Isopreno: Propiedades, Producción y Usos
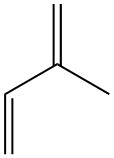
El isopreno, también conocido como 2-metil-1,3-butadieno, es un hidrocarburo de cinco carbonos que existe en la naturaleza en niveles traza. Es un líquido incoloro y volátil con la fórmula química C5H8.
El isopreno se utiliza como componente fundamental de numerosos productos naturales. Estos incluyen terpenos (caucho natural, alcanfor), vitamina A y hormonas sexuales esteroides (siguiendo la «regla del isopreno» de Wallach y Ruzicka). Fue sintetizado por primera vez mediante pirólisis de caucho natural en 1860 por Williams.
Tabla de contenido
1. Propiedades físicas del isopreno
En condiciones normales, el isopreno es un líquido volátil e incoloro que es insoluble en agua a 20 °C. Es miscible con disolventes orgánicos como etanol, éter dietílico, acetona y benceno.
El isopreno forma mezclas azeotrópicas binarias con diversos compuestos como metanol, n-pentano, disulfuro de carbono, formiato de metilo, bromoetano, etanol, sulfuro de dimetilo, acetona, óxido de propileno, formiato de etilo, nitrito de isopropilo, metilal, éter dietílico, perfluorotrietilamina, acetonitrilo y isopropilamina.
Las propiedades físicas importantes del isopreno se detallan en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Peso molecular | 68,118 g/mol |
| Punto de fusión (101,3 kPa) | -145,95 °C |
| Punto de ebullición (101,3 kPa) | 34.059°C |
| Temperatura crítica | 483,3 K |
| Presión crítica | 3,74 MPa |
| Volumen crítico | 266 cm3/mol |
| Densidad (293 K) | 0,68095 g/cm3 |
| Viscosidad (293 K) | 0,216 mPa.s |
| Tensión superficial (293 K) | 18,22 mN/m |
| Índice de refracción | 1.42194 |
| Presión de vapor | |
| -20 °C | 9,8 kPa |
| 0 °C | 26,4 kPa |
| 20 °C | 60,7 kPa |
| 34.059°C | 101,3 kPa |
| 40 °C | 123,8kPa |
| 60°C | 229,1 kPa |
| 80 °C | 392,1 kPa |
| 100°C | 629,5kPa |
| Calor específico | |
| Vapor (298 K) | 102,69 J mol-1 K-1 |
| Líquido (298 K) | 151,07 J mol-1 K-1 |
| Límites de explosividad en el aire (presión total 13 kPa, 25 °C) | |
| Límite superior | 7 – 9,7 % en volumen (200 – 275 g/m3) |
| Límite inferior | 1 – 1,5 % en volumen (28 – 40 g/m3) |
| Presión máxima de explosión | 0,66 MPa |
2. Propiedades químicas del isopreno
El análisis espectroscópico indica que a 50 °C, la mayoría de las moléculas de isopreno existen en la conformación s-trans. Sólo el 15% adopta la forma s-cis de mayor energía.
Como dieno conjugado, el isopreno presenta un comportamiento característico. La presencia de un grupo metilo mejora su reactividad con electrófilos y dienófilos de Diels-Alder en comparación con el butadieno.
El isopreno es más reactivo que el butadieno debido a sus cuatro átomos de hidrógeno únicos en comparación con los dos del butadieno. El isopreno participa en una amplia gama de reacciones, incluidas la sustitución, la adición, la formación de anillos, la complejación y la telomerización.
La reacción con radicales hidroxilo es la vía dominante para la degradación del isopreno en la atmósfera. Los radicales hidroxilo, moléculas altamente reactivas, inician una compleja reacción en cadena que descompone el isopreno en varios productos. También puede ser descompuesto por el ozono.
Bajo altas temperaturas y condiciones específicas, el isopreno forma peróxidos y radicales libres, lo que en última instancia conduce a la descomposición del isopreno en diferentes productos como dimetoximetano y naftaleno.
El isopreno puede sufrir reacciones de adición similares a las de los alquenos, pero no es selectivo y da como resultado una mezcla de productos.
La única reacción química importante del isopreno es su conversión en terpenos. El isopreno se utiliza principalmente en la síntesis de polímeros.
3. Producción de isopreno
3.1. Producción de isopreno a partir de olefinas
El isopreno se produce principalmente mediante la reacción de Prins catalizada por ácido de formaldehído con isobuteno, produciendo 4,4-dimetil-1,3-dioxano, que luego se escinde en la fase gaseosa (a 200 – 300 °C) para producir isopreno y recuperarse. la mitad del formaldehído.
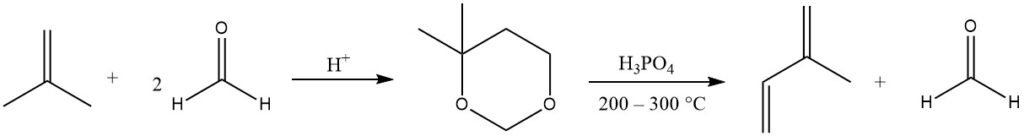
Varias empresas refinaron este proceso debido a la disponibilidad de materiales de partida. Actualmente existen instalaciones de producción de este tipo en Japón.
Los esfuerzos se han centrado en simplificar y mejorar la rentabilidad de la síntesis de isopreno a partir de isobuteno y formaldehído. Takeda Chemical en Japón propuso un proceso en fase gaseosa de un solo paso utilizando catalizadores de óxido.
Los subproductos del formaldehído plantean un desafío. Empresas como Idemitsu y Sun Oil utilizan derivados del formaldehído (metilal, dimetoximetano) para evitar la formación de resina. Los métodos alternativos implican integrar la producción de formaldehído directamente en el proceso utilizando metanol y oxígeno o metil terc-butil éter (MTBE) y oxígeno.
Las patentes japonesas exploraron el alcohol terc-butílico como fuente de C4, mientras que las publicaciones soviéticas anteriores describían métodos basados en la escisión de 1,3-dioxano.
El proceso en fase gaseosa de un solo paso está limitado por el bajo rendimiento espacio-temporal del catalizador y su rápida desactivación. No está claro si alguna de estas variaciones ha llegado a la producción comercial.
El 2-metilbutanal es otra materia prima para producir isopreno. Se produce mediante hidroformilación de 2-buteno utilizando un catalizador de rodio.
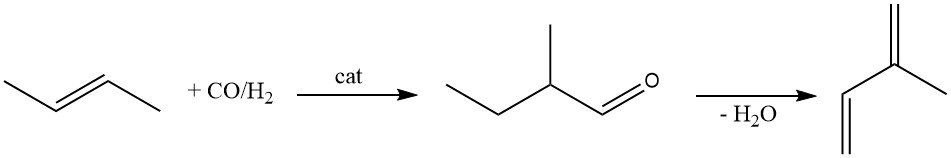
La deshidratación catalítica de 2-metilbutanal a isopreno se ha estudiado ampliamente. Si bien se han propuesto numerosos catalizadores (β-fosfato, fosfato magnésico y amónico, tamices moleculares y zeolitas), todos sufren una rápida pérdida de actividad.
Sin embargo, las zeolitas modificadas con silano o cesio muestran una vida útil mejorada. La escisión de 3-metilbutanal produjo peores resultados. Actualmente, ninguna instalación industrial utiliza la síntesis de isopreno a partir de 2-metilbutanal.
La codimerización de etileno y propeno conduce a 2-metil-1-buteno, que puede deshidrogenarse a isopreno, pero este método permanece en la etapa experimental.
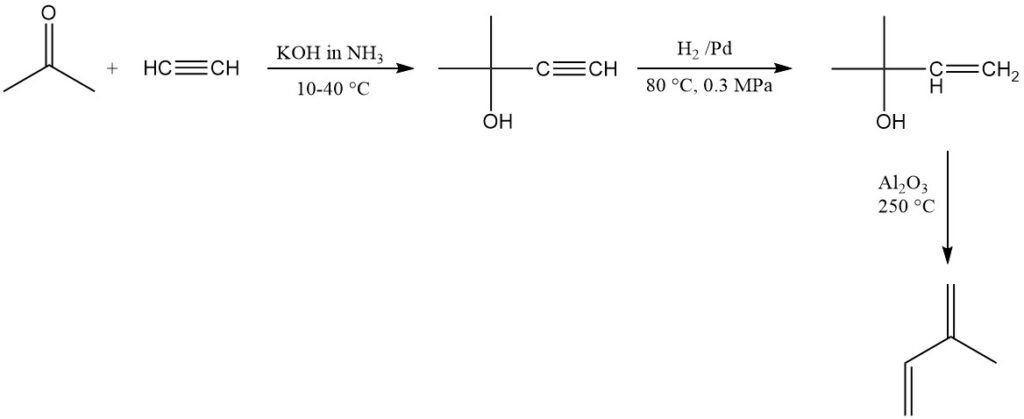
SNAM en Italia produce comercialmente isopreno utilizando acetileno y acetona, pero la planta ya no está operativa. Existe una planta similar en Sudáfrica. Este método produce isopreno de alta pureza pero es relativamente caro.
El proceso Goodyear-Scientific Design produjo isopreno mediante dimerización de propeno a 2-metil-1-penteno, seguida de isomerización a 2-metil-2-penteno y posterior craqueo. La primera síntesis comercial de isopreno utilizó este método (Beaumont, Texas), pero la producción cesó en 1975 debido al aumento de los costos del propeno.
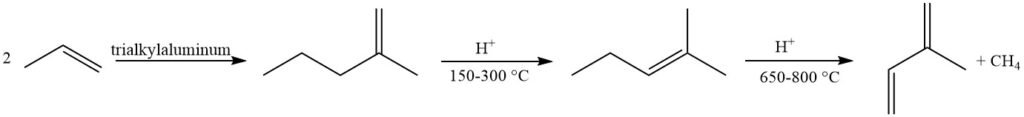
La metátesis de olefinas ofrece un enfoque atractivo utilizando petroquímicos fácilmente disponibles. Una fracción de buteno se convierte en 2-metil-2-buteno y propeno, con la posterior deshidrogenación del 2-metil-2-buteno en isopreno. Sin embargo, este método adolece de formación de subproductos debido a reacciones entre varias olefinas en el reactor.
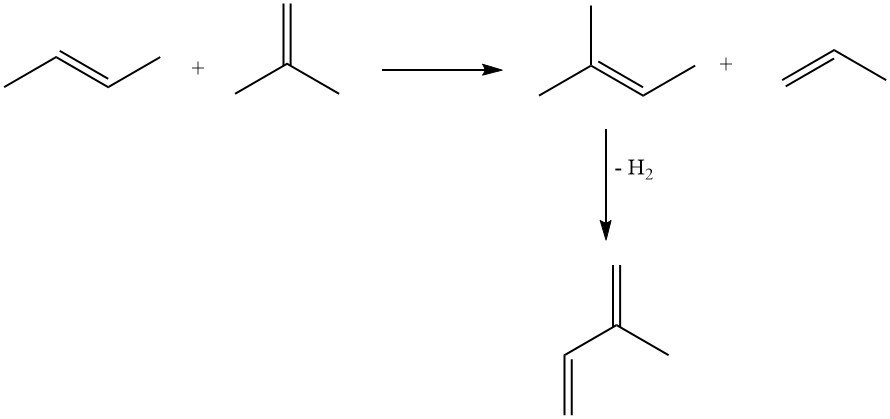
3.2. Producción de isopreno mediante deshidrogenación de isopentano o metilbutenos
El isopreno se puede producir mediante la deshidrogenación de isopentano o metilbutenos (isopentenos). Estas reacciones son similares a la deshidrogenación de n-butano y n-butenos a butadieno.
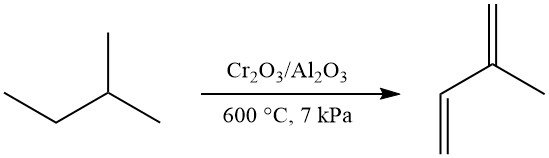
La deshidrogenación en un solo paso de isopentano a isopreno se puede lograr mediante el proceso Houdry-Catadieno (catalizador de Cr2O3/Al2O3, ~600 °C, ~7 kPa), lo que produce un 52 % de isopreno. Este método se utilizó comercialmente en la antigua Unión Soviética.
En los Estados Unidos y los Países Bajos existían plantas de producción de isopreno basadas en la deshidrogenación de metilbuteno, pero actualmente no están operativas.
El material de partida normalmente se extrae de los gases residuales del cracker mediante el procedimiento Sinclair (extracción con ácido sulfúrico seguida de retroextracción con parafinas).
La deshidrogenación se realiza con un catalizador Shell (Fe2O3-K2CO3-Cr2O3) a 600 °C con dilución con vapor y se logra un rendimiento del 85% de isopreno.
Se ha explorado la deshidrogenación oxidativa tanto de isopentano como de metilbutenos. Se han informado rendimientos y selectividades del 60% y del 95% para el isopreno. Para la deshidrogenación oxidativa de metilbutenos a isopreno se utilizan catalizadores de silicato dopados con óxidos alcalinotérreos u óxidos de níquel, hierro o cobalto.
3.3. Recuperación de isopreno a partir de fracciones de craqueo C5
El isopreno se puede recuperar a partir de subproductos C5 de la pirólisis de hidrocarburos en la producción de etileno. El craqueo de nafta produce «gasolina de crack» con bajo contenido de isopreno y otros hidrocarburos C5, principalmente aromáticos C6-C8.
La destilación separa esta mezcla en fracciones C5 y aromáticas. El rendimiento de isopreno suele ser de 2 a 5% en peso basado en etileno, y aumenta con materias primas más pesadas como el gasóleo. El rendimiento de isopreno disminuye con una mayor severidad de craqueo (temperatura/tiempo de residencia), pero su concentración en la fracción C5 aumenta. La recuperación de isopreno a partir de fracciones de crack es más eficiente energéticamente que la síntesis química.
Las materias primas de craqueo más pesadas para la producción de etileno generarán más subproductos de isopreno. Algunos craqueadores sólo recuperan una fracción aromática de la gasolina de craqueo, mientras que el residuo C5 a menudo se recicla con la fracción C4 en la alimentación del craqueador.
El aislamiento puro de isopreno de la fracción C5 no se puede lograr mediante destilación simple debido a los puntos de ebullición similares de los componentes y a la formación de un azeótropo con n-pentano. El enriquecimiento por destilación al 25-50% se utiliza comercialmente para reducir los costos de transporte y separación.
Las técnicas de separación para producir isopreno puro son la destilación azeotrópica, el aislamiento químico y la destilación extractiva utilizando disolventes como N-metilpirrolidona, dimetilformamida y acetonitrilo.
En la Figura 1 se ilustra un proceso simple de aislamiento de isopreno.
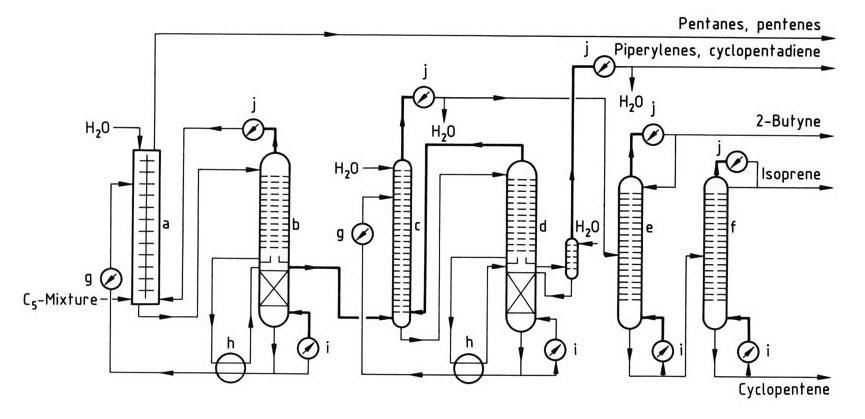
a) Columna de extracción líquido – líquido; b) – d) Columnas para destilación extractiva; e) columna de butino; f) columna de isopreno; g) Enfriador; h) Intercambiador de calor; i) Caldero; j) Condensador
El primer paso es una combinación de extracción líquido-líquido y destilación extractiva, particularmente adecuada para fracciones C5 con bajo contenido de isopreno. La preconcentración de isopreno se produce en el extractor, seguida de la eliminación del isopreno bruto de la columna de destilación extractiva.
La destilación extractiva posterior elimina los piperilenos y el ciclopentadieno. La purificación final para isopreno de grado de polimerización se logra en columnas de destilación adicionales. Este proceso permite procesar fracciones C5 que contienen ciclopentadieno, que se elimina con piperilenos.
El proceso se puede adaptar para aislar ciclopentadieno o ciclopenteno con equipo adicional, y los piperilenos puros se pueden recuperar con una columna suplementaria.
4. Usos del isopreno
4.1. Uso de isopreno en la síntesis de polímeros
El poli(cis-1,4-isopreno) (caucho de isopreno, IR), particularmente el tipo catalizado por titanio, es la aplicación principal del isopreno. Este caucho sintético se parece mucho al caucho natural en estructura y propiedades. El caucho de isopreno se utiliza principalmente en la producción de neumáticos para vehículos.
El poli(trans-1,4-isopreno) tiene propiedades similares a la gutapercha o la balata, lo que limita sus aplicaciones comerciales principalmente al aislamiento de cables y pelotas de golf.
El segundo mercado más grande para el isopreno es la producción de copolímeros en bloque de estireno-isopreno-estireno (SIS), un tipo de elastómero termoplástico. Se consumen entre 0,79 y 0,88 toneladas de isopreno por tonelada de polímero SIS. Estos copolímeros se utilizan como cauchos termoplásticos y adhesivos sensibles a la presión o termoestables.
Se utilizan cantidades más pequeñas de isopreno en la producción de caucho de butilo (caucho de isobuteno-isopreno, IIR), un copolímero con isobuteno. El contenido de isopreno en el caucho de butilo oscila entre 0,5 y 3,0% en moles. IIR es conocido por su baja permeabilidad a los gases, lo que lo hace adecuado para mangueras y revestimientos de neumáticos sin cámara.
Finalmente, se pueden producir resinas de hidrocarburos (resinas de petróleo) copolimerizando isopreno a partir de fracciones de craqueo C5 libres de ciclopentadieno con otros compuestos C5 insaturados.
4.2. Uso de isopreno en la síntesis de terpenos
Mientras que el isopreno sufre diversas reacciones químicas, sólo la síntesis de terpenos tiene importancia industrial y se investiga activamente.
En 1972, Rhodia comenzó a desarrollar un proceso para la síntesis de terpenos C10 y derivados a partir de isopreno, acetona y acetileno. El isopreno reacciona con el ácido clorhídrico para formar cloruro de prenilo, que luego se convierte en deshidrolinalool en dos pasos.
Rhodia utilizó deshidrolinalool para diversas síntesis, pero interrumpió la producción. Sin embargo, Kuraray en Japón continúa produciendo estos compuestos, escualano y otros a partir de isopreno.
Rhodia utilizó previamente una síntesis de Grignard para producir el alcohol terpénico C10 lavandulol a partir de dos moléculas de isopreno.
El isopreno reacciona mediante oligomerización o telomerización para formar terpenos. Los ejemplos incluyen la oligomerización lineal científica e industrialmente relevante de isopreno a mirceno y la telomerización con N,N-dietilnerilamina (ambos terpenos C10).
Los terpenos naturales consisten en unidades de isopreno dispuestas «de cabeza a cola» con posiciones de doble enlace específicas. La producción de terpenos a partir de isopreno requiere replicar esta estructura, lo que hace que la síntesis de terpenos C10 a partir de isopreno sea generalmente menos favorable que las rutas alternativas. La composición del catalizador puede influir en la estructura de los dimetiloctadienos sintetizados a partir de isopreno.
Takabe et al. informaron la síntesis de mirceno mediante oligomerización de isopreno utilizando un catalizador de sodio/dialquilamina. Nissan Chemical Industries desarrolló y anunció la producción industrial de mirceno utilizando este método.
La telomerización del isopreno se produce con varios compuestos, incluidos el amoníaco o las aminas. La regioselectividad se puede manipular variando la cantidad y concentración de los ácidos de Brønsted y Lewis en el catalizador.
El isopreno reacciona con dietilamina para formar N,N-dietilnerilamina mediante una reacción de telomerización catalizada por butil-litio. Otras reacciones de N,N-dietilnerilamina producen linalol, geraniol, nerol, hidroxicitronelal, citronelal y mentol (Figura 2).
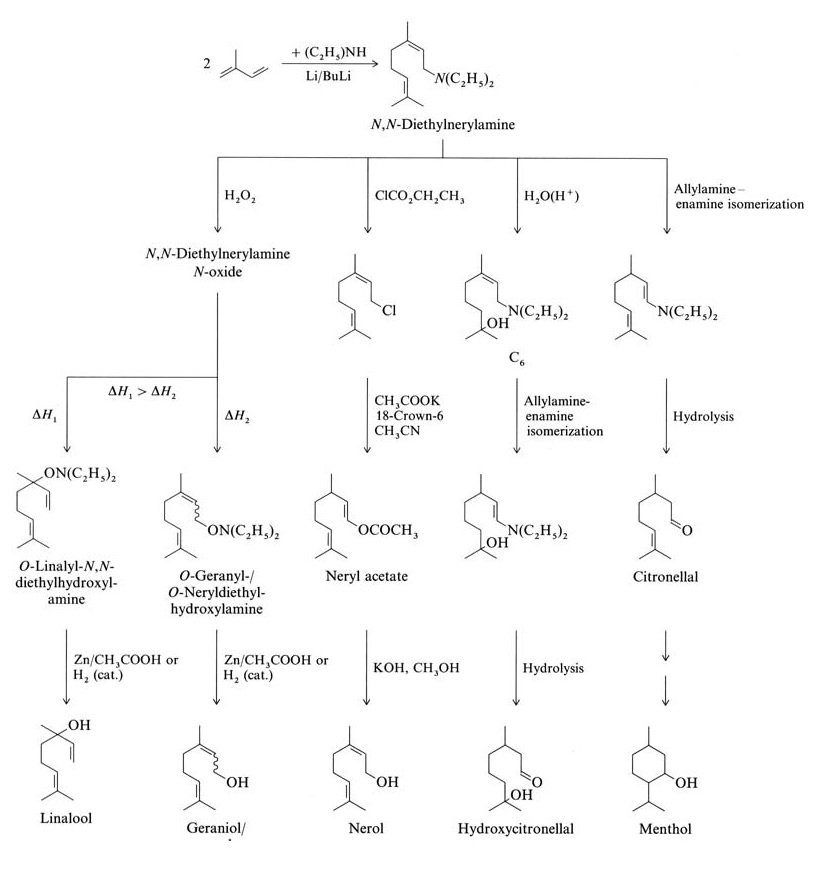
La Takasago Perfumery Company de Japón utiliza una síntesis industrial de L-mentol enantioméricamente puro a partir de citronelal ópticamente activo. Este proceso implica la isomerización asimétrica alilamina-enamina de N,N-dietilgeranilamina o N,N-dietilnerilamina con un catalizador Rh-BINAP.
5. Toxicología del isopreno
Toxicidad aguda
La exposición a altos niveles de isopreno provoca efectos anestésicos en los animales, provocando parálisis y muerte. Las exposiciones por inhalación únicas de 2 horas en ratones (56.000 mg/m³) no mostraron efectos adversos. Los niveles de 98.000 a 126.000 mg/m³ indujeron una narcosis profunda, y la exposición a 140.000 mg/m³ durante 2 horas provocó mortalidad (CL50 = 180.000 mg/m³ para ratas).
La concentración umbral de irritación en gatos es de 800 mg/m³. Se determinó que los valores de LD50 oral e intraperitoneal en ratas macho eran 2100 mg/kg y 1400 mg/kg, respectivamente, para el isopreno líquido. La exposición dérmica única (1 ml/kg) en ratas no causó mortalidad ni síntomas adversos.
Toxicidad por exposición repetida
Se expusieron ratas y ratones a 0, 438, 875, 1750, 3500 y 7000 ppm de isopreno durante dos semanas mediante inhalación. Las ratas no mostraron cambios relacionados con la exposición.
Los ratones expuestos a 7000 ppm mostraron un menor aumento de peso corporal, mientras que todos los grupos mostraron anemia, atrofia testicular, degeneración epitelial olfatoria y cambios hiperplásicos epiteliales en el estómago. Al igual que el 1,3-butadieno, los ratones parecen ser más susceptibles que las ratas.
La exposición dérmica repetida (500 mg x 2 aplicaciones/día durante 5 días) en orejas de conejo causó sólo una irritación leve y reversible. No se dispone de datos sobre exposición por inhalación a largo plazo.
mutagenicidad
El isopreno y sus monoepóxidos no son mutagénicos en la prueba de Ames. Sin embargo, el dióxido de isopreno (2-metil-1,2,3,4-diepoxibutano) mostró mutagenicidad en este sistema de prueba.
Debido a las posibles similitudes con el 1,3-butadieno en la generación de metabolitos mutagénicos, se justifica una evaluación adicional de la carcinogenicidad del isopreno.
La exposición por inhalación de ratones a 438–7000 ppm de isopreno durante 6 h/día durante 12 días dio lugar a un aumento de las frecuencias de intercambio de cromátidas hermanas, lo que indica efectos citogenéticos.
No se dispone de datos sobre efectos reproductivos o teratogénicos.
Metabolismo
Las fracciones mitocondriales de roedores convierten el isopreno en sus monoepóxidos (3,4-epoxi-3-metil-1-buteno y 3,4-epoxi-2-metil-1-buteno), dando lugar a los correspondientes dioles. Se ha informado de una oxidación menor del metabolito más estable (3,4-epoxi-2-metil-1-buteno) a diepóxido.
El isopreno sufre un metabolismo significativo en el tracto respiratorio. La exposición a isopreno atmosférico de hasta 300 ppm muestra una proporcionalidad directa entre la concentración de exposición y el metabolismo. Los efectos de saturación ocurren por encima de 300 a 500 ppm. Los ratones metabolizan el isopreno a un ritmo más rápido que las ratas.
Se ha observado síntesis endógena de isopreno. Se estima que las tasas de síntesis en ratones y ratas no expuestas son de 0,4 mmol h⁻¹ kg⁻¹ y 1,9 mmol h⁻¹ kg⁻¹, respectivamente.
Efectos humanos
En niveles de exposición muy altos, el isopreno actúa como narcótico en humanos. También puede irritar la piel, los ojos, las membranas mucosas y el tracto respiratorio.
Normas higiénicas
No se ha establecido ningún valor límite umbral (TLV) ni concentración máxima permitida (MAK) para el isopreno. La antigua Unión Soviética fijó un umbral de 40 mg/m³.
Referencias
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812
