Hidracina: Propiedades, Reacciones y Usos

En 1875, EMIL FISCHER hizo una predicción sobre la presencia de hidracina H2N-NH2. En 1887, CURTIUS logró aislarlo. Luego, en 1893, DE BRUYN logró aislar la hidracina anhidra.
RASCHIG inventó el primer proceso de producción comercial en 1907, que todavía se utiliza en Japón, Rusia, China y Corea.
El uso extensivo de hidracina y sus derivados como agentes espumantes para espumas plásticas condujo a la aparición de diversas aplicaciones industriales, como el tratamiento de agua de calderas, iniciadores de polimerización, pesticidas, productos farmacéuticos, productos químicos fotográficos y tintes.
Incluso después de un siglo de su descubrimiento, la síntesis de hidracina sigue siendo un desafío debido principalmente a limitaciones termodinámicas. La mayor parte de la hidracina se fabrica mediante versiones modificadas del proceso Raschig, que implica la oxidación del amoníaco con hipoclorito.
Sin embargo, las plantas más nuevas construidas desde 1980 emplean el proceso PCUK, que utiliza peróxido de hidrógeno como oxidante.
La hidrazina se vende principalmente en forma de solución acuosa que contiene hasta un 64% de concentración, correspondiente al hidrato de hidrazina N2H4·H2O.
Tabla de contenido
1. Propiedades físicas de la hidracina
La hidrazina es un líquido incoloro con olor a amoníaco. Muestra completa miscibilidad con agua y forma soluciones acuosas altamente alcalinas.
En particular, propiedades específicas como la viscosidad y la densidad alcanzan sus valores máximos cuando la composición está al 64%, lo que indica la presencia de la forma monohidrato, N2H4·H2O, tanto en la fase sólida como en la líquida.
La hidrazina forma un azeótropo (punto de ebullición 120,5 °C) con agua, donde la mezcla azeotrópica contiene 58,5 % en moles de hidracina.
La hidracina es un compuesto endotérmico, con un calor de formación de +50,6 kJ/mol. Sus límites de explosividad en el aire oscilan entre el 4,7% y el 100%. El límite superior indica que la hidracina anhidra es capaz de autoexplotar.
Sin embargo, diluirlo con un gas inerte como nitrógeno o agua reduce significativamente el rango de inflamabilidad al aumentar el límite explosivo inferior. En consecuencia, el hidrato de hidracina (que contiene 30,9 % en volumen de hidracina) se puede manipular de forma segura a presión atmosférica y 120 °C en ausencia de aire.
A continuación se proporciona una descripción general de ciertas propiedades físicas de la hidracina:
- Masa molar = 32,05 g/mol
- punto de fusión = 2 °C
- punto de ebullición = 113,5 °C
- densidad = 1,0045 g/ml
- Índice de refracción = 1,4644 a 25 °C
- viscosidad = 0,974 μPa.s
- pH (en solución de agua al 65%) = 12,75
2. Reacciones químicas de la hidracina
Las propiedades químicas de la hidracina están fuertemente influenciadas por las siguientes características: su naturaleza endotérmica, alcalinidad y fuertes propiedades de agente reductor.
2.1. Descomposición térmica
Una descomposición significativa de la hidracina requiere una temperatura relativamente alta (250 °C) en ausencia de catalizadores. Sin embargo, la presencia de ciertos catalizadores como cobre, cobalto, molibdeno y sus óxidos reduce la temperatura de descomposición. Por lo tanto, es necesario manipular con precaución la hidracina.
2.2. Reacciones ácido-base
La hidracina actúa como una base débil y reacciona con el agua:

2.3. Agente reductor
La hidracina muestra fuertes propiedades de agente reductor y reacciona exotérmicamente con el oxígeno:
Muchas aplicaciones de la hidracina se basan en esta reacción. La oxidación de la hidracina por el aire en soluciones alcalinas está catalizada por varios metales. Por lo tanto, las soluciones de hidracina deben destilarse en ausencia o desactivación de cobre, metales polivalentes o sus sales. Los óxidos de cadmio, magnesio, zinc y aluminio proporcionan estabilización contra la oxidación aérea en soluciones de hidracina.
En soluciones ácidas, la hidracina reacciona con los halógenos:

Estas reacciones resultan útiles para determinar N2H4 (usando yodo), purificar haluros de hidrógeno crudos y eliminar trazas de halógenos en aguas residuales. Se puede emplear el mismo procedimiento para eliminar restos de hidracina. El hipoclorito de sodio o el peróxido de hidrógeno, en presencia de sales de hierro (III) o cobre (II), son opciones convenientes para el tratamiento de desechos o derrames.
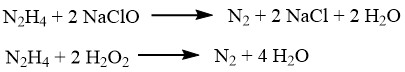
La hidrazina puede reducir diversos iones u óxidos metálicos como cobre, plata, oro, mercurio, níquel y platino, transformándolos en metales pulverulentos.
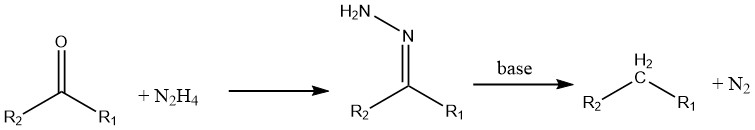
Las cetonas y los aldehídos se reducen en presencia de hidracina (conocida como reacción de Wolff-Kishner).
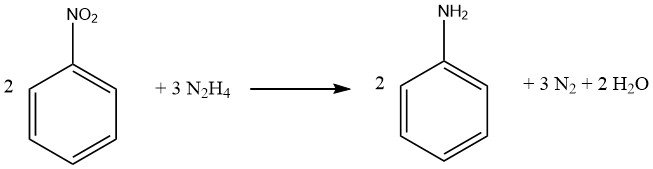
Los compuestos nitro aromáticos se pueden reducir a sus aminas correspondientes utilizando hidracina y un catalizador de hidrogenación como el níquel Raney.
La hidracina se oxida a diimida en presencia de peróxido de hidrógeno. Luego, la diimida reduce los acetilenos a cis-alquenos e hidrogena los dobles enlaces residuales en el caucho de acrilonitrilo–butadieno.

2.4. Reacciones de diamina
La hidrazina encuentra un amplio uso en la síntesis y producción de diversos compuestos nitrogenados heterocíclicos y de cadena abierta, incluidos hidrazo y compuestos azo, pirazoles, triazoles, urazoles, tetrazoles, piridazinas y triazinas.
3. Usos de la hidracina
La mayor parte de la hidracina disponible se vende como solución en agua. La hidracina anhidra, por el contrario, se utiliza principalmente como combustible para cohetes o como mono o bipropulsor para satélites y naves espaciales.
Aproximadamente el 80-90% de la producción de hidracina se convierte en derivados orgánicos. Otras de sus aplicaciones se basan en su papel como agente reductor, como compuesto rico en energía o en su capacidad de almacenamiento de hidrógeno.
Los usos importantes de la hidracina y sus derivados incluyen su uso como iniciadores de polimerización y agentes espumantes para plásticos espumados, así como en la producción de pesticidas. También se utilizan como componentes sintéticos, productos farmacéuticos, propulsores y bolsas de aire para automóviles.
3.1. Agentes espumantes
La producción industrial de agentes espumantes a base de hidracina es sustancial, y el consumo de hidrato de hidracina para este fin alcanzó las 50.000 toneladas por año en 1998. Estos agentes espumantes son principalmente derivados hidrazo o azo, obteniéndose estos últimos mediante oxidación de los primeros utilizando cloro o peróxido de hidrógeno. .
Cuando se calientan, los agentes espumantes se descomponen, liberando nitrógeno y otros gases, que crean un efecto espumante en los polímeros, lo que resulta en la formación de poros o células.
Se encuentran disponibles varios agentes espumantes a base de hidracina producidos comercialmente y su temperatura de descomposición depende de factores como el tamaño de las partículas, el pH y la presencia de agentes activadores como sales de bario, cadmio o zinc.
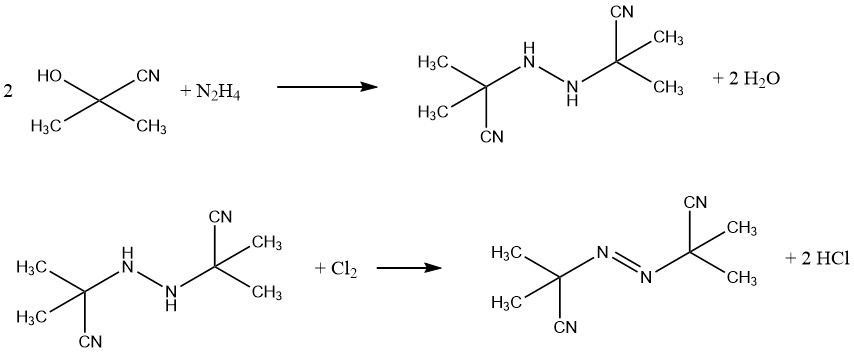
Un ejemplo de agente espumante comercial es el azobis(isobutironitrilo) (AIBN), utilizado para productos de caucho esponjoso y espumas de PVC. También actúa como fuente de radicales libres en el inicio de la polimerización. AIBN se sintetiza a partir de acetona cianhidrina e hidracina, seguido de oxidación con cloro.
La azodicarbonamida es otro importante agente espumante producido a partir de urea e hidracina.

La hidrazodicarbonamida intermedia se puede obtener directamente a partir de urea e hipoclorito de sodio o mediante oxidación con cloro o peróxido de hidrógeno en presencia de una pequeña cantidad de iones bromuro en un medio ácido.
La azodicarbonamida es el agente espumante más utilizado debido al gran volumen de gas que se desprende durante la descomposición y a sus características seguras.
Para cumplir con los requisitos de la fabricación de nuevos cauchos o materiales plásticos porosos, en la década de 1950 se introdujeron las hidrazidas de ácido sulfónico.
Estas hidrazidas son superiores a los agentes de soplado inorgánicos utilizados anteriormente (por ejemplo, nitrito de amonio, bicarbonato de amonio, bicarbonato de sodio) en términos de dispersión, mayor tolerancia a la temperatura y estructura celular de espuma mejorada.
También son incoloros, inodoros y seguros, con productos de descomposición que no favorecen la combustión. Las mono y dihidrazidas de ácido sulfónico se producen a partir de hidrato de hidrazina y el correspondiente cloruro de ácido sulfónico.
3.2. bolsas de aire
La azida de sodio se utiliza comúnmente como precursor de gas en la tecnología de las bolsas de aire. Un proceso de fabricación de azida sódica implica hidrazina y un nitrito de alquilo. Para la misma aplicación se está desarrollando otro derivado de hidrazina, el 5-aminotetrazol, obtenido a partir de sales de aminoguanidina.
3.3. Iniciadores de polimerización por radicales libres
Los compuestos azo, particularmente los azodinitrilos simétricos, se usan ampliamente como iniciadores de polimerización por radicales libres.
Estos compuestos azo se sintetizan a partir de hidrazina, una cetona y cianuro de hidrógeno (HCN). El derivado hidrazo se oxida usando cloro o peróxido de hidrógeno en presencia de un catalizador de bromuro.
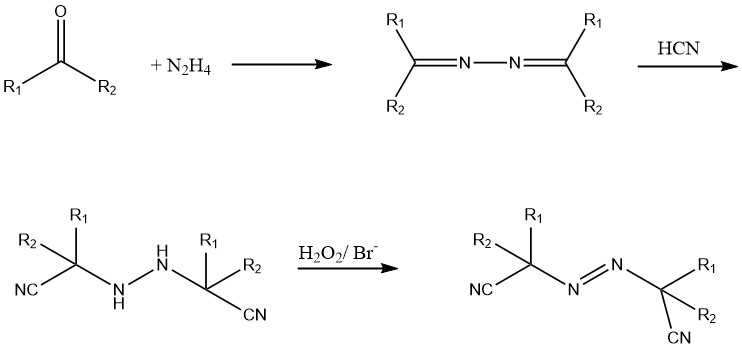
Actualmente se están desarrollando compuestos solubles en agua como el diclorhidrato de 2,2′-azo bis (2-aminopropano) y compuestos azo líquidos como el 2,2′-azobisisobutirato de dietilo.
3.4. Pesticidas
Los pesticidas a base de hidracina constituyen una parte importante del consumo de hidracina. El primer ejemplo es la hidrazida maleica, sintetizada haciendo reaccionar anhídrido maleico con hidrazina.
Otro herbicida de uso general es el 3-amino-1,2,4-triazol, obtenido a partir de cianamida, hidrato de hidrazina y ácido fórmico. Este herbicida se utiliza selectivamente en viñedos y huertas, alcanzando un consumo de varios miles de toneladas al año.
Se producen comercialmente numerosos compuestos a base de hidrazina para aplicaciones de pesticidas, principalmente compuestos heterocíclicos como triazinas, oxadiazoles, pirazoles, piridazinas y tiadiazoles.
3.5. Productos farmacéuticos
Aunque representa un pequeño porcentaje de la producción total de hidracina, el uso de hidracina en productos farmacéuticos es significativo. Por ejemplo, la isoniazida, la hidrazida del ácido isonicotínico, se utilizó por primera vez en la década de 1950 para tratar la tuberculosis.
En las décadas de 1980 y 1990, se introdujeron otros productos farmacéuticos a base de hidracina que contenían el grupo 1,2,4-triazol, que sirvieron como antidepresivos, antihipertensivos y agentes antibacterianos o antifúngicos.
Los avances recientes se han centrado en productos farmacéuticos que contienen el grupo 4-amino-1,2,4-triazol, que demuestran una mayor eficacia.
3.6. Tratamiento de aguas
La hidracina se utiliza en el tratamiento del agua para proteger el acero de la corrosión en las calderas. Cuando la hidracina reacciona con el óxido de hierro (III), forma magnetita, que sirve como capa protectora contra la corrosión del agua y el oxígeno.
Las concentraciones de hidracina residual inferiores a 0,1 ppm garantizan una protección total contra la corrosión. Las formulaciones de hidrato de hidracina catalizada disponibles comercialmente, conocidas como hidracina activada, son eficaces incluso a temperatura ambiente.
3.7. Propulsores
El uso inicial a gran escala de la hidracina fue como combustible para cohetes. La hidrazina anhidra es un excelente propulsor, y sólo el hidrógeno supera su impulso específico.
Los propulsores de cohetes actuales incluyen hidracina anhidra, monometilhidrazina y dimetilhidrazina asimétrica, utilizados predominantemente como combustibles bipropulsores en cohetes como Titan o Ariane.
La hidracina anhidra también sirve como monopropulsor para satélites y naves espaciales. Su descomposición sobre un catalizador produce una mezcla de gases.
Los catalizadores, a menudo basados en iridio o rutenio depositados sobre alúmina, se clasifican en espontáneos (que funcionan a temperatura ambiente) o no espontáneos (que funcionan por encima de 100 °C).
3.8. Celdas de combustible
Se han realizado extensas investigaciones sobre pilas de combustible que utilizan la oxidación de hidracina con oxígeno o peróxido de hidrógeno. Sin embargo, su uso se limita principalmente a aplicaciones militares debido al costo del hidrato de hidracina.
Referencia
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
