Fabricación industrial de cresoles
Desde 1965, la producción sintética de cresoles ha aumentado considerablemente, reemplazando la recuperación del alquitrán de hulla y los cáusticos de refinería debido a la creciente demanda. Los cresoles se producen principalmente mediante diferentes procesos, como la fusión alcalina de toluenosulfonatos, la hidrólisis alcalina de clorotolueno, la descomposición del hidroperóxido de cimeno y la metilación en fase de vapor del fenol.
Los tres primeros procesos utilizan tolueno como materia prima y son extensiones de los métodos establecidos de síntesis de fenol. Sin embargo, la metilación del fenol es una ruta específica para la producción de cresol y xilenol.
Cada proceso genera una distribución distintiva de isómeros de cresol, y todos son de importancia individual.
Tabla de contenido
1. Producción de cresol mediante fusión alcalina de toluenosulfonatos
La fusión alcalina es un importante método industrial utilizado principalmente para la síntesis de p-cresol. Este proceso consta de cuatro pasos de reacción distintos:
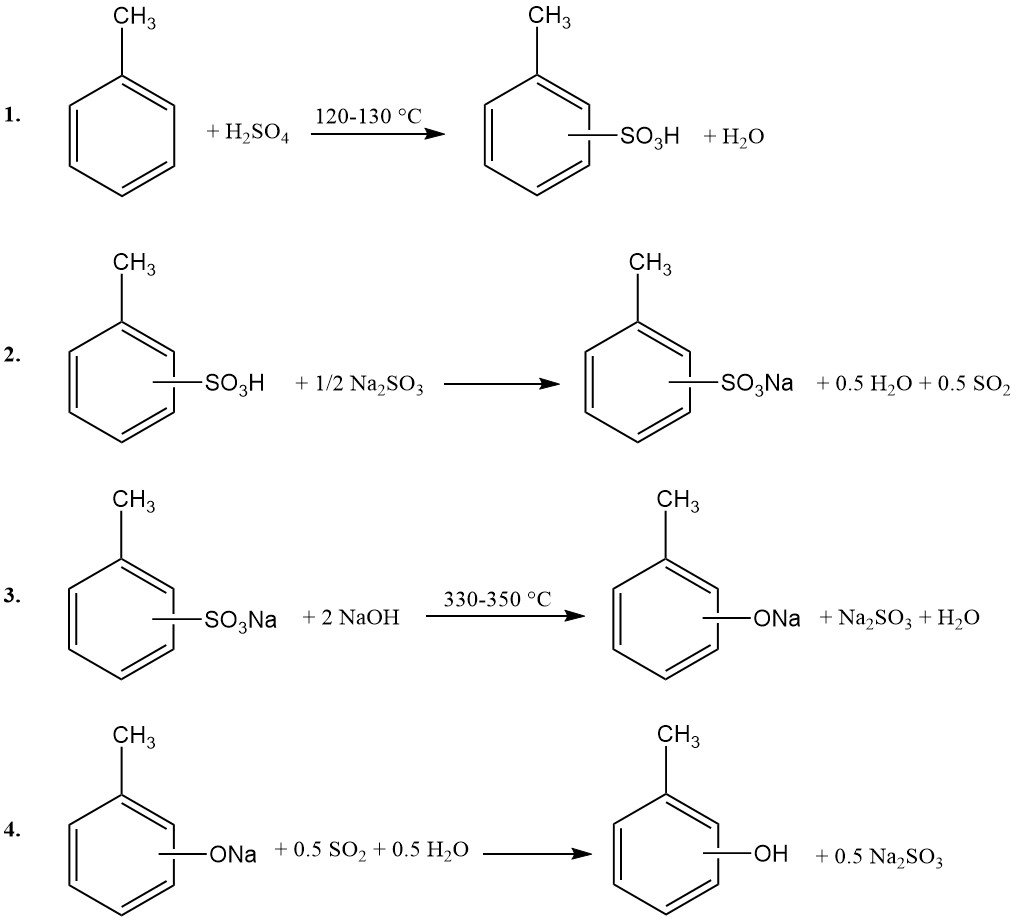
1. Sulfonación de tolueno: El tolueno reacciona con ácido sulfúrico concentrado a 120-130 °C a presión atmosférica. Para asegurar el consumo completo del ácido sulfúrico, el agua generada en la reacción se elimina azeotrópicamente con el exceso de vapor de tolueno.
2. Neutralización: La mezcla de ácido toluenosulfónico resultante se neutraliza con sulfito de sodio o hidróxido de sodio.
3. Fusión alcalina: El toluenosulfonato de sodio se fusiona posteriormente con un exceso de hidróxido de sodio a 330-350 °C.
4. Acidificación: El producto fundido se disuelve en agua y se filtra el sulfito de sodio insoluble. A continuación, la fase acuosa se acidifica con dióxido de azufre (reciclado del paso 2) o ácido sulfúrico.
La etapa de acidificación produce una solución acuosa de sulfito de sodio, que se recicla a la unidad de neutralización, y una fase de cresol crudo. Este cresol crudo se deshidrata mediante destilación azeotrópica. La configuración de la planta y del proceso es muy similar a la utilizada previamente para la síntesis de fenol mediante la fusión alcalina del bencenosulfonato de sodio.
La destilación fraccionada del cresol crudo deshidratado produce fenol, o-cresol, una mezcla de m-/p-cresol y un residuo que contiene ditolilsulfonas, xilenoles y otros fenoles superiores. Las ditolilsulfonas son subproductos de la sulfonación, mientras que los fenoles y xilenoles se forman en cantidades menores durante la fusión alcalina.
La distribución de isómeros del cresol se ve afectada principalmente por las condiciones de sulfonación. Las composiciones típicas incluyen entre un 6 % y un 12 % de o-cresol, un 6 % y un 12 % de m-cresol y un 80 % y un 85 % de p-cresol. Tras la eliminación del o-cresol por destilación, se puede obtener p-cresol con una pureza aproximada del 90 %.
Se puede lograr una purificación adicional hasta un contenido de m-cresol de aproximadamente el 1 % mediante cristalización en estado fundido. Es posible obtener un rendimiento de cresol del 80 %, basado en tolueno, aunque el rendimiento disminuye al aumentar el contenido de m-cresol.
Las condiciones de sulfonación controladas cinéticamente (suaves), junto con una fusión alcalina suave, pueden producir mezclas de cresol con un contenido reducido de m-cresol. Por ejemplo, se ha informado que la sulfonación con ácido clorosulfúrico a 33–45 °C produce un producto sin m-cresol con un rendimiento del 90 % y una relación o-/p-cresol de 15:85.
De igual manera, la sulfonación de tolueno con mezclas de trióxido de azufre y dióxido de azufre a 25–50 °C produce mezclas de ácido toluenosulfónico prácticamente libres del isómero meta, con relaciones o-/p-isómero tan bajas como 3:97.
Operar en un reactor de bucle a 0 °C con SO3 gaseoso diluido con un gas inerte (o al vacío) puede reducir el contenido de isómeros o y m al 0,5 %. La sulfonación con óleum o ácido sulfúrico en un reactor de película rotatoria con tiempos de residencia cortos también permite la sulfonación sin meta-isómeros, obteniéndose principalmente ácido p-toluenosulfónico.
En cambio, la sulfonación controlada termodinámicamente (alta temperatura, tiempo de reacción prolongado, bajo contenido de agua) genera una mezcla en equilibrio que contiene aproximadamente un 5 % de o-, un 54 % de meta- y un 41 % de ácido para-toluenosulfónico. La fusión alcalina de estas mezclas produce posteriormente una distribución de isómeros de aproximadamente un 5 % de o-cresol, un 56 % de m-cresol y un 39 % de p-cresol.
El m-cresol de grado técnico se puede producir mediante la reacción de vapor a 165 °C con una mezcla de ácido toluenosulfónico rica en meta-isómeros obtenida en condiciones controladas termodinámicamente (seguida de una isomerización durante varias horas a 190-200 °C).
Este proceso hidroliza selectivamente los ácidos orto- y para-toluenosulfónicos, devolviéndolos a ácido sulfúrico y tolueno. El tolueno liberado se destila con vapor, dejando ácido m-toluenosulfónico con una pureza superior al 90 % junto con el ácido sulfúrico.
Las reacciones secundarias durante la isomerización y la hidrólisis pueden suprimirse añadiendo un 5-10 % molar de sulfato de sodio al lote de sulfonación. Esta adición también facilita la eliminación del ácido sulfúrico formado por hidrólisis como fase inferior a 140-150 °C.
La mezcla de hidrólisis puede neutralizarse con una solución concentrada de hidróxido de sodio para formar sulfato de sodio y m-toluenosulfonato de sodio. La solución de m-toluenosulfonato de sodio resultante se hace reaccionar con una mezcla fundida de hidróxido de sodio (que contiene un 10-15 % de hidróxido de potasio) a una temperatura inicial de 330 °C, que luego se aumenta a 340 °C para la fusión.
La destilación de la fase cruda de cresol obtenida tras la acidificación produce m-cresol con una pureza de hasta el 98 %, con un rendimiento aproximado del 65 % basado en el tolueno reaccionado.
El proceso de sulfonación de tolueno para p-cresol es empleado por PMC (Estados Unidos, aprox. 18 000 t/a), Inspec Fine Chemicals (Reino Unido, aprox. 12 000 t/a), Beraton (Rusia, aprox. 3000 t/a) y Konan Chemicals (Japón, aprox. 4000 t/a).
Honshu Chemical Industry Co. (Japón) opera una planta de reserva (aprox. 2500 t/a) capaz de producir m-cresol o p-cresol. Una planta de Gujarat Aromatics en India, basada en el proceso Honshu, produce, según se informa, entre 3000 y 5000 t/a de p-cresol o m-cresol.
Si bien el proceso de ácido toluenosulfónico-cresol requiere una planta relativamente sencilla, su principal desventaja es la inevitable generación de sulfito de sodio acuoso.
2. Producción de cresol mediante hidrólisis alcalina de clorotolueno
Los cresoles pueden producirse industrialmente mediante hidrólisis alcalina de clorotolueno para obtener una mezcla de isómeros con un alto contenido de m-cresol. Bayer AG en Alemania, un fabricante líder de cresol sintético con una capacidad superior a 30.000 t/a, utiliza este proceso.
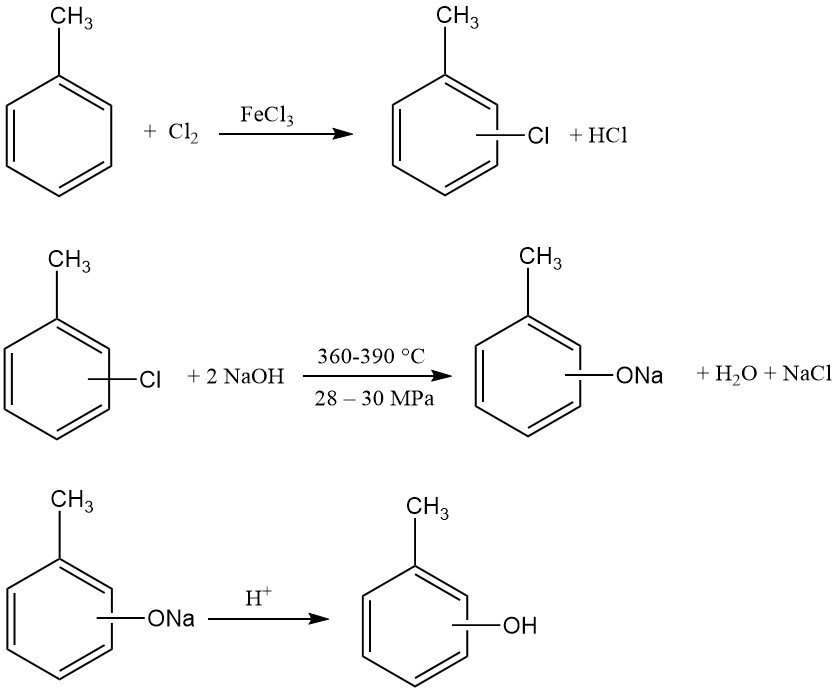
El paso inicial es la cloración del tolueno. Un mol de tolueno reacciona con un mol de cloro en presencia de cloruro de hierro(III) y dicloruro de disulfuro, produciendo una mezcla de o- y p-clorotolueno. Dependiendo del FeCl3 y del sistema cocatalizador, las relaciones o/p pueden variar de 3:1 a 1:2.
Posteriormente, esta mezcla de clorotolueno se hidroliza con un exceso de solución de hidróxido de sodio (2,5–3,5 mol/mol de clorotolueno). Esta reacción se produce a altas temperaturas (360–390 °C) y presiones (280–300 bar, 28–30 MPa).
La hidrólisis exotérmica se lleva a cabo de forma continua en tubos largos de alta presión, fabricados con acero al níquel para resistir la mezcla de reacción corrosiva. La alta velocidad de flujo con frecuentes cambios de dirección garantiza la homogeneidad de la masa de reacción, evitando la separación de los componentes.
La solución de cresolato de sodio resultante se neutraliza para liberar los cresoles. El ácido clorhídrico generado durante la etapa inicial de cloración puede utilizarse para esta neutralización. El cloruro de sodio coproducido puede reciclarse a una unidad de electrólisis cloroalcalina.
La eficiencia económica requiere la ubicación conjunta de la producción de materia prima y la planta de hidrólisis, lo que permite el transporte por tuberías. La tecnología subyacente de este proceso se asemeja en gran medida a la de la hidrólisis de clorobenceno a fenol de Dow-Bayer. Sin embargo, la producción de cresol genera más subproductos.
Estos subproductos incluyen éteres ditolílicos (éteres bis(metilfenil)), tolilcresoles (metil(metilfenil)fenoles) y cantidades menores de tolueno, fenol, ácido benzoico y gases de craqueo (metano, hidrógeno). El fenol, por ejemplo, puede eliminarse mediante destilación azeotrópica con clorotolueno.
Si bien la formación de tolilcresol es difícil de controlar, la formación de éter ditolílico puede gestionarse ajustando la temperatura, el tiempo de residencia y la concentración de hidróxido de sodio. El reciclaje de los éteres ditolílicos también minimiza su acumulación debido a su hidrolización, aunque a una velocidad menor que la del éter difenílico.
Un control óptimo de la reacción permite obtener rendimientos de cresol de aproximadamente el 80 % con base en clorotolueno.
Dado que el éter ditolílico es un producto químico valioso que se utiliza como medio de transferencia de calor (p. ej., Diphyl DT), aislante eléctrico (p. ej., Baylectrol 4800, un sustituto de PCB) y precursor de agentes curtientes, no suele reciclarse y, en ocasiones, las condiciones del proceso pueden incluso ajustarse para mejorar su formación selectiva.
La hidrólisis alcalina del clorotolueno produce cresoles de alta pureza, con una cantidad mínima de otros compuestos.
Una entrada de o/p-clorotolueno 1:1 suele dar como resultado una proporción de isómeros o-, m- y p-cresol de aproximadamente 1:2:1. Esta proporción alterada, en relación con la alimentación de clorotolueno, sugiere isomerización mediante intermediarios arinos en las severas condiciones de hidrólisis. Tras la destilación del o-cresol, se obtiene una mezcla de m-/p-cresol que contiene aproximadamente un 70 % de m-cresol.
La planta también puede operar con o-clorotolueno o p-clorotolueno puros. La hidrólisis del p-clorotolueno produce una mezcla de m-/p-cresol 1:1, mientras que la hidrólisis del o-clorotolueno produce una mezcla de o-/m-cresol 1:1. Técnicamente, el m-cresol puro puede aislarse de este último mediante la destilación del o-cresol.
La hidrólisis del clorotolueno sin isomerización significativa es posible en condiciones más suaves (200-350 °C) utilizando hidróxidos de metales alcalinos, carbonatos de metales alcalinos, hidróxido de amonio o soluciones de acetato/propionato de metales alcalinos, en presencia de cobre o compuestos de cobre.
Estos procesos alternativos generalmente no son viables industrialmente debido a los menores rendimientos a bajas temperaturas.
3. Producción de cresol mediante la escisión del hidroperóxido de cimeno
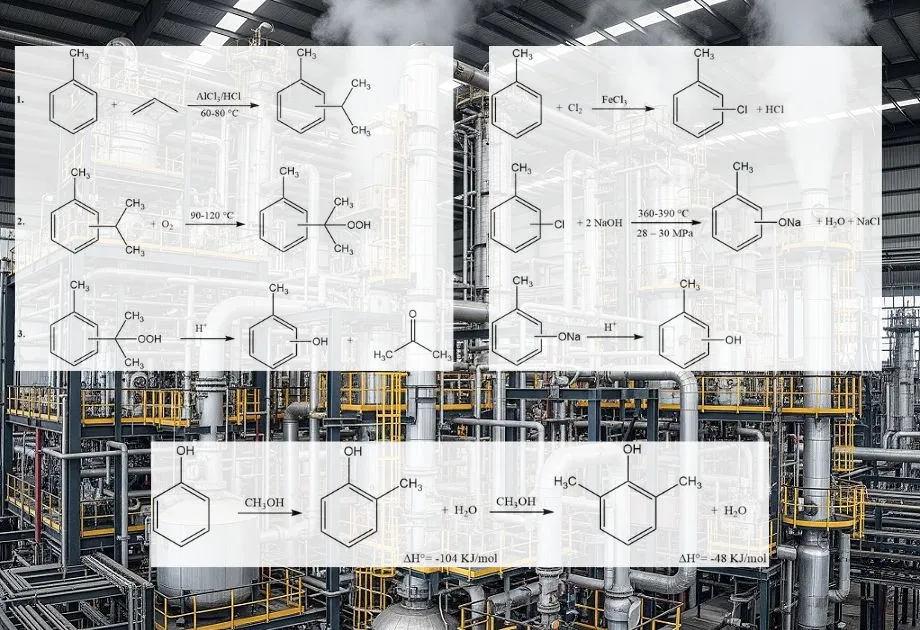
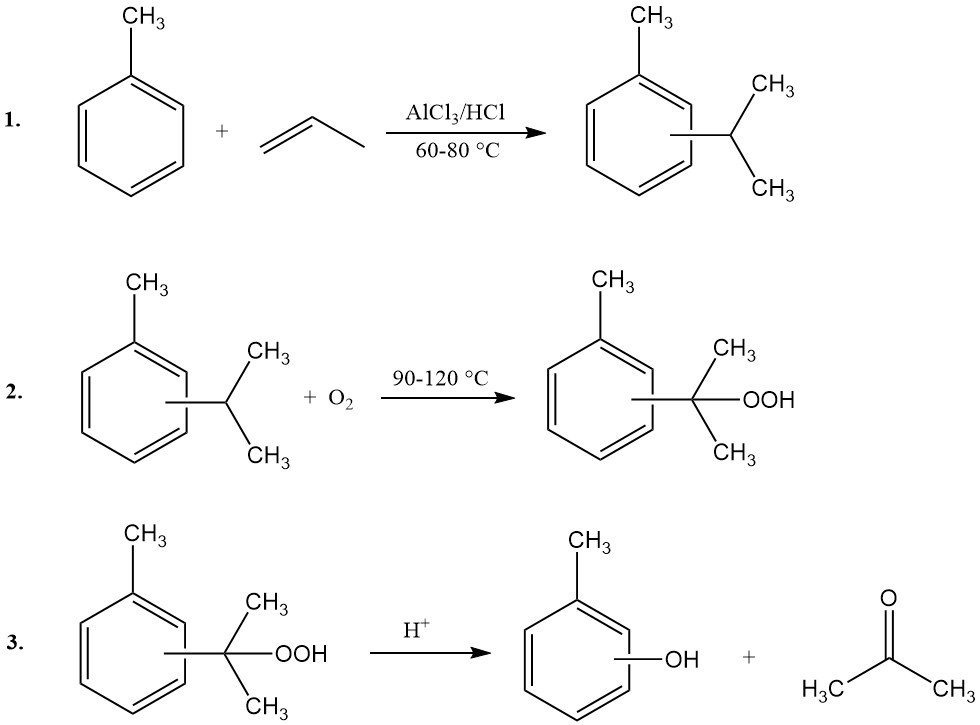
El proceso cimeno-cresol, también conocido como síntesis mediante hidroperóxido de cimeno, permite la producción de m- o p-cresol a partir de sus correspondientes isómeros de isopropiltolueno (cimeno). Este método no es adecuado para la síntesis de o-cresol. El proceso consta de tres etapas principales:
- Propilación del tolueno e isomerización del cimeno: El tolueno reacciona con el propeno para formar isómeros de cimeno, seguido de su isomerización para lograr la distribución isomérica deseada.
- Oxidación del cimeno: El cimeno se oxida para producir hidroperóxido de cimeno.
- Escisión del peróxido: El hidroperóxido de cimeno se somete a una escisión catalizada por ácido para producir cresol y acetona.
El proceso cimeno-cresol presenta varias desventajas operativas y económicas en comparación con el proceso Hock-cumeno. Estas incluyen menores rendimientos espacio-temporales, complejos requisitos de destilación, una gestión compleja de las aguas residuales y una reducción del rendimiento del producto (entre un 20 % y un 30 % inferior).
Los factores clave que contribuyen a estas limitaciones son la distribución de isómeros en la propilación, la cinética de oxidación subóptima, la oxidación del grupo metilo y las reacciones secundarias del formaldehído, y la compleja separación de subproductos.
1. La propilación del tolueno produce isómeros de orto-, meta- y para-cimeno. El orto-cimeno inhibe la oxidación de otros cimenos y se oxida poco. Mantener el contenido de o-cimeno por debajo del 10 % es fundamental para una oxidación continua.
Para lograr esto se requieren rigurosos pasos de reciclaje e isomerización, que a menudo emplean cloruro de aluminio para establecer el equilibrio termodinámico (p. ej., 3 % de o-cimeno, 64 % de m-cimeno y 33 % de p-cimeno). Los subproductos de diisopropiltolueno también se reciclan para la isomerización.
2. Las tasas de oxidación del cimeno son más lentas que las del cumeno, y el contenido máximo de peróxido alcanzable es menor (aprox. 20 % frente a >30 % para el cumeno). Esto requiere mayores tasas de reciclaje del cimeno sin reaccionar y conduce a una mayor formación de subproductos (p. ej., dimetil(tolil)metanol, metilacetofenona) a niveles de oxidación más altos.
3. La oxidación del grupo metilo del cimeno es una reacción secundaria importante que produce peróxidos primarios menos estables y productos secundarios (p. ej., alcohol isopropilbencílico, ácido cumínico). La posterior escisión ácida genera formaldehído, que puede reaccionar con cresol para formar resinas, lo que reduce sustancialmente la producción de cresol y dificulta la purificación del producto.
Las técnicas para mitigar la formación de formaldehído o sus efectos incluyen la descomposición/hidrogenación selectiva de peróxidos primarios, la extracción o la disolución alcalina in situ de subproductos ácidos.
4. La mezcla de reacción posterior a la escisión es muy compleja y contiene numerosos subproductos con puntos de ebullición y tendencias azeotrópicas similares. Esto encarece la separación. La hidrogenación selectiva de peróxidos primarios y la posterior rehidrogenación de la mezcla concentrada de escisión pueden aumentar la producción de cresol mediante la reformación del cimeno.
Las plantas de cimeno-cresol a escala industrial, que utilizan cimeno como materia prima, han estado operativas desde 1969 (p. ej., Sumitomo y Mitsui en Japón, con una capacidad de 22 000 t/a cada una), produciendo típicamente m-/p-cresol con una pureza superior al 99,5 % y una relación m/p de 60:40. Se coproduce acetona de alta calidad.
El uso de p- o m-cimeno puro como materia prima elimina la necesidad de reciclar e isomerizar el o-cimeno, simplificando así la producción directa de isómeros puros. Algunos ejemplos incluyen la antigua producción de p-cresol a partir de terpenos naturales (Hercules Powder Co., EE. UU.) y las plantas actuales que utilizan el proceso Cymex de UOP, que aísla selectivamente el p-cimeno mediante tamices moleculares.
4. Producción de Cresol por Metilación de Fenol
Los cresoles sintéticos, en particular el o-cresol, y los xilenoles se fabrican principalmente mediante la metilación de fenol con metanol. Este proceso se produce en presencia de diversos catalizadores. El 2,6-xilenol se produce casi exclusivamente mediante este método.
Esta síntesis consta de una sola reacción. Sin embargo, utiliza fenol, una materia prima comparativamente cara. Además, separar los productos de la mezcla de reacción es costoso debido a los puntos de ebullición cercanos de varios componentes y a los estrictos requisitos de pureza de ciertos productos.
La reacción de metilación puede realizarse en fase de vapor o líquida.
4.1. Metilación de fenol en fase de vapor
La metilación de fenol en fase de vapor con metanol es una ruta industrial primaria para producir o-cresol y/o 2,6-xilenol de alta pureza; este último se fabrica casi exclusivamente de esta manera.
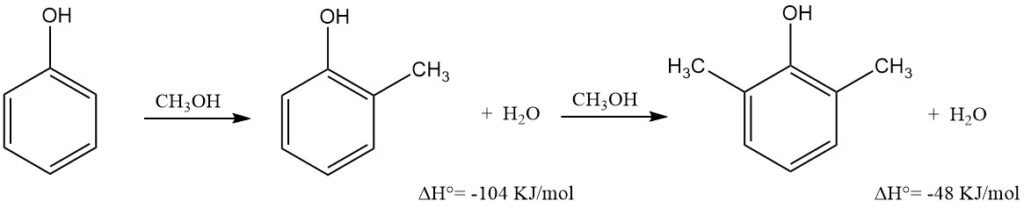
El proceso consiste en pasar una mezcla sobrecalentada de fenol, metanol y vapor de agua sobre un catalizador de óxido metálico fijo en un reactor multitubular de acero inoxidable a 300–460 °C y presión atmosférica o ligeramente elevada.
La velocidad espacial horaria del líquido (LHSV) suele oscilar entre 1 y 2 h⁻¹. La temperatura de reacción depende del catalizador y puede ajustarse según la composición deseada del producto. El calor de reacción se gestiona mediante medios orgánicos de transferencia de calor en ebullición, sales fundidas circulantes o generación de vapor a alta presión.
La pérdida de actividad del catalizador con el tiempo se contrarresta mediante aumentos de temperatura y la eliminación periódica de los depósitos de carbono mediante combustión. El agua presente en la mezcla de materia prima suprime la descomposición del metanol, prolonga los ciclos de regeneración y prolonga la vida útil del catalizador.
El efluente del reactor intercambia calor con la materia prima y posteriormente se condensa. Los productos no condensables de la descomposición del metanol (H2, CH4, CO2 y CO) se utilizan como gas combustible para la generación de vapor.
El metanol acuoso se destila del producto líquido y se recicla; la separación en metanol, agua con fenol y fenoles puede realizarse en una sola columna de destilación o por decantación con posterior adsorción de fenoles en resina.
El agua restante se elimina mediante destilación azeotrópica con tolueno o como un azeótropo con fenol no reaccionado, requiriendo en este último caso la extracción de fenol de las aguas residuales.
La mezcla deshidratada se somete a destilación fraccionada continua al vacío en columnas de alta eficiencia para obtener éter fenólico, fenol, o-cresol de alta pureza (99,5 %) y 2,6-xilenol. La fracción de éter fenólico-fenol se recicla.
El residuo de destilación, que contiene otros xilenoles y trimetilfenoles, se utiliza típicamente como combustible. Si el catalizador presenta una alta selectividad orto, se puede obtener directamente 2,6-xilenol con una pureza del 99,5 %. De lo contrario, o en condiciones severas, la fracción de 2,6-xilenol puede contener m- y p-cresol, lo que requiere una mayor purificación.
La proporción de o-cresol a 2,6-xilenol se puede controlar ajustando la proporción metanol-fenol; el reciclaje del o-cresol puede convertir el 2,6-xilenol en el único producto. El rendimiento global (selectividad) de o-cresol y 2,6-xilenol, basado en el fenol reaccionado, oscila entre el 90 % y el 98 %.
La metilación del fenol en fase de vapor utiliza principalmente catalizadores de óxidos metálicos. Estos catalizadores influyen en la temperatura de reacción, la distribución del producto y la selectividad.
Los catalizadores de óxido de magnesio ofrecen una alta orto-selectividad y minimizan la formación de m- y p-cresol incluso a temperaturas elevadas (420–460 °C). Su rendimiento se puede mejorar mediante la combinación con otros óxidos metálicos (p. ej., metales alcalinos, manganeso, cobre).
Se pueden alcanzar temperaturas de reacción más bajas con otros sistemas catalíticos. Los catalizadores de óxido de manganeso u óxido de cromo operan alrededor de 390 °C, mientras que los catalizadores de óxido de vanadio u óxido de hierro se utilizan a 320–350 °C.
Estos suelen mezclarse con otros óxidos (p. ej., cerio, aluminio, silicio) para mejorar la conversión y la selectividad del 2,6-xilenol/o-cresol. Estos sistemas de óxidos mixtos también ayudan a prolongar la vida útil del catalizador y a reducir la descomposición del metanol.
El óxido de γ-aluminio cataliza la reacción a 300–320 °C con una descomposición mínima del metanol y una buena estabilidad. Sin embargo, requiere un reciclaje significativo del producto debido a la limitada conversión de fenol para controlar la formación de subproductos, lo que requiere complejas etapas de purificación para el 2,6-xilenol.
Los catalizadores con sitios ácidos fuertes, como los óxidos de aluminio, la sílice-alúmina, las zeolitas, los fosfatos de aluminio y el ácido fosfórico-kieselguhr, promueven la isomerización y la transmetilación. Suelen producir productos con un mayor contenido de m/p-cresol, especialmente a temperaturas elevadas.
Las zeolitas con selectividad de forma (p. ej., tipo HKY) y el ácido fosfórico-kieselguhr, que reaccionan a 250-300 °C, pueden mostrar una alta selectividad para el p-cresol, dando lugar a mezclas de m-/p-cresol con aproximadamente un 77-85 % de p-cresol. Las zeolitas Pentasil modificadas también presentan para-selectividad. Los agentes metilantes alternativos incluyen metilbencenos, éter dimetílico, metilamina, metano, mezclas de monóxido de carbono e hidrógeno y mezclas de formaldehído e hidrógeno.
La metilación en fase de vapor se utiliza globalmente por empresas como General Electric Co. (EE. UU., Países Bajos), Inspec Fine Chemicals (Reino Unido), Chemopetrol (República Checa), Nippon Crenol (Japón), GEM Polymers (Japón), Mitsubishi Gas Chemical Company (Japón) y Honshu Chemical Industry Co. (Japón).
4.2. Metilación del fenol en fase líquida
La metilación en fase líquida ofrece una alternativa a los métodos en fase de vapor para sintetizar cresoles y xilenoles. Este proceso generalmente emplea catalizadores de óxido, como γ-Al2O3, suspendidos en una mezcla de fenol y metanol en un autoclave a 300–400 °C, o sobre un lecho fijo en un reactor tubular (por ejemplo, 350 °C, 35 bar).
Un proceso industrial notable, utilizado por Chemisches Werk Lowi, consiste en la reacción del fenol con una cantidad equimolar de metanol a 350-400 °C utilizando metilato de aluminio como catalizador. Este método alcanza un rendimiento aproximado del 80 % de cresoles y xilenoles a partir de aproximadamente el 60 % de fenol convertido.
Si bien el o-cresol es el producto principal, también se forman otros isómeros y trimetilfenoles, cuyas proporciones de producto se ajustan mediante los parámetros de reacción. La presencia de bases aumenta la conversión, mientras que los ácidos favorecen el p-cresol y el 2,4-xilenol.
Otro proceso significativo, el proceso Biller (anteriormente Union Rheinische Kraftstoff AG), utilizaba soluciones acuosas de haluro de cinc-haluro de hidrógeno como catalizadores en condiciones más suaves (200-240 °C, aprox. 25 bar). Este método produjo hasta un 98 % de cresol a partir del fenol convertido, pero produjo mayores cantidades de p-cresol y 2,4-xilenol, con p-cresol prácticamente libre de m-cresol en condiciones optimizadas.
Este proceso requirió materiales altamente resistentes a la corrosión debido al sistema catalítico.
Ambos procesos en fase líquida presentan desafíos, como el costo de la materia prima (fenol) y la compleja separación del producto debido a puntos de ebullición similares y estrictos requisitos de pureza.
4.3. Transmetilación e isomerización
Los procesos de transmetilación e isomerización permiten la conversión de subproductos y residuos de metilfenol menos deseados en isómeros de cresol más valiosos, en particular mezclas de o-cresol y m-/p-cresol.
Estas reacciones suelen ocurrir mediante la adición de fenol a residuos de metilfenol (procedentes de la metilación del fenol u otras fuentes) o a xilenoles no utilizados. El proceso se lleva a cabo en fase de vapor o líquida, a temperaturas que oscilan entre 400 y 500 °C.
Los catalizadores comunes utilizados en estas reacciones incluyen óxido de aluminio, óxido de cromo-óxido de aluminio, sílice-alúmina, óxido metálico-óxido de hierro y óxido de magnesio-óxido de tungsteno.
En el caso del 2,6-xilenol, la transmetilación y la isomerización concomitante pueden ocurrir sin catalizador. Esta conversión no catalítica puede realizarse en fase de vapor a 550-600 °C o por lotes en fase líquida a 420-470 °C. Estos métodos pueden mejorar el rendimiento total de o-cresol a partir de la metilación del fenol.
Chiyoda Chemical Engineering Construction Co. desarrolló un proceso de isomerización-transalquilación para mezclas de isómeros de cresol. Este proceso implica la reacción de mezclas de cresol con fenol sobre catalizadores de sílice-alúmina a 400 °C a presión normal.
La mezcla resultante puede rectificarse para aislar el o-cresol puro, reciclando todos los demás componentes fenólicos.
Históricamente, los intentos de isomerizar o-cresol a m- y p-cresol (debido a la fluctuación de la demanda) utilizando catalizadores como cloruro de aluminio, fluoruro de aluminio, trifluoruro de boro, silicatos de aluminio u óxido de aluminio resultaron en gran medida insatisfactorios. Estos métodos a menudo resultaban en reacciones secundarias indeseables, como la resinificación y la desproporción a fenol y dimetilfenoles.
Sin embargo, la isomerización sin una desproporción sustancial se puede lograr utilizando zeolitas de sílice-alúmina del grupo ZSM. A aproximadamente 400 °C, con conversiones de o-cresol del 40-50 %, estos catalizadores pueden alcanzar selectividades de m-/p-cresol del 90 % y una relación m:p de 7:3.
5. Otros procesos de producción de cresol
Más allá de los métodos industriales primarios, se han explorado diversas síntesis alternativas de cresoles, a menudo buscando la selectividad isomérica. Estos procesos generalmente no se utilizan aún a escala industrial.
5.1. Oxicloración del Golfo
Este proceso implica la oxicloración del tolueno con ácido clorhídrico acuoso y oxígeno, catalizada por ácido nítrico y una sal de paladio o cobre, a aproximadamente 100 °C. Produce principalmente o- y p-clorotolueno con alta selectividad.
La posterior hidrólisis en fase de vapor del clorotolueno produce cresol, y el ácido clorhídrico liberado se recicla. Si bien es eficiente y ofrece alta conversión y selectividad, este proceso de oxicloración del tolueno requiere un reciclaje sustancial y materiales vegetales resistentes a la corrosión.
5.2. Descarboxilación oxidativa de ácidos metilbenzoicos
Los ácidos metilbenzoicos pueden descarboxilarse a cresoles haciendo pasar una mezcla de aire y vapor a través de su fusión a 200-240 °C, catalizada por sales de cobre y magnesio.
La oxidación en fase de vapor con mezclas de oxígeno y nitrógeno sobre catalizadores mixtos a aproximadamente 300 °C muestra mejores resultados, con ácido metametilbenzoico produciendo m-cresol selectivamente. Este método es más complejo que la producción de fenol y presenta dificultades con la formación de alquitrán y la generación de subproductos.
5.3. Oxidación Baeyer-Villiger de p- u o-metilbenzaldehído
Esta ruta produce específicamente p-cresol a partir de p-metilbenzaldehído (u o-cresol a partir de o-metilbenzaldehído). Implica la reacción del metilbenzaldehído con ácido perfórmico (generado a partir de peróxido de hidrógeno y ácido fórmico) para formar un formiato de tolilo, que posteriormente se hidroliza a cresol y ácido fórmico. El proceso ofrece altos rendimientos, con ácido fórmico reciclado en gran medida.
5.4. Hidroxilación del núcleo del tolueno
Implica la hidroxilación directa del tolueno (o xileno) utilizando diversos oxidantes (p. ej., oxígeno, peróxido de hidrógeno, peróxidos orgánicos) y sistemas catalíticos (p. ej., catalizadores de Friedel-Crafts, compuestos de metales de transición, microorganismos).
Si bien se ha investigado exhaustivamente, los desafíos incluyen el aislamiento de cresoles a partir de soluciones diluidas y la necesidad de un reciclaje exhaustivo de auxiliares costosos. Por ejemplo, microorganismos específicos pueden producir p-cresol de forma regioselectiva, y ciertos sistemas que utilizan peróxido de hidrógeno con ácidos fuertes o zeolitas modificadas con titanio producen mezclas de o- y p-cresol.
5.5. Metilación oxidativa del tolueno
Este proceso implica la oxidación adiabática del tolueno con oxígeno, metano y vapor a altas temperaturas (700–750 °C) en un reactor tubular. Produce una mezcla de aromáticos que incluye etilbenceno, estireno, benceno, fenol y cresol, lo que sugiere potencial para la producción de cresol a escala petroquímica.
5.6. Reacción de Hock de Derivados de Tolueno
De forma similar al proceso cimeno-cresol, otros derivados de tolueno pueden sufrir peroxidación y escisión para producir cresol y un compuesto carbonílico correspondiente. Algunos ejemplos son el etilidenbis(p-metilbenceno) y el 4-metil-ciclohexilbenceno, que pueden modificarse para producir p-cresol.
La oxidación del xileno en presencia de ácido acético también puede producir acetato de cresilo, que posteriormente se hidroliza a cresol.
5.7. Hidrogenación de N,N’-dialquilaminometilfenoles
Este método implica la reacción del fenol con paraformaldehído y una amina secundaria (p. ej., piperidina) para formar aminometilfenoles, que posteriormente se hidrogenan sobre un catalizador de paladio-carbono. Esto suele producir o-cresol y p-cresol en una proporción molar de 1:2, con altos rendimientos basados en el fenol convertido.
5.8. Cierre del anillo de Diels-Alder de isopreno y acetato de vinilo
Esta ruta sintética de tres pasos produce selectivamente p-cresol. El isopreno reacciona con acetato de vinilo mediante una cicloadición de Diels-Alder para formar acetato de 1-metilciclohexen-4-ilo, que posteriormente se saponifica. El 1-metilciclohexen-4-ol resultante se deshidrogena catalíticamente a p-cresol.
Referencias
- Cresols and Xylenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a08_025
- Methylation of phenols. – https://patents.google.com/patent/US3446856A/en
- Synthesis method of o-cresol and m-cresol. – https://patents.google.com/patent/CN103992210A/en
