Dioxano: Propiedades, Reacciones, Producción y Usos
El dioxano, o 1,4-dioxano, es un diéter heterocíclico con la fórmula C4H8O2. Es un líquido inflamable e incoloro con un leve olor dulce similar al éter dietílico. Se le conoce con otros nombres como p-dioxano, óxido de dietileno, dióxido de dietileno, éter dietílico, 1,4-dioxaciclohexano, éter dioxietilenado y dioxano.
El dioxano fue producido por primera vez por A. V. Lourenço en 1863 haciendo reaccionar etilenglicol con 1,2-dibromoetano. Sin embargo, la producción comercial no se produjo hasta 1929.
Tabla de contenido
1. Propiedades físicas del dioxano
El dioxano es un buen disolvente con propiedades excepcionales. Disuelve fácilmente una amplia gama de compuestos orgánicos, incluidos hidrocarburos alifáticos y aromáticos, éteres, alcoholes, cetonas e hidrocarburos clorados, especialmente aquellos con pesos moleculares más bajos.
El 1,4-dioxano es miscible con agua en todas las proporciones y también disuelve diversos compuestos y elementos inorgánicos, incluidos cloruros de hierro, cloruro de mercurio, ácidos minerales (clorhídrico, sulfúrico y fosfórico), halógenos (bromo, cloro y yodo), sustancias animales. y aceites vegetales, aceites de parafina y resinas sintéticas y naturales.
A temperatura ambiente, el 1,4-dioxano aparece como un líquido transparente con un olor etéreo. Su estabilidad química es comparable a la de otros éteres alifáticos. Al igual que estos éteres, el dioxano forma peróxidos al exponerse al aire.
Las propiedades físicas más importantes del dioxano se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Peso molecular | 88,11 g/mol |
| Punto de ebullición | 101,3 °C |
| Punto de congelación | 11,8 °C |
| Densidad | 1,0356 g/cm3 |
| Calor latente de evaporación | 413 kJ/kg |
| Calor de fusión | 141 kJ/kg |
| Calor específico (20 °C) | 1,76 kJ kg-1 K-1 |
| Índice de refracción | 1,4224 |
| Presión de vapor (20 °C) | 4,13 kPa (41,3 mbar) |
| Constante dieléctrica (20 °C) | 2.23 |
| Tensión superficial (20 °C) | 36,9 mN/m |
| Temperatura crítica | 312 °C |
| Presión crítica | 5,14 MPa |
| Punto de inflamación (copa cerrada) | 11°C |
| Límites de inflamabilidad (en el aire) |
Inferior: 2 % vol Superior: 22 % vol. |
| Calor de combustión | 27 600 kJ/kg |
| Temperatura de autoignición | 180°C |
El dioxano forma mezclas azeotrópicas con muchos disolventes. En la Tabla 2 se dan ejemplos comunes.
| Componente | Componente pb, °C | Dioxano, % en peso | Pb azeotrópico, °C |
|---|---|---|---|
| Ácido fórmico | 100,7 | 57 | 113,35 |
| Nitrometano | 100,8 | 43,5 | 100,55 |
| Ácido acético | 117,9 | 20,5 – 23 | 119,4 |
| Etanol | 78,5 | 9.3 | 78.1 |
| 3-yodo-1-propeno | 103 | 44 | 98,5 |
| 1-Propanol | 97,4 | 45 | 95,3 |
| alcohol terc-amílico | 102,5* | 20 | 100,65 |
| Ciclohexano | 80,7 | 24.6 | 79,5 |
| Heptano | 98,4 | 44 | 91,85 |
| Agua | 100 | 82 | 87,8 |
| * A 8 kPa | |||
2. Reacciones químicas del dioxano
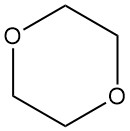
Al igual que otros éteres, el dioxano forma fácilmente peróxidos al exponerse al aire. Estos peróxidos suelen ser muy explosivos e inestables. El peróxido primario formado es 2-hidroperoxi-1,4-dioxano (1), que se descompone para producir dioxanona (2) y agua.
La hidrólisis posterior conduce a la formación de ácido 2-(2-hidroxietoxi)acético (3). Afortunadamente, la vía de reacción favorece la formación del producto final, limitando la concentración de peróxido.
A pesar de ello, la manipulación del dioxano requiere las mismas precauciones que con otros éteres para evitar la formación de peróxido. Una práctica recomendada es el rociado de gas inerte, normalmente con nitrógeno. Además, los peróxidos nunca deben concentrarse ni destilarse hasta sequedad.
Los métodos establecidos para su eliminación implican agentes reductores como cloruros de hierro (II) o estaño (II), bisulfito de sodio o materiales adsorbentes como carbón activado, alúmina o resinas de intercambio aniónico.
El 1,4-dioxano es capaz de disolverse y formar complejos con varios halógenos (Cl2, Br2 e I2) y ácidos halógenos. Estos complejos pueden moderar la reactividad de los halógenos o de los ácidos halógenos durante las reacciones. Como ejemplo, el complejo de dibromuro de dioxano se puede utilizar para la bromación controlada de fenoles, aldehídos/aminas aromáticos y cetonas.
La cloración del dioxano puede producir derivados clorados que contienen de 1 a 8 átomos de cloro. La distribución específica de isómeros depende de las condiciones de reacción (temperatura, catalizadores) empleadas.
Los dioxanos con menos átomos de cloro se utilizan como precursores de compuestos de adición, como grupos etoxi o etilo, utilizando reactivos apropiados como NaOCH2CH3 o CH3CH2MgBr, respectivamente.
El 2,3-dicloro-1,4-dioxano es altamente reactivo y se condensa fácilmente con otros grupos funcionales como ácidos carboxílicos, alcoholes y glicoles para formar los diésteres y éteres correspondientes.
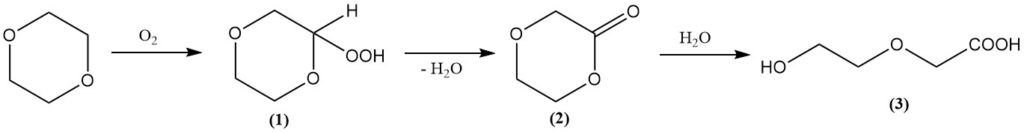
Si bien el anillo de dioxano es estable, los ácidos fuertes bajo temperatura y presión elevadas pueden romperlo. En tales condiciones, las reacciones con anhídrido acético producen diacetato de etilenglicol y diacetato de dietilenglicol.
El dioxano se puede descomponer con peróxido de hidrógeno a 25 °C utilizando FeSO4 como catalizador.
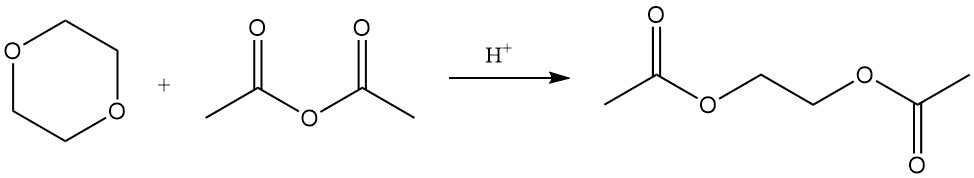
Las reacciones catalizadas por ácido de Lewis de 1,4-dioxano con cloruro de benzoílo o cloruro de acetilo producen los ésteres 2-cloroetílicos del ácido benzoico y del ácido acético, respectivamente.
Utilizando peróxido de benzoilo como catalizador, el dioxano reacciona con α-olefinas a una temperatura de 80 a 140 °C durante 5 a 10 h para producir una variedad de polímeros utilizados como lubricantes.
Pueden ocurrir reacciones similares con tetrafluoroetileno, donde reacciones catalizadas por peróxido a altas temperaturas y presión producen polímeros análogos.
Se han informado numerosos catalizadores alternativos para estas polimerizaciones, incluidos peróxidos (orgánicos e inorgánicos), bases (bórax, fosfato disódico, hidracina) y ácidos de Lewis (cloruro de zinc, ácido fosfórico).
Además de los halógenos, el 1,4-dioxano forma complejos con diferentes grupos funcionales, como AlBr3, AlCl3, AuCl3, BBr3, BCl3, BF3, CuCl2, CoCl2, FeCl3, HgCl2, LiBr, LiCl, LiI, ZnCl2, PtCl4, HCl, H2SO4, H3PO4, SO2, SO3 y trinitrofenol.
Estos complejos se utilizan como catalizadores, agentes moderadores en reacciones como bromación o sulfonación, o como medios de reacción para sistemas de ácidos anhidros.
3. Producción de dioxano
El dioxano se produce principalmente mediante un proceso de circuito cerrado que implica la deshidratación y el posterior cierre del anillo de dietilenglicol. Se utiliza ácido sulfúrico concentrado (alrededor del 5%) como catalizador para esta reacción. Sin embargo, también se pueden emplear catalizadores alternativos como ácido fosfórico, ácido p-toluenosulfónico y resinas de intercambio iónico fuertemente ácidas.
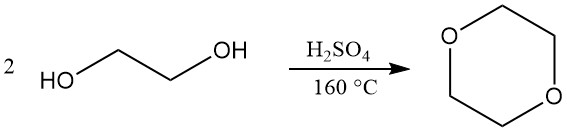
Las condiciones operativas para este proceso pueden variar. Las temperaturas de reacción suelen oscilar entre 130 y 200 °C, mientras que la presión puede variar desde ligeramente por encima de la presión atmosférica hasta un vacío parcial (25-110 kPa). A menudo se considera óptima una temperatura de reacción de 160 °C.
La configuración de la reacción permite una producción continua, con el dioxano formado vaporizado directamente desde el recipiente de reacción. Luego, estos vapores pasan a través de una trampa de ácido y una serie de columnas de destilación para eliminar el agua y purificar el producto final. Se pueden lograr rendimientos de aproximadamente el 90%.
Es importante tener en cuenta que este proceso genera subproductos no deseados como 2-metil-1,3-dioxolano, acetaldehído, crotonaldehído y poliglicol.
Si bien la deshidratación del dietilenglicol es la ruta comercial dominante, existen otros métodos para sintetizar 1,4-dioxano. Estos métodos menos comunes incluyen:
- Deshidrohalogenación del éter 2-cloro-2′-hidroxietílico
- Reacción del etilenglicol con 1,2-dibromoetano
- Dimerización de óxido de etileno utilizando catalizadores como NaHSO4, SiF4 o BF3, o por reacciones a alta temperatura con resinas de intercambio catiónico ácidas
4. Usos del dioxano
La aplicación industrial más importante del 1,4-dioxano es la estabilización del 1,1,1-tricloroetano frente a la reacción con el aluminio. Se forma una película de óxido de aluminio sobre la superficie del metal, lo que impide el contacto directo con el 1,1,1-tricloroetano.
Sin embargo, cuando se altera esta capa protectora, el 1,1,1-tricloroetano reacciona con el aluminio expuesto, extrayendo cloro y formando cloruro de aluminio, que luego promueve la deshidrohalogenación del 1,1,1-tricloroetano para producir ácido clorhídrico y cloruro de vinilideno.
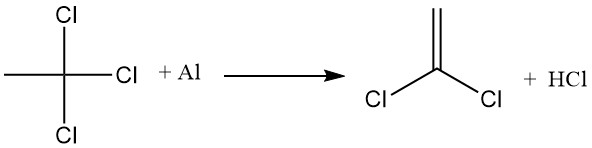
El 1,4-dioxano inhibe estas reacciones formando un complejo insoluble entre dioxano y cloruro de aluminio. Este complejo desactiva el catalizador AlCl3 y sella cualquier abertura en la película de óxido de aluminio, evitando el contacto directo entre el metal y el 1,1,1-tricloroetano.
El dioxano se emplea como agente humectante y dispersante en el procesamiento de textiles, baños de tinte, tinciones y composiciones de estampación. Además, ayuda en la preparación de portaobjetos histológicos.
El dioxano se utiliza en otros sectores, entre ellos:
- Solventes: Se utiliza como solvente en la formulación de tintas, recubrimientos, adhesivos, contadores de centelleo y para la extracción de aceites animales y vegetales.
- Intermedio químico: los productos derivados del dioxano son valiosos como insecticidas, herbicidas, plastificantes y monómeros.
- Catálisis y reactivos: Los complejos de oxonio formados por dioxano con sales, ácidos minerales, halógenos y trióxido de azufre funcionan como catalizadores y reactivos en reacciones de ácidos anhidros, bromaciones y sulfonaciones.
- Aplicaciones de laboratorio: En los laboratorios, el 1,4-dioxano se utiliza como disolvente crioscópico para determinar masas moleculares y su estabilidad lo convierte en un medio de reacción adecuado para diversas transformaciones químicas.
- Tradicionalmente, el dioxano se utilizaba en la fabricación de polímeros y como disolvente para resinas naturales y sintéticas, incluidos derivados de celulosa, resinas de polivinilacetal y copolímeros de acrilonitrilo-metilvinilpiridina.
5. Toxicología del dioxano
El dioxano tiene una toxicidad aguda relativamente baja. Los valores de LD50 oral y dérmica en ratas y conejos, respectivamente, son 5170 mg/kg y 7600 mg/kg. La exposición por inhalación durante 4 horas a 14.260 ppm (51.880 mg/m³) es letal para el 50 % de la población de ratas expuestas (CL50).
Límites de exposición ocupacional:
- Valor límite umbral de la Conferencia Estadounidense de Higienistas Industriales Gubernamentales (ACGIH): promedio ponderado en el tiempo (TLV-TWA): 25 ppm (90 mg/m³) con una notación de «piel».
- Administración de Salud y Seguridad Ocupacional de EE. UU. (OSHA): 100 ppm (360 mg/m³)
- Deutsche Forschungsgemeinschaft (MAK): >50 ppm (180 mg/m³) con notación IIIB (sospecha de carcinógeno)
Medidas de control de exposición
Debido al potencial de irritación de la piel y los ojos y daños al sistema respiratorio en altas concentraciones, los lugares de trabajo que utilizan 1,4-dioxano deben implementar medidas de control para minimizar la exposición de los trabajadores. Estos incluyen controles de ingeniería para minimizar los niveles de vapor en el aire y el uso de equipo de protección personal como guantes, protección para los ojos y respiradores, cuando sea necesario.
Carcinogenicidad
Los primeros estudios en animales que utilizaron altas dosis orales de dioxano (7 a 18 000 mg/kg) dieron como resultado tumores nasales y hepáticos. Sin embargo, estudios posteriores con dosis más bajas (1000 mg/kg e inferiores) no mostraron formación de tumores, lo que sugiere un posible efecto umbral. Además, las pruebas de mutagenicidad no revelaron ninguna interacción directa del dioxano con el ADN.
Estos hallazgos sugieren que los tumores en roedores pueden surgir de daños tisulares repetidos más que de genotoxicidad directa.
Metabolismo y eliminación
Los estudios que utilizan dioxano radiomarcado indican que dosis bajas se convierten rápidamente y se eliminan en la orina como ácido 2-hidroxietoxiacético. Este proceso de conversión se vuelve menos eficiente en dosis altas, lo que resulta en una eliminación más lenta.
Exposición humana y evaluación de riesgos de carcinogenicidad
Los incidentes de exposición humana a concentraciones estimadas de 470 ppm de dioxano han provocado muertes. Sin embargo, los estudios epidemiológicos de trabajadores expuestos a niveles de hasta 51 ppm no han mostrado ningún efecto adverso para la salud.
La potencial carcinogenicidad del 1,4-dioxano ha llevado a varios organismos reguladores internacionales a establecer directrices para su presencia en el agua potable y el medio ambiente.
La Agencia Internacional para la Investigación del Cáncer (IARC) clasifica el 1,4-dioxano como carcinógeno del Grupo 2B (probablemente carcinógeno humano) basándose en estudios en animales que muestran una mayor incidencia de carcinomas de cavidad nasal, hígado y vesícula biliar en ratas, ratones y cobayas. , respectivamente.
Dioxano en el agua potable
La Organización Mundial de la Salud (OMS) recomienda un valor guía de 50 μg/L para 1,4-dioxano en el agua potable.
La Agencia de Protección Ambiental de EE. UU. (EPA) y el Centro Nacional de Evaluación Ambiental propusieron un nivel de recomendación basado en la salud de 3 μg/L en el agua potable.
El Sistema Integrado de Información de Riesgos de la EPA sugiere un riesgo potencial de cáncer de 1 en 1.000.000 con una exposición de por vida de 0,35 μg/L. En consecuencia, la Regla de Monitoreo de Contaminantes No Regulados (UCMR3) establece un nivel mínimo de informe de 0,07 μg/L.
La Agencia Federal de Medio Ambiente de Alemania recomienda un límite de precaución de 0,1 μg/L para carcinógenos no genotóxicos como el 1,4-dioxano en el agua potable.
Japón estableció un estándar ambiental de 50 μg/L para 1,4-dioxano.
En Estados Unidos, varios estados han establecido sus propios niveles de recomendación para el 1,4-dioxano en el agua potable, lo que refleja un mosaico de regulaciones en todo el país.
Referencias
- Dioxane; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_545.pub2
- 1,4-Dioxane; https://onlinelibrary.wiley.com/doi/10.1002/9781119407621.ch4
