Cloroaminas

Las cloroaminas son compuestos que contienen nitrógeno, ya sean inorgánicos u orgánicos, donde uno o más átomos de cloro están unidos directamente a un átomo de nitrógeno. La monocloroamina (NH2Cl), descubierta a principios del siglo XIX, es un ejemplo bien conocido.
Las cloroaminas son sustancias clorantes y oxidantes utilizadas en reacciones sintéticas y como agentes blanqueadores, desinfectantes y bactericidas. En comparación con el cloro gaseoso o los hipocloritos metálicos, ofrecen un manejo más seguro y una mayor estabilidad.
Por ello, se utilizan en la purificación del agua potable y en el saneamiento de piscinas. Los ácidos N-cloroisocianúricos y 1-bromo-3-cloro-5,5-dimetilhidantoína se están volviendo más importantes en los mercados de higienización y desinfección que el hipoclorito de calcio, 1,3-dicloro-5,5-dimetilhidantoína y cloramina-T.
Tabla de contenido
1. Propiedades químicas de las N-cloroaminas
Las N-cloroaminas poseen capacidades oxidantes y aceptan dos electrones para convertirse en iones cloruro. Esta propiedad les permite oxidar el ácido yodhídrico, liberando yodo, en una reacción utilizada para análisis cuantitativos:
2 HI + RR’NCl → HCl + RR’NH + I2
El contenido teórico de cloro en una N-cloroamina se calcula como el doble de la fracción de masa de cloro. Sin embargo, las aplicaciones prácticas lo expresan como el equivalente del cloro elemental según su capacidad oxidante real.
Las N-cloroaminas se hidrólisis en agua, liberando ácido hipocloroso (HOCl). La constante de hidrólisis cuantitativa (valor K), que oscila entre 10-4 y 10-10 (Tabla 1), refleja esta reacción:
RR’NCl + H2O ⇌ RR’NH + HOCl
K = [RR’NH][HOCl] / [RR’NCl]
| N-Cloroamina | Valor K |
|---|---|
| Ácido tricloroisocianúrico | 6,7 × 10-4 |
| 1,3-Dicloro-5,5-dimetilhidantoína | 2,5 × 10-4 |
| N-clorosuccinimida | 6,6 × 10-5 |
| Dicloramina-T | 8,0 × 10-7 |
| Cloramina-T | 4,9 × 10-8 |
| Monocloroamina | 2,8 × 10-10 |
Este valor de K se relaciona con el poder bactericida de las N-cloroaminas, ya que su eficacia depende de la generación de ácido hipocloroso en el agua.
Los enlaces N-Cl en las N-cloroaminas son covalentes y se hidrolizan fácilmente, liberando ácido hipocloroso. Presentan inestabilidad térmica, a menudo no se derriten de manera congruente y potencialmente explotan a altas temperaturas. La tricloroamina (NCl3) es un compuesto particularmente inestable y puede provocar explosiones incluso como impureza.
El almacenamiento adecuado de N-cloroaminas requiere temperaturas frescas y protección contra la luz, el agua, las aminas y los compuestos de amonio, los ácidos y bases fuertes y el material orgánico que se oxida fácilmente.
2. Reacciones de las cloroaminas
Muchas N-cloroaminas demuestran funciones valiosas como reactivos o intermediarios en diversas reacciones orgánicas.
Degradación de Hofmann: las N-cloroamidas derivadas de ácidos carboxílicos orgánicos se reducen con álcalis para producir las aminas correspondientes con alta eficiencia. Esta reacción, conocida como degradación de Hofmann, se utiliza para la síntesis de aminas aromáticas, aminas heterocíclicas y aminas alicíclicas.
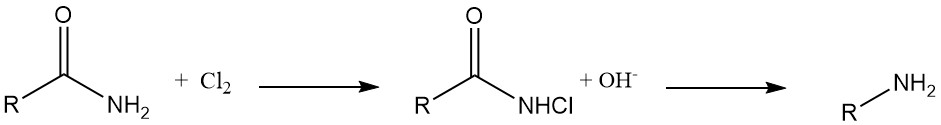
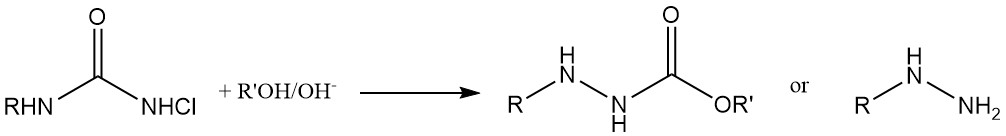
Síntesis de hidrazinas: Las N-cloroureas se transforman en hidracinas tras el tratamiento con una base en soluciones de alcohol o agua.
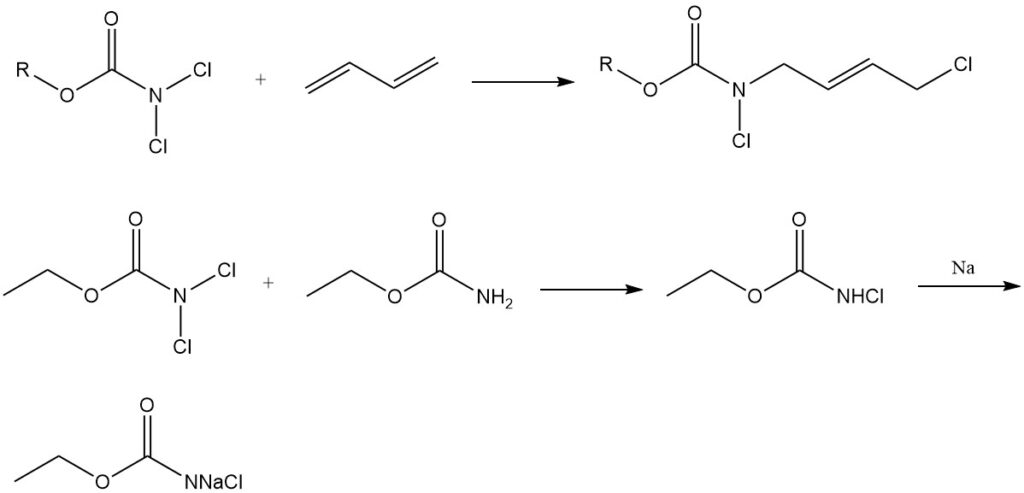
Agentes clorantes y adición de dieno: Los N,N-diclorocarbamatos (Cl2NCOOR) se utilizan como agentes clorantes. agentes y también participan en reacciones de adición con dienos. Además, actúan como materiales de partida para la síntesis de N-halo-N-metalocarbamidatos, intermediarios importantes en la producción de derivados carbamato de compuestos fisiológicamente activos.
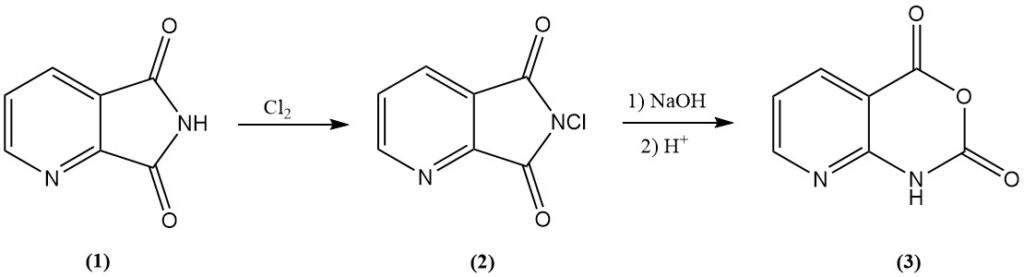
El anhídrido 8-azaisatoico (3), un intermedio en varios agroquímicos, se obtiene eficientemente clorando 2,3-piridinadicarboximida (1) a N-cloro-2,3-piridinadicarboximida (2), seguido de un tratamiento alcalino.
Síntesis de anillos heterocíclicos: las N-cloroamidinas y las N-cloroguanidinas se utilizan como materia prima para la producción de sistemas de anillos heterocíclicos como imidazoles, tiazoles y oxadiazoles.
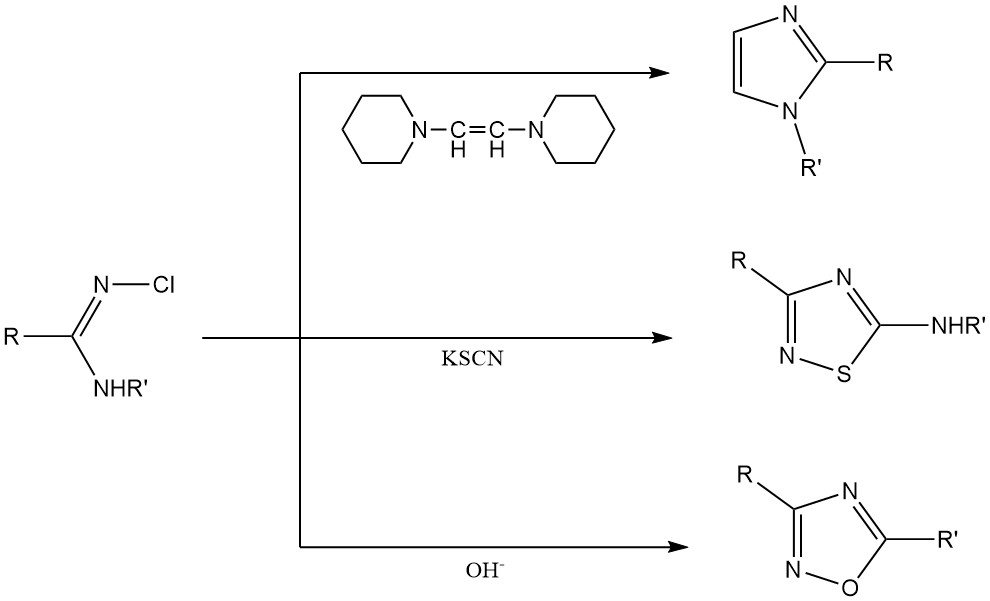
3. N-Cloroaminas inorgánicas
La monocloroamina (NH2Cl) es un líquido incoloro y de olor fuerte que es más estable en soluciones acuosas que otras N-cloroaminas como la dicloroamina (NHCl2) y tricloroamina (NCl3). Su principal aplicación es la desinfección del agua potable. También se utiliza como agente oxidante en síntesis orgánica, particularmente para fosfinas trisustituidas.
Las N-cloroaminas se sintetizan mediante reacciones de pH controlado entre sales de amonio y ácido hipocloroso o cloro.
Es importante tener extrema precaución al manipular N-cloroaminas puras debido a su inestabilidad y explosividad inherentes, incluso a temperatura ambiente.
Ácido N-clorosulfámico (ClSO2NH2), (ácido N,N-diclorosulfámico y N-cloroimidodisulfonato de sodio (ClSO2NNaSO2) se utilizan como desinfectantes y blanqueadores para papel o tejidos y se producen a partir de ácido sulfámico y ácido hipocloroso.
4. Ácidos N-cloroisocianúricos
Los ácidos N-cloroisocianúricos (cloroisocianuratos), como el ácido tricloroisocianúrico (Symclosene o TCC) y el dicloroisocianurato de sodio (DCC-Na), están experimentando un aumento notable en su uso como desinfectantes. Esta creciente popularidad se debe a su estabilidad superior y facilidad de uso en comparación con los hipocloritos metálicos tradicionales.
La Tabla 2 enumera algunas propiedades físicas importantes de TCC y DCC-Na.
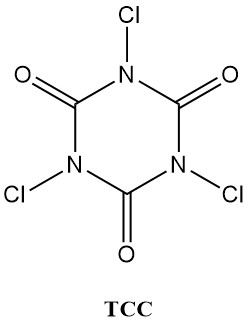
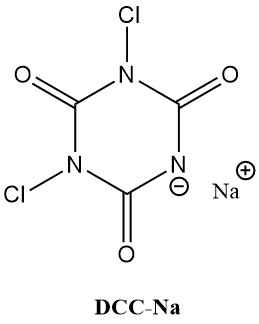
| Propiedad | TCC | DCC-Na |
|---|---|---|
| Número CAS | [87-90-1] | [2893-78-9] |
| Forma física | Polvo blanco | Polvo blanco |
| Fórmula | (ClNCO)3 | Cl2Na(NCO)3 |
| Señor | 232,44 | 219,98 |
| Punto de fusión | 234 °C (descomp.) | 225 °C (descomp.) |
| Cloro disponible teórico (%) | 91,5 | 64,5 |
| Cloro disponible Valor típico | 90.0 | 62,0 |
| pH (solución acuosa al 1 %) | 2.7 – 3.3 | 6.2 – 6.8 |
| Solubilidad en agua (25 °C) (g/100 g) | 1.0 | 30.0 |
| Solubilidad en acetona (30 °C) | 35,0 | 0,5 |
TCC y DCC-Na han adquirido una importante cuota de mercado históricamente dominada por el hipoclorito de calcio, los aceites de pino, las sales de amonio cuaternario y los fenoles.
Los ácidos N-cloroisocianúricos se producen mediante una reacción de cloración continua del ácido isocianúrico en hidróxido de sodio acuoso a bajas temperaturas (0-15 °C). Es importante un control preciso tanto del pH como de la temperatura de reacción para evitar la formación de la altamente explosiva tricloroamina (NCl3).
El ácido tricloroisocianúrico (TCC) se descompone gradualmente en un medio alcalino para generar subproductos como tricloroamina (NCl3), dicloroamina (NHCl2) y monocloroamina (NH2Cl).
Tanto el dicloroisocianurato de sodio (DCC-Na) como su dihidrato tienen una mayor solubilidad en agua en comparación con el TCC. El dihidrato de DCC-Na se obtiene enfriando una solución acuosa saturada de DCC-Na (45°C) a 10°C; esta forma ofrece una estabilidad térmica mejorada en comparación con su forma anhidra.
El poder desinfectante y sanitario de los ácidos N-cloroisocianúricos se debe a su liberación gradual de ácido hipocloroso (HOCl) en el agua, que presenta propiedades tanto oxidantes como biocidas.
Estos compuestos se utilizan para muchos propósitos, entre ellos:
- Tratamiento de lana que no encoge: Protegen las fibras de lana del encogimiento durante el procesamiento.
- Desinfección de piscinas: Los ácidos N-cloroisocianúricos eliminan eficazmente los microorganismos nocivos de las piscinas, manteniendo la higiene del agua.
- Limpieza y desinfección de baños.
- Lejía para ropa: se utilizan como lejía para ropa eficaz para eliminar manchas y realzar la blancura.
Los limpiadores y desinfectantes a base de ácido N-cloroisocianúrico a menudo incluyen componentes adicionales como fosfatos, metasilicatos de sodio, tensioactivos y sales neutras (sulfato de sodio, carbonato de sodio).
Esta combinación mejora sus capacidades de eliminación de grasa y proteínas, lo que los hace ideales para diversas tareas de limpieza. Se recomiendan para el lavado de vajilla en hoteles, hospitales, restaurantes e instalaciones de procesamiento de alimentos debido a su eficacia contra diversos microorganismos.
5. N-Cloroaminas Orgánicas
A continuación se enumeran varios compuestos orgánicos de N-cloroamina y sus aplicaciones:
1,3-dicloro-5,5-dimetilhidantoína (dactina) (4)
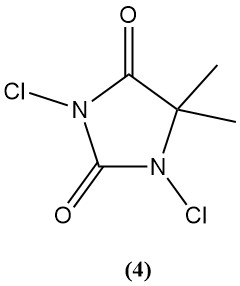
- Peso molecular: 197,03 g/mol
- Punto de fusión: 132 °C
- Contenido teórico de cloro: 77,6%
- Solubilidad en agua: 2,1 g/L
- Se prepara clorando 5,5-dimetilhidantoína acuosa.
- Históricamente se utilizó como bactericida y desinfectante, pero su uso disminuyó debido a la competencia de TCC y Di-Halo.
1-Bromo-3-cloro-5,5-dimetilhidantoína (Di-Halo) (5)
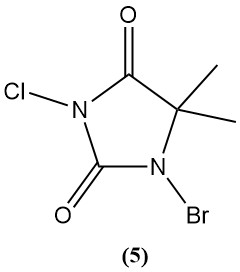
- Peso molecular: 241,48 g/mol
- Punto de fusión: 130 °C (descomp.)
- pH: 2,88 (solución al 0,1 %)
- Solubilidad en agua (20°C): 2 g/L
- Se prepara mediante bromación y cloración secuencial de 5,5-dimetilhidantoína.
- Es un polvo blanco estable sin formación de cloroamina en soluciones débilmente básicas.
- Se utiliza ampliamente como desinfectante de piscinas (0,5 a 3 mg/l de halógeno activo) debido a su estabilidad, actividad de amplio espectro y larga vida útil.
1-cloro-2,5-pirrolidinediona (N-clorosuccinimida) (6)
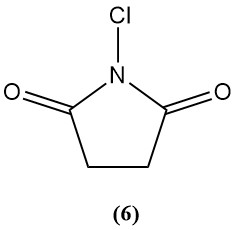
- Peso molecular: 133,54 g/mol
- Punto de fusión: 150–151 °C
- Es poco soluble en varios disolventes orgánicos.
- Cloro disponible: 50–54 %
- Se utiliza principalmente como agente clorante de síntesis orgánica.
N-cloroglicolurilos
- Se estudian como agentes protectores contra gases venenosos.
- Se preparan mediante condensación de 1,2-dicetona con urea, seguida de cloración.
- 2,4,6,8-tetracloro-2,4,6,8-tetrazabi-ciclo[3.3.0]octano-3,7 -dione (7) es un ejemplo importante de esta clase.
![2,4,6,8-tetrachloro-2,4,6,8-tetrazabi-cyclo[3.3.0]octane-3,7-dione structure](https://chemcess.com/wp-content/uploads/2024/02/2468-tetrachloro-2468-tetrazabi-cyclo3.3.0octane-37-dione-structure.jpg)
1,3,4,6-Tetracloro-3α,6α-difenilglicolurilo (Iodogen) (8)
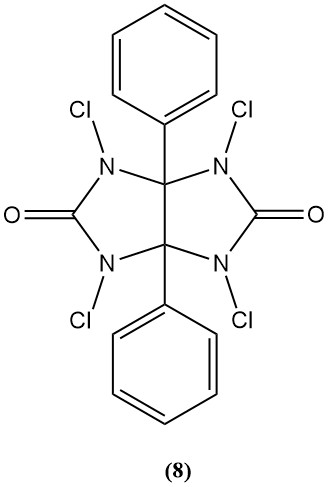
- Peso molecular: 431,94 g/mol
- Se utiliza como bactericida y agente oxidante en la síntesis de péptidos.
3-cloro-4,4-dimetil-2-oxazolidinon (9)
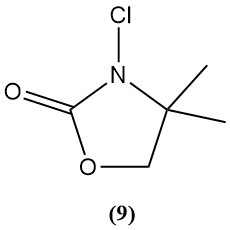
- Peso molecular: 149,50 g/mol
- Es un ejemplo de una nueva clase de N-cloroaminas que se está investigando como desinfectantes.
N-cloro-p-toluenosulfonamida sódica (cloramina-T) (10)
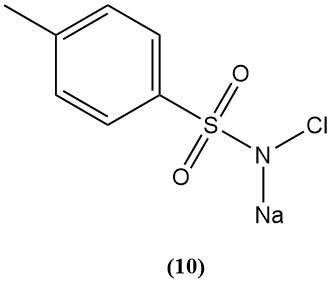
- Peso molecular: 227,67 g/mol (hidrato)
- Punto de fusión: 175 °C; explosivo
- Cloro disponible: 25%
- Se prepara clorando p-toluenosulfonamida en hidróxido de sodio.
- Es un electrolito fuerte en ácido, un buen agente oxidante en base y bastante soluble en agua e insoluble en benceno.
- Reacciona con gas mostaza para formar cristales de sulfimida inofensivos.
- Sus derivados se estudian como protección contra gases venenosos.
N,N’,N»-tricloromelamina (11)
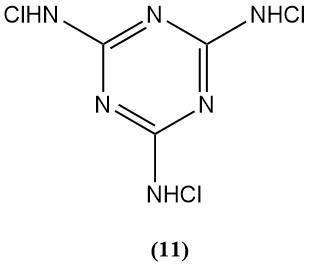
- Peso molecular: 229,46 g/mol
- Punto de fusión: 175°C (descomp.)
- Contenido teórico de cloro: 92,8%
- Se utiliza como agente esterilizante, limitado por su baja solubilidad en agua.
Los derivados de aminoácidos N-clorados están bajo investigación por su potencial como agentes blanqueadores y bactericidas.
6. Toxicología de las N-cloroaminas
Las N-cloroaminas se emplean ampliamente en el agua potable, las piscinas y el procesamiento de alimentos, lo que requiere una cuidadosa consideración de sus posibles efectos toxicológicos.
Cuando se utiliza en agua rica en compuestos orgánicos, se requiere especial vigilancia para evitar la formación de halometanos débilmente cancerígenos. Su presencia a menudo se cuantifica mediante métodos de espacio de cabeza, trampa de purga o extracción con solventes, seguidos de análisis por GC con detectores de captura de electrones o GC-MS.
La mayoría de las N-cloroaminas presentan efectos irritantes locales en los ojos, la piel húmeda y el tracto respiratorio superior. Las soluciones diluidas (hasta 100 ppm de cloro disponible) de ácidos N-cloroisocianúricos generalmente no presentan problemas de toxicidad, irritación o sensibilización.
Sin embargo, la ingestión de sólidos puros o suspensiones concentradas puede dañar el revestimiento del estómago. Además, el ácido isocianúrico, formado tras la hidrólisis, posee una baja toxicidad inherente. En la Tabla 3 se proporciona un resumen de los valores de toxicidad aguda para N-cloroaminas seleccionadas.
| Compuesto | LD50 (mg/kg, rata, oral) |
|---|---|
| TCC | 1300 |
| DCC-Na | 1420 |
| 1,3-Dicloro-5,5-dimetilhidantoína | 542 |
| N-clorosuccinimida | 2700 |
- Cloramina-T: aunque irrita la piel, este compuesto presenta una toxicidad significativa al absorberse en el torrente sanguíneo, lo que requiere su uso solo en soluciones diluidas.
- Monocloroamina: a pesar de presentar un menor riesgo de formación de halometano, su uso generalizado en la desinfección del agua potable genera preocupación debido a su posible toxicidad mutagénica y acuática. La Agencia de Protección Ambiental de Estados Unidos ha propuesto incluso prohibir su uso en el agua potable.
Los estudios sugieren que la 1-bromo-3-cloro-5,5-dimetilhidantoína presenta una menor toxicidad hacia especies de peces específicas en comparación con la 1,3-dicloro-5,5-dimetilhidantoína.
Referencia
- Chloroamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_553
