Benzotricloruro: reacciones, producción y usos
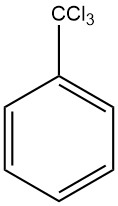
El benzotricloruro es el producto resultante de la cloración exhaustiva de la cadena lateral del tolueno, también conocido como (triclorometilbenceno, α,α,α-triclorotolueno, fenilcloroformo).
La síntesis del benzotricloruro fue realizada inicialmente en 1858 por L. SCHISCHKOFF y A. ROSING, empleando la reacción entre PCl5 y cloruro de benzoílo.
Hoy en día, debido a su importante papel como intermediario crucial en la síntesis de cloruros de ácido (específicamente cloruro de benzoílo), colorantes, herbicidas, pesticidas y varios otros productos, el benzotricloruro se produce a gran escala.
Tabla de contenido
Propiedades físicas del benzotricloruro
Benzotricloruro, un líquido incoloro que posee un olor acre y es irritante para los ojos y las membranas mucosas. Genera humos cuando se expone al aire húmedo.
El etanol, el éter dietílico y el cloroformo son buenos disolventes del benzotricloruro. Sin embargo, su solubilidad en agua es limitada, con sólo 0,05 g por litro a 5°C y 0,25 g por litro a 39°C. En particular, la hidrólisis se produce durante el proceso de disolución en agua.
La cantidad de cloro que se puede disolver en 100 gramos de benzotricloruro depende de la temperatura. A 30°C, la solubilidad es de 5,1 gramos, mientras que a 50°C disminuye a 3,4 gramos y a 100°C se reduce aún más a 1,3 gramos.
Las propiedades físicas del benzotricloruro son las siguientes:
- Masa molar = 195,48 g/mol
- Punto de ebullición = 220,7 °C
- Punto de fusión = -4,5 °C
- Densidad = 1,373 a 20 °C
- Índice de refracción = 1,558 a 20 °C
- Punto de inflamación = 108 °C
- Temperatura de ignición = 420 °C
Reacciones químicas del benzotricloruro
El ácido benzoico se produce mediante hidrólisis ácida o alcalina del benzotricloruro, mientras que la hidrólisis parcial produce cloruro de benzoílo.
Cuando el benzotricloruro reacciona con ácidos carboxílicos, produce los cloruros de ácido correspondientes, así como el cloruro de benzoílo.
La condensación de benzotricloruro con benceno, en presencia de catalizadores como FeCl3, AlCl3 o ZnCl2, conduce a la formación de difenil- y trifenilmetano.
El tratamiento del benzotricloruro con ácido fluorhídrico o fluoruros permite la sustitución de los tres átomos de cloro por flúor.
Al hacer reaccionar benzotricloruro con alcoholes anhidros, se pueden preparar ortoésteres de ácido benzoico.
La hidrólisis del benzotricloruro se puede lograr reaccionando con agua.
Producción de benzotricloruro
Se puede utilizar un método similar al procedimiento empleado para el cloruro de bencilo para la cloración exhaustiva de la cadena lateral del tolueno, facilitando la producción de benzotricloruro. Para este fin se emplea habitualmente en particular la cloración fotoquímica.
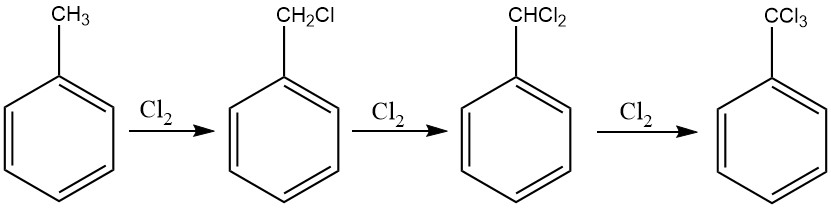
En procesos continuos es recomendable implementar una cascada de seis a diez reactores para evitar la formación de derivados clorados en anillo. Este enfoque permite controlar la alimentación de cloro, asegurando que se obtenga benzotricloruro con cantidades mínimas de cloruro de benzal.
La Figura 1 muestra una planta operada continuamente diseñada para la producción de benzotricloruro. El tolueno fresco se dirige a través del preclorador (R0) y posteriormente ingresa al primer reactor en la cascada de ocho reactores. Los reactores se cargan con cantidades decrecientes de cloro.
Normalmente, el último reactor de la cascada se purga con nitrógeno puro para eliminar el cloro gaseoso residual. A efectos de eliminación de gases residuales (indicados por líneas discontinuas), los reactores se pueden clasificar en tres grupos.
Los reactores R1-R3 reciben una dosificación precisa de cloro, la mayor parte del cual se consume durante la reacción. El gas de escape de los reactores R4-R8 contiene una mayor concentración de cloro debido a la cloración avanzada del material en estos reactores. En consecuencia, este gas se recicla a los reactores R1 y R2.
Asimismo, los gases de escape de los reactores R1-R4 se introducen en el preclorador (R0), que contiene la mayor proporción de tolueno, para eliminar posibles restos de cloro. Por tanto, el gas de escape del reactor R0 está desprovisto de cloro y se dirige al sistema de lavado para eliminar el HCl.
Al controlar con precisión las alimentaciones de cloro y tolueno, esta técnica logra una conversión casi completa de tolueno en benzotricloruro, generando gases residuales compuestos predominantemente de cloruro de hidrógeno y nitrógeno, sin cloro presente.

Para mejorar el rendimiento y la velocidad de reacción, es imperativa la exclusión del oxígeno y se pueden agregar cantidades catalíticas de bromo, cloruro de amonio o una combinación de tricloruro de fósforo y disulfuro de bis(dimetiltiocarbamoil).
La cloración de metilbencenos en los tricloruros correspondientes como disolventes, que se afirma que ofrece un alto rendimiento de productos de alta pureza, presenta un método alternativo para la producción de benzotricloruro.
Otro proceso de fabricación de benzotricloruro implica la cloración de éter dibencílico, un subproducto obtenido durante la conversión de cloruro de bencilo en alcohol bencílico. Este proceso de cloración produce una mezcla de benzotricloruro y cloruro de benzoílo, que posteriormente puede procesarse para obtener cloruro de benzoílo puro.
Este enfoque mejora indirectamente la viabilidad económica de la producción de alcohol bencílico.
Usos del benzotricloruro
La aplicación principal del benzotricloruro radica en su utilización para la producción de cloruro de benzoílo mediante hidrólisis parcial con agua o reacción con ácido benzoico.
El benzotricloruro también encuentra aplicaciones a menor escala en diversas industrias. Se emplea en la producción de productos farmacéuticos y agroquímicos, particularmente después de sufrir una transformación en benzotrifluoruro. Además, sirve como precursor para la síntesis de colorantes y estabilizadores UV de tipo benzofenona.
Toxicología del benzotricloruro
El benzotricloruro es una sustancia química tóxica que puede causar irritación en la piel, los ojos y el tracto respiratorio. También es un probable carcinógeno para los humanos.
La toxicidad oral aguda (DL50) del benzotricloruro es de 2188 mg/kg en ratas macho y de 1590 mg/kg en ratas hembra. Esto significa que el 50% de las ratas morirán si ingieren 2188 mg/kg o 1590 mg/kg de benzotricloruro, respectivamente.
Los valores de CL50 para el benzotricloruro son superiores a 600 mg/m³ en ratas macho y aproximadamente 500 mg/m³ en ratas hembra después de un período de exposición de 4 horas. Esto significa que el 50% de las ratas morirán si se exponen al vapor de benzotricloruro en una concentración superior a 600 mg/m³ o aproximadamente 500 mg/m³, respectivamente, durante 4 horas.
También se ha demostrado que el benzotricloruro es mutagénico en sistemas de prueba bacterianos. Esto significa que puede provocar cambios en el ADN que pueden provocar cáncer.
La exposición por inhalación de ratones hembra al benzotricloruro ha provocado tumores de pulmón y piel tanto benignos como malignos. En un estudio de tumores de pulmón en ratones, la inyección intraperitoneal de benzotricloruro aumentó la incidencia de adenomas de pulmón.
Además, la administración oral de benzotricloruro a 40 ratones hembra durante 25 semanas indujo neoplasias en el estómago, los pulmones y la glándula tímica en la dosis más alta.
Estos hallazgos sugieren que el benzotricloruro es un carcinógeno potencial para los humanos. Es importante evitar la exposición a este químico tomando las precauciones de seguridad adecuadas al manipularlo.
Referencia
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
