Benceno: Propiedades, Reacciones y Usos
El benceno (C6H6) es un líquido incoloro, inflamable y de olor dulce. Es un compuesto aromático de un solo anillo, lo que significa que sus átomos de carbono están dispuestos en un anillo con enlaces simples y dobles alternos. El benceno es térmicamente estable y químicamente reactivo, lo que lo convierte en un valioso precursor de muchas otras sustancias químicas.
El benceno se utiliza principalmente para producir estireno, fenol y ciclohexano, que se utilizan en la fabricación de plásticos, resinas y otros productos. También se utiliza como disolvente, pero su uso ha disminuido debido a su alta toxicidad. El benceno también es un componente de la gasolina, donde se utiliza para aumentar el octanaje.
El benceno fue aislado por primera vez por Michael Faraday en 1825 y los procesos de producción comercial se desarrollaron a mediados del siglo XIX. Hoy en día, el benceno se obtiene principalmente del petróleo.
Tabla de contenido
1. Propiedades físicas del benceno
La estructura Kekulé del benceno, un anillo de seis carbonos con enlaces simples y dobles alternos, no puede explicar sus propiedades. El benceno es más estable de lo esperado, su espectro de RMN es inusual y las longitudes de sus enlaces son intermedias entre enlaces simples y dobles. También es más reactivo que los hidrocarburos simples.
Estas propiedades sugieren que el benceno tiene una estructura híbrida, con electrones deslocalizados.
La Tabla 1 proporciona propiedades físicas importantes del benceno:
| Propiedad | Valor |
|---|---|
| Peso molecular | 78,11 g/mol |
| Olor | Dulce |
| Color | Incoloro |
| Densidad a 20 °C | 0,879 g/cm³ |
| Punto de fusión | 5,53 °C |
| Punto de ebullición | 80,01 °C |
| Índice de refracción a 20 °C | 1.501 |
| Densidad crítica | 0,309 g/cm³ |
| Presión crítica | 48,9 bares |
| Temperatura crítica | 288,9 °C |
| Punto de inflamación | -11 °C |
| Temperatura de ignición | 595°C |
| Límites de explosión en el aire (vol%) | 1,4–6,7 |
| Viscosidad a 20 °C | 0,654 mPa·s |
| Solubilidad en agua | Ligeramente soluble |
| Solubilidad en disolventes orgánicos | Miscible con la mayoría de disolventes orgánicos |
2. Propiedades químicas del benceno
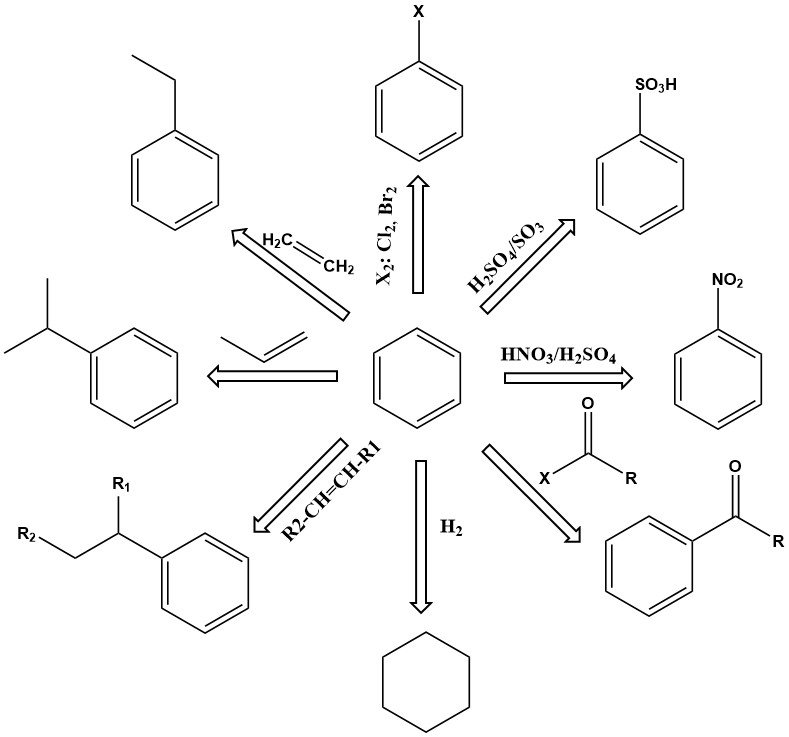
El benceno, como unidad básica de los compuestos aromáticos, es una importante sustancia química industrial con una amplia gama de aplicaciones. Es térmicamente estable y sufre una variedad de reacciones, incluidas sustitución, adición y deshidrogenación, para producir una gran variedad de productos útiles.
Las reacciones de sustitución del benceno son de primordial importancia. Dependiendo de las condiciones de reacción, uno o más átomos de hidrógeno en el anillo de benceno pueden intercambiarse por nitro, ácido sulfónico, amina, hidroxilo, cloro, bromo u otros grupos. Los productos incluyen fenol, nitrobenceno, clorobenceno, ácido bencenosulfónico y muchos otros.
Otras reacciones importantes del benceno implican adición, como la alquilación y la hidrogenación. Estas reacciones generalmente tienen lugar a temperatura y presión elevadas, y a veces requieren catalizadores activos.
Por ejemplo, el etilbenceno se produce mediante la alquilación de benceno con etileno en presencia de un catalizador de cloruro de aluminio.
El cumeno es otro importante producto de adición primaria del benceno, producido por la alquilación catalítica en fase de vapor del benceno con propeno sobre ácido fosfórico o catalizadores de kieselguhr a 200–250 °C y 2,7–4,2 MPa de presión manométrica.
La hidrogenación también es una reacción de adición. Uno de los más importantes es la hidrogenación del benceno para producir ciclohexano.
La deshidrogenación del etilbenceno a estireno es una reacción comercial importante. Esta reacción endotérmica requiere alta temperatura para desarrollarse cinética y termodinámicamente.
El benceno es una materia prima esencial para la producción de muchos otros productos químicos importantes, incluidos plásticos, resinas, detergentes y productos farmacéuticos. La mayoría de las reacciones analizadas en este capítulo son reacciones primarias del benceno. Innumerables reacciones y productos dependen del benceno, directa o indirectamente, como fuente.
3. Materias primas para el benceno
El benceno y sus homólogos, como el tolueno y los xilenos, se encuentran en el petróleo crudo en pequeñas cantidades, lo que hace que la separación física y la recuperación no sean prácticas. Las fracciones de petróleo crudo de Arabia Saudita y el Reino Unido tienen bajos contenidos de benceno, tolueno y xileno (BTX), pero mayores contenidos de nafteno.
Los crudos más pesados y los crudos sintéticos de arenas bituminosas pueden tener contenidos aromáticos más altos en la fracción de nafta ligera. Un análisis de la fracción de nafta C5-150 °C de un crudo convencional y una nafta sintética derivada de arenas bituminosas de Athabasca muestra que la nafta sintética tiene menores contenidos de aromáticos y nafteno que la fracción de crudo convencional.
Sin embargo, la mayor fracción de nafta del crudo sintético tiene un contenido aromático considerablemente mayor (32 frente a 19%), aunque el contenido de nafteno es menor. Es probable que esto se deba a la desalquilación o apertura del anillo de los aromáticos de mayor masa molecular en el betún.
- Visite el enlace para ver un artículo detallado sobre la producción de benceno →
4. Usos del benceno
El benceno se utiliza para producir etilbenceno, cumeno y ciclohexano, que representan entre el 75% y el 80% de su consumo como materia prima química.
El etilbenceno se deshidrogena a estireno, el monómero de polímeros importantes como las resinas acrílicas-butadieno-estireno y el caucho de estireno-butadieno.
El cumeno se utiliza para producir fenol y acetona. El fenol se utiliza principalmente para resinas fenólicas.
El ciclohexano se utiliza para producir ácido adípico, que se utiliza para fabricar nailon.
Alrededor del 5% del benceno se nitra a nitrobenceno, que luego se hidrogena a anilina.
El benceno también se puede oxidar a anhídrido maleico, un precursor de las resinas de poliéster.
Otros productos de benceno incluyen bencenos halogenados y alquilbencenos lineales, que se utilizan para fabricar detergentes.
5. Toxicología y Salud Ocupacional del Benceno
El benceno es un compuesto tóxico que puede provocar efectos agudos y crónicos. Se absorbe por inhalación, ingestión o absorción cutánea. La intoxicación aguda puede provocar dolores de cabeza, confusión, pérdida del control muscular e irritación del tracto respiratorio y gastrointestinal. Concentraciones más altas pueden provocar pérdida del conocimiento o la muerte. La exposición crónica puede provocar anemia y leucemia.
La inhalación es la principal fuente de intoxicación por benceno. La ingestión puede causar irritación de la boca, el esófago y el estómago. La absorción cutánea no es una fuente importante de intoxicación.
Varios estudios han investigado la toxicidad del benceno. Es absorbido selectivamente por los pulmones y retenido en diversos tejidos corporales. El benceno se metaboliza lentamente y forma intermediarios tóxicos. La susceptibilidad individual al envenenamiento varía.
La exposición al benceno se ha relacionado con leucemia, pancitopenia y anemia aplásica. Se necesita más investigación para determinar la relación causal exacta.
Las emisiones de benceno provienen de la gasolina para motores, la carbonización del carbón e históricamente de los solventes que contienen benceno.
La prevención del envenenamiento por benceno implica buenas prácticas de laboratorio y planta, minimizar las concentraciones en las áreas de trabajo y utilizar medidas de protección.
Los organismos reguladores han establecido límites de exposición al benceno y lo han clasificado como sustancia potencialmente cancerígena.
Las regulaciones recientes tienen como objetivo reducir las emisiones de compuestos orgánicos volátiles, incluido el benceno, de las refinerías de petróleo y las plantas químicas.
Los estudios en curso y los esfuerzos regulatorios reflejan el compromiso activo en la comprensión y el control de la toxicidad del benceno.
Se necesitan investigaciones continuas y medidas estrictas para mitigar los riesgos asociados con la exposición al benceno.
Referencia
- Benzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_475
