Antraquinona: Producción, Reacciones y Usos
La antraquinona es un sólido cristalino de color amarillo que es casi insoluble en agua y disolventes orgánicos a temperatura ambiente. Su solubilidad aumenta con la temperatura. La antraquinona se utiliza como precursor en la producción de una amplia gama de tintes, así como como catalizador en la elaboración de pulpa de madera.
La antraquinona se sintetizó por primera vez en 1835, pero su papel fundamental en la industria de los tintes no se realizó hasta 1868. Desde entonces, la química de las antraquinonas se ha expandido rápidamente, lo que ha llevado al desarrollo de nuevos tintes mordientes, tintes ácidos, tintes de tina, tintes dispersos y reactivos. tintes.
En las últimas décadas, la industria de las antraquinonas ha experimentado una transformación global. Se han desarrollado nuevos procedimientos de síntesis para satisfacer la creciente demanda de antraquinona y los métodos de procesamiento han evolucionado para volverse más eficientes y respetuosos con el medio ambiente.
Una de las aplicaciones más innovadoras de la antraquinona es su uso como catalizador en la elaboración de pulpa de madera alcalina. Esta rama de la química de las antraquinonas se está desarrollando rápidamente y tiene el potencial de superar las demandas de la industria de los tintes.
La demanda de antraquinona ha aumentado constantemente desde 1870 y la demanda anual actual supera las 30.000 toneladas métricas.
Tabla de contenido
1. Physical Properties of Anthraquinone
Physical Properties of Anthraquinone are listed in the following table:
| Propiedad | Valor |
|---|---|
| Número CAS | 84-65-1 |
| Fórmula química | C14H8O2 |
| Masa molar | 208,20 g/mol |
| Apariencia | La antraquinona cristalina son agujas delicadas de color amarillo claro a amarillo pálido. Cuando está finamente dividido o precipitado en ácido sulfúrico, parece casi incoloro. |
| Punto de fusión | 287°C |
| Punto de ebullición | 377°C |
| Clase de cristal | Monoclínica |
| Grupo espacial | P 21/a |
| Dimensiones de la celda unitaria |
|
| Densidad cristalina |
|
| Presión de vapor |
|
| Capacidad calorífica molar a presión constante (cp) | 265 J mol-1 K-1 |
| Entalpía de formación | -179 kJ/mol |
| Entalpía de combustión | 6449 kJ/mol a 25°C |
| Entalpía de fusión | 32,57 kJ/mol a 287°C |
| Punto de inflamación | 185°C |
| espectro ultravioleta | Cuatro bandas distintivas a 251 nm (emax 54000), 279 nm (emax 17600), 321 nm (emax 4800) y 377 nm (emax 110), cada una de las cuales exhibe una estructura vibratoria pronunciada. |
| Espectro IR | Muy pocas bandas, principalmente con una banda notable en nC=O = 1680 cm-1 debido a la alta simetría del compuesto. |
| Solubilidad |
|
| Otro |
|
2. Reacciones químicas de la antraquinona
2.1. Oxidación
- La antraquinona es estable a la oxidación en condiciones normales, pero puede oxidarse a alizarina en condiciones adversas con hidróxido de sodio y clorato de sodio.
- La antraquinona se puede oxidar a polihidroxiantraquinonas con ácido sulfúrico concentrado y ácido bórico, persulfatos o ácido metaarsénico a temperaturas superiores a 200 °C.
- Oleum también se puede utilizar para oxidar antraquinona a polihidroxiantraquinonas a temperaturas más bajas, dependiendo de su contenido de SO3.
- El ácido nítrico concentrado no oxida la antraquinona, sino que la nitra. Algunas mezclas de antraquinona y ácido nítrico pueden ser explosivas.
2.2. Reducción
- La antraquinona se puede reducir a antrahidroquinona con agentes reductores comunes o hidrógeno en presencia de un catalizador.
- El hiposulfito de sodio en una solución alcalina reduce la antraquinona a una sal de sodio de antrahidroquinona de color rojo sangre, que puede reorganizarse en su tautómero oxantrona en una solución ácida.
- Métodos de reducción más vigorosos, como el ácido clorhídrico de estaño o la hidrogenación catalítica a alta presión o temperatura, producen antrona, que existe en equilibrio con su tautómero antrol (9-hidroxiantraceno) y posteriormente se transforma en antraceno e hidroantraceno.
- Cuando se utiliza zinc o hidróxido de sodio, el diantranol se produce mediante dimerización.
- En determinadas condiciones de reacción, el proceso de reducción puede dirigirse específicamente a los dos núcleos externos, lo que lleva a la formación de 1,2,3,4-tetrahidroantraquinona u octahidroantraquinona.
2.3. Condensación
La antraquinona se puede condensar con glicerol, polvo de hierro y ácido sulfúrico para producir benzantrona.
2.4. cloración
- La antraquinona se puede clorar en óleum, principalmente en la posición alfa.
- Calentar la antraquinona con pentacloruro de antimonio o reactivos liberadores de cloro similares produce productos clorados que van desde monocloroantraquinona hasta percloroantraquinona.
2.5. Sulfonación e hidroxilación
- El ácido sulfúrico o el óleum pueden sulfonar y/o hidroxilar la antraquinona.
- El ácido sulfúrico concentrado sulfona principalmente la antraquinona por encima de 200°C.
- El oleum se utiliza normalmente para sulfonar antraquinona a temperaturas entre 140 °C y 160 °C, produciendo productos de reacción principales que incluyen ácidos β-sulfónicos como el ácido antraquinona-2-sulfónico, el ácido antraquinona-2,6-disulfónico y la antraquinona-2,7. -ácido disulfónico.
- En presencia de mercurio, la sulfonación ocurre predominantemente en la posición alfa, produciendo ácido antraquinona-1-sulfónico, ácido antraquinona-1,5-disulfónico y ácido antraquinona-1,8-disulfónico.
2.6. Nitración
- La nitración de antraquinonas requiere condiciones rigurosas, lo que da como resultado principalmente alfa-nitroantraquinonas junto con proporciones variables de beta-nitro y alfa,beta-dinitroantraquinonas.
- Se producen procesos de mono y dinitración, que a menudo producen productos de nitración impuros que requieren un procesamiento extenso para la separación en 1-nitroantraquinona, 1,5-dinitroantraquinona y 1,8-dinitroantraquinona.
3. Producción industrial de antraquinona
En la producción industrial de antraquinona se emplean varios procesos. El método más común es la oxidación del antraceno en fase de vapor utilizando aire. Sin embargo, el proceso de naftaleno y la síntesis a partir de anhídrido ftálico y benceno también están ganando protagonismo debido a la escasez de antraceno.
1. Oxidación del antraceno
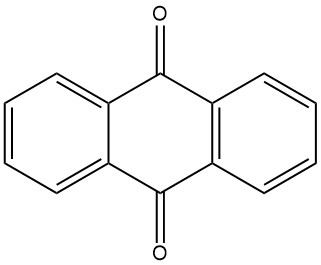
La antraquinona se sintetiza tradicionalmente a partir del antraceno, que se obtiene del alquitrán de hulla. Este proceso implica la oxidación del antraceno con ácido crómico en una solución de ácido sulfúrico al 48%. El subproducto del sulfato de cromo (III) debe transformarse en agentes curtientes. Este método requiere antraceno de alta pureza con un mínimo de 94% de pureza.
2. Oxidación en fase de vapor del antraceno
Aproximadamente el 85% de la producción mundial de antraquinona depende de la oxidación del antraceno en fase de vapor utilizando aire. Sin embargo, la disminución de la producción de antraceno ha provocado una escasez de suministro, lo que ha fomentado el proceso de naftaleno. La naftaleno está fácilmente disponible en el alquitrán de hulla y también se puede extraer de los aceites residuales obtenidos del reformado de gasolina.
3. Proceso de naftaleno
Este proceso lo emplea Kawasaki en Japón y Bayer en Europa. Implica una síntesis de antraquinona en tres pasos:
- La naftoquinona se prepara mediante oxidación en fase de vapor de naftaleno con aire.
- El butadieno se introduce en una reacción de Diels-Alder con la naftoquinona.
- La tetrahidroantraquinona resultante se somete a oxideshidrogenación.
Este proceso genera anhídrido ftálico como subproducto.
4. Síntesis de anhídrido ftálico y benceno
En regiones donde el antraceno no está suficientemente disponible a partir del alquitrán de hulla, la antraquinona se puede sintetizar a partir de anhídrido ftálico y benceno. Este proceso implica el uso de aproximadamente 1,4 toneladas métricas de cloruro de aluminio y de 4 a 6 toneladas métricas de ácido sulfúrico por tonelada de antraquinona.
Ha cobrado renovada importancia debido a la escasez de antraceno. La disponibilidad de anhídrido ftálico de bajo coste en cantidades suficientes, lograda mediante la oxidación económica de naftaleno u o-xileno con aire, ha contribuido al resurgimiento de esta ruta de síntesis.
5. Proceso de dimerización de estireno
A principios de la década de 1970, BASF introdujo otro intrigante proceso de producción de antraquinona. Este método comienza con la dimerización del estireno en 1-metil-3-fenilindano, facilitada por un catalizador ácido. Posteriormente, el 1-metil-3-fenilindano se convierte en antraquinona en fase vapor mediante oxidación con aire.
3.1. Oxidación del antraceno con ácido crómico
La producción industrial de antraquinona mediante oxidación del ácido crómico es un proceso eficiente y bien establecido. Es relativamente económico y puede realizarse en operaciones por lotes.
El proceso comienza con la preparación de una pasta de antraceno pulverizando finamente antraceno puro (94-95% de pureza) y mezclándolo con agua y un agente humectante en un recipiente mezclador. A continuación se oxida la pasta de antraceno añadiendo alternativamente porciones de ácido sulfúrico al 48% y una solución de dicromato de sodio al 20%. La reacción se controla para evitar una formación excesiva de espuma y un aumento de temperatura.
Una vez completada la oxidación, se filtra la mezcla de reacción y el material filtrado se lava y se suspende en agua. A continuación se filtra el producto de antraquinona en bruto y tiene una pureza de aproximadamente el 95%. La antraquinona cruda se puede procesar adicionalmente mediante secado o recristalización para lograr un nivel de pureza de hasta el 99%.
Este proceso suele combinarse con la producción de curtientes, ya que implica gastos mínimos de agente oxidante.
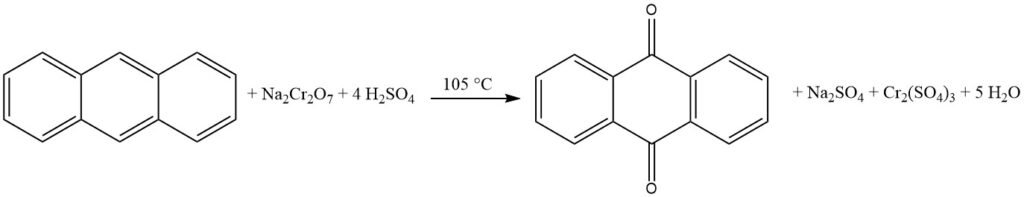
3.2. Oxidación en fase de vapor de antraceno con aire
La oxidación en fase de vapor del antraceno con aire es un método eficiente y bien controlado para la producción de antraquinona de alta pureza.
Se basa en el uso de catalizadores similares a los utilizados en la oxidación de naftaleno u o-xileno a anhídrido ftálico. El proceso se caracteriza por una alta conversión de antraceno, una mínima formación de subproductos y una alta pureza del producto.
El proceso comienza con la evaporación del antraceno utilizando una mezcla de aire y vapor de agua precalentada. Luego, la corriente de gas se mezcla cuidadosamente con aire adicional para evitar el riesgo de explosión. Luego, esta mezcla se dirige a un horno catalítico desde la parte inferior, donde se controla la temperatura.
El horno catalítico consta de 1.400 litros de material catalizador dispuestos en capas. La parte inferior, donde tiene lugar la reacción, se enfría a 390°C, mientras que la parte superior se calienta a 339°C. El catalizador suele ser vanadato de hierro, preparado a partir de vanadato de amonio y cloruro de hierro (III).
Los gases que salen del horno catalítico se someten a varias etapas de enfriamiento y filtrado para separar el producto de antraquinona de los gases subproductos.
El catalizador de vanadato de hierro utilizado en este proceso se prepara disolviendo óxido de hierro (III) rojo en ácido clorhídrico y agua. Luego se mezcla esta solución con vanadato de amonio en agua y se precipita. La solución resultante se evapora sobre piedra pómez en un molino de bolas calentable y a continuación se calcina. El catalizador resultante debería tener un color amarillo-marrón.
Con el tiempo, la actividad del catalizador puede disminuir, lo que lleva a una disminución en el rendimiento de antraquinona y un aumento en la producción de anhídrido ftálico. Para mantener o reactivar la actividad del catalizador, se puede agregar una pequeña cantidad de amoníaco al aire de oxidación o se puede lavar el catalizador agotado con una solución alcalina diluida.
Este proceso produce antraquinona con una alta pureza del 99%.
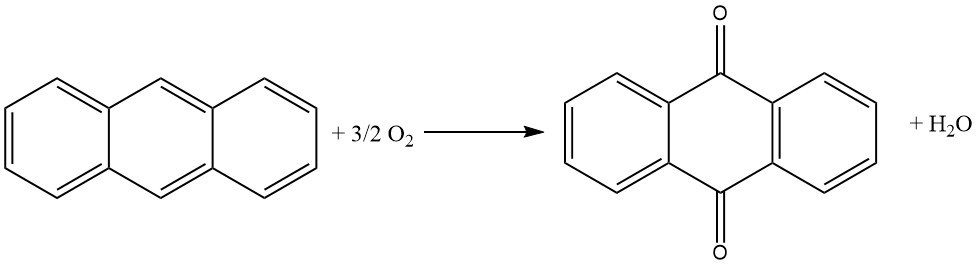
3.3. Proceso de naftaleno
El proceso de naftaleno, iniciado por Kawasaki Kasei Chemicals, es un proceso de tres pasos para producir antraquinona a partir de naftaleno.
Paso 1: oxidación de naftaleno
En el primer paso, la naftaleno se oxida con aire sobre un catalizador de pentóxido de vanadio para producir naftoquinona y anhídrido ftálico. La reacción se lleva a cabo en fase gaseosa a alta temperatura.
Paso 2: Reacción de Diels-Alder con Butadieno
En el segundo paso, la naftoquinona se hace reaccionar con butadieno en una reacción de Diels-Alder para producir tetrahidroantraquinona. La reacción se lleva a cabo en una fase líquida usando un disolvente orgánico como xileno o tetrahidroantraquinona.
Paso 3: Oxidehidrogenación de tetrahidroantraquinona
En el tercer paso, la tetrahidroantraquinona se oxida con aire para producir antraquinona. La reacción se lleva a cabo en una fase acuosa usando un catalizador alcalino.
Recuperación de anhídrido ftálico
El anhídrido ftálico producido en el primer paso se puede recuperar de la solución acuosa mediante cristalización y filtración.
Variante de Bayer del proceso de naftaleno
La variante de Bayer del proceso de naftaleno se diferencia del proceso Kawasaki Kasei en los siguientes aspectos:
- La oxidación de naftaleno se lleva a cabo con una mezcla de aire y gas de reacción reciclado.
- La reacción de Diels-Alder con butadieno se lleva a cabo sin purificar los productos de oxidación de naftaleno.
- La tetrahidroantraquinona se oxida a antraquinona en presencia de naftaleno.
- La antraquinona y el anhídrido ftálico se separan mediante destilación fraccionada.
3.4. Síntesis a partir de anhídrido ftálico y benceno
La síntesis de antraquinona a partir de anhídrido ftálico y benceno es un proceso de dos pasos:
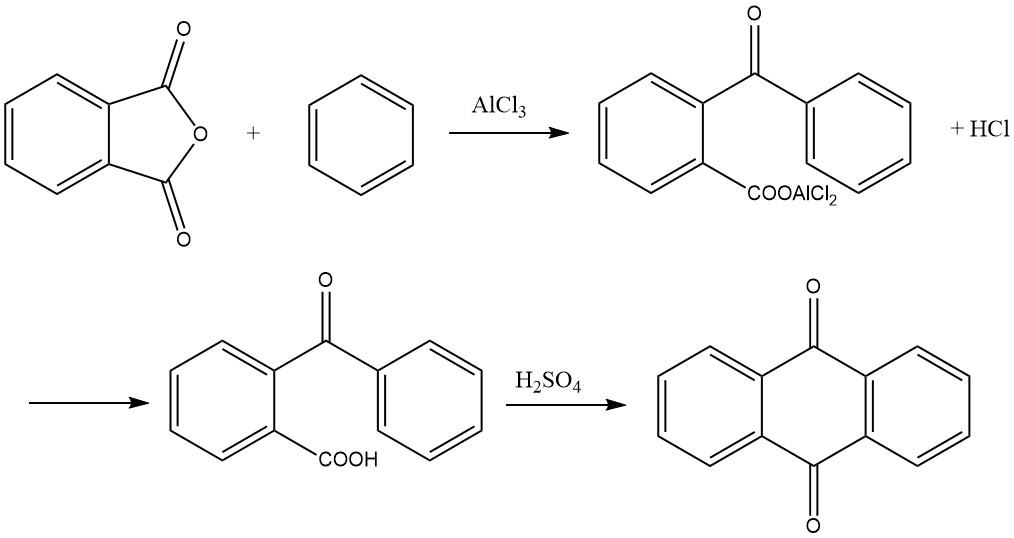
1. Formación de ácido o-benzoilbenzoico
En el primer paso, se forma ácido o-benzoilbenzoico mediante una acilación de Friedel-Crafts utilizando anhídrido ftálico y benceno como materiales de partida. Esta reacción produce un complejo de cloruro de aluminio de ácido o-benzoilbenzoico como producto primario, que puede solidificarse dentro del recipiente de reacción.
Para abordar este problema, se han propuesto varios métodos, que incluyen:
- Realizar la reacción con exceso de benceno para lograr rendimientos superiores al 95%.
- Realizar la reacción en un proceso libre de solventes en molinos de bolas, utilizando etilenglicol o 1,4-butanodiol para mitigar el problema de solidificación y reducir el exceso requerido de benceno.
La reacción normalmente transcurre con una relación molar de 1:1:2 para anhídrido ftálico, benceno y cloruro de aluminio. Tiene lugar a temperaturas inferiores a 45 °C y genera cloruro de hidrógeno como subproducto. Durante la reacción se produce una gran formación de espuma, lo que aumenta varias veces el volumen, lo que debe tenerse en cuenta al medir la carga inicial.
La finalización de la reacción está indicada cuando se ha desprendido 1 mol de cloruro de hidrógeno por mol de anhídrido ftálico. El producto de reacción resultante se coloca luego en una solución ácida diluida, precipitando ácido o-benzoilbenzoico. Este precipitado se separa, se lava y se seca, dando más del 95% del producto deseado.
2. Ciclación a antraquinona
En el segundo paso, el ácido o-benzoilbenzoico se puede convertir en antraquinona. Si bien es posible comenzar con el complejo de cloruro de aluminio formado en el primer paso y escindir 1 mol de cloruro de hidrógeno calentándolo a 200 °C para producir antraquinona, el método preferido en la práctica es condensar el ácido o-benzoilbenzoico seco con ácido sulfúrico. .
El ácido se disuelve en aproximadamente tres o cuatro veces su peso en ácido sulfúrico al 95-98% y se calienta a una temperatura que oscila entre 115 y 140 °C. La duración del calentamiento depende de factores como la cantidad y concentración del ácido sulfúrico y la temperatura.
Una vez completada la reacción, la antraquinona precipita al agregar agua y posteriormente se puede filtrar y secar. Alternativamente, se puede obtener una porción del producto en forma cristalizada gruesa enfriando directamente la solución de ácido sulfúrico. El rendimiento en este paso es casi cuantitativo.
La solución de condensación también se puede utilizar directamente para la producción de benzantrona o ácidos antraquinonasulfónicos.
3.5. Proceso de estireno
El proceso de estireno, desarrollado por BASF, es un proceso de varios pasos para producir antraquinona a partir de estireno. Es un método eficiente y versátil que produce antraquinona de alta pureza.
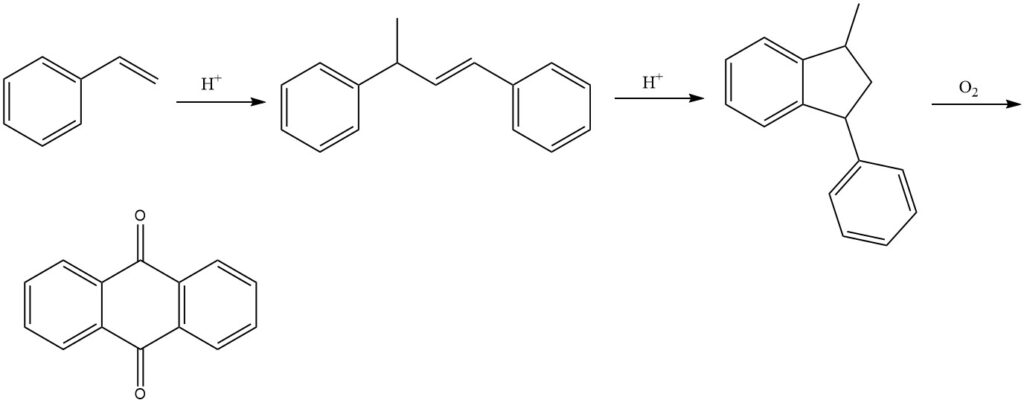
El proceso comienza con la dimerización del estireno en presencia de catalizadores ácidos para producir 1,3-difenil-2-buteno. A esto le sigue la ciclación del 1,3-difenil-2-buteno para formar 1-metil-3-fenilindano. Finalmente, el 1-metil-3-fenilindano se oxida con aire en fase vapor para producir antraquinona.
Se pueden utilizar varios catalizadores en la etapa de oxidación, como compuestos de vanadio (principalmente pentóxido de vanadio), a menudo en combinación con otros óxidos como el óxido de talio y el óxido de antimonio.
El proceso de estireno da como resultado rendimientos de aproximadamente el 77% para el producto final. Sin embargo, el producto de reacción precipitado aún puede contener subproductos, lo que requiere una purificación adicional para el aislamiento final de antraquinona pura.
4. Usos de la antraquinona
La antraquinona es una sustancia química versátil e importante que se utiliza en la producción de una amplia gama de productos, incluidos tintes, plásticos, productos farmacéuticos y papel.
Producción de tintes
La antraquinona se utiliza para producir una amplia gama de tintes, incluidos tintes ácidos, tintes básicos, tintes de tina, tintes dispersos y tintes reactivos. Estos tintes se utilizan en una variedad de industrias, incluidas la textil, la de plástico y la de impresión.
Producción de plásticos
La antraquinona también se utiliza en la producción de plásticos, como el tereftalato de polietileno (PET) y el tereftalato de polibutileno (PBT). Estos plásticos se utilizan en una variedad de productos, incluidos envases de alimentos, botellas de bebidas y componentes eléctricos.
Producción farmacéutica
La antraquinona también se utiliza en la producción de productos farmacéuticos, como laxantes y antiinflamatorios.
Producción de papel
La antraquinona se utiliza en la industria papelera como catalizador redox para facilitar la hidrólisis alcalina de la lignina polimérica. Esto conduce a un mayor rendimiento de pulpa y un menor tiempo de cocción.
Otras aplicaciones
La antraquinona también se utiliza en una variedad de otras aplicaciones, como la producción de desnaturalizantes para la protección de semillas, la modificación de aceites vegetales y la mejora de la colofonia.
Tendencias recientes
En los últimos años, ha habido un cambio en la producción de tintes de antraquinona de ácidos sulfónicos a compuestos nitro debido a preocupaciones ambientales. El proceso de ácido sulfónico genera grandes cantidades de aguas residuales, mientras que el proceso de compuestos nitro es más eficiente y produce menos desechos.
5. Toxicología de la antraquinona
La antraquinona es una sustancia química relativamente no tóxica. Se considera biológicamente inerte, lo que significa que está inactivo en los sistemas biológicos. Probablemente esto se deba a su baja solubilidad tanto en agua como en lípidos.
Faltan datos toxicológicos disponibles sobre la antraquinona, pero los estudios han demostrado que es menos irritante para los ojos que la benzoquinona y tiene un nivel similar de inercia al del polvo inerte.
Se ha recomendado un valor MAK de 10 mg/m3 para la antraquinona en entornos laborales. Esto significa que se considera que el polvo de antraquinona tiene un riesgo bajo para la salud.
Referencia
- Anthraquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_347
