Anhídrido acético: Reacciones, Producción y Usos
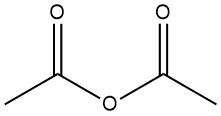
El anhídrido acético es un compuesto orgánico con la fórmula química (CH3CO)2O. Es un líquido incoloro con un olor acre y se usa comúnmente como agente acetilante y deshidratante. Fue preparado en 1852 mediante la reacción de cloruro de benzoílo y acetato de potasio fundido.
Desde entonces, el anhídrido acético se ha convertido en un destacado intermediario orgánico de gran importancia en diversas aplicaciones industriales y de investigación. Actualmente, se utiliza ampliamente en síntesis tanto académica como industrial.
El anhídrido acético se encuentra en pequeñas cantidades en las uvas para vinificación (Vitis vinifera), pero se produce principalmente de forma industrial.
Tabla de contenido
1. Propiedades físicas del anhídrido acético
El anhídrido acético, con la fórmula química C4H6O3 y una masa molar de 102,09 g/mol, presenta ciertas propiedades físicas que son importantes. Es un líquido incoloro caracterizado por un olor acre y posee fuertes propiedades lacrimógenas. Los datos físicos clave asociados con el anhídrido acético se proporcionan a continuación.
| Propiedad | Valor |
|---|---|
| Fórmula molecular | (CH3CO)2O |
| Peso molecular | 102,09 g/mol |
| Apariencia | Líquido incoloro |
| Densidad | 1,08 g/cm3 |
| Punto de ebullición | 140,1 °C |
| Punto de fusión | -73,1 °C |
| Solubilidad en agua | Reacciona violentamente; miscible |
| Olor | Acre |
| Presión de vapor | 13 mmHg a 25 °C |
| Punto de inflamación | 49 °C (vaso cerrado) |
| Temperatura de autoignición | 485 °C |
| Índice de refracción | 1.392 |
| Viscosidad | 1,3 cP a 25 °C |
| Límites explosivos | 2,3 - 10,6% (volumen) |
A una temperatura de -73,1 °C, el anhídrido acético sufre una transición de fase sólida a líquida (punto de fusión). Por el contrario, hierve a 140 °C bajo una presión de 101,3 kPa (punto de ebullición).
El anhídrido acético demuestra miscibilidad con disolventes polares y muestra solubilidad en alcohol frío, aunque con una velocidad de descomposición lenta. Cuando se disuelve en agua a una temperatura de 20 °C, la solubilidad del anhídrido acético es de aproximadamente 2,6 % en peso, acompañado de un proceso de descomposición gradual.
Por el contrario, a una temperatura de 15 °C, la solubilidad del agua en anhídrido acético es de aproximadamente el 10,7 % en peso, también con una tendencia a la descomposición gradual.
2. Reacciones químicas del anhídrido acético
El anhídrido acético exhibe una amplia gama de reacciones químicas y ha sido ampliamente estudiado como anhídrido de ácido carboxílico alifático.
En los últimos 25 años, el anhídrido acético se ha utilizado en numerosas publicaciones y patentes, particularmente para la acetilación de grupos hidroxilo (OH) o amino (NH), sirviendo como paso principal en estas reacciones.
2.1. Acetilación
2.1.1. O-acetilación
El anhídrido acético es muy adecuado para reacciones de esterificación con alcoholes, que a menudo son difíciles o imposibles de lograr con ácido acético. Durante este proceso se libera ácido acético. Comúnmente se emplean catalizadores como bases, ácidos fuertes y sales como el acetato de sodio.
Ejemplos notables de la reacción del anhídrido acético con grupos hidroxilo incluyen la formación de acetilcelulosa, ácido acetilsalicílico (comúnmente conocido como aspirina) y triacetato de glicerol.
Cuando el anhídrido acético reacciona con el peróxido de hidrógeno, produce ácido peracético o peróxido de diacetilo, cuyo resultado depende de la relación molar de los reactivos:
(CH3CO)2O + 2 H2O2 → 2 CH3CO3H
(CH3CO)2O + H2O2 → CH3COOH + CH3CO3H
(CH3CO)2O + CH3CO3H → CH3COOOOCOCH3 + CH3COOH
2.1.2. N-acetilación
La acetilación de compuestos que contienen grupos NH produce acetamidas, siguiendo la ecuación general:
RR’NH + (CH3CO)2O → RR’NCOCH3 + CH3COOH
Aquí, R y R’ representan hidrógeno (H) o grupos alquilo. Las aminas alifáticas normalmente reaccionan sin necesidad de calentarse. La anilina, por ejemplo, produce acetanilida, que previene la oxidación durante la nitración posterior.
Las reacciones de N-acetilación generalmente ocurren más rápido que la acetilación de grupos OH, lo que permite la acetilación parcial de compuestos con múltiples grupos funcionales. Los ejemplos incluyen la producción de N-acetilaminoácidos como N-acetilmetionina-S-óxido (1) y ácidos N-acetil antranílicos (2).

Las amidas y carbamidas con grupos NH libres, tanto alifáticas como aromáticas, se pueden acetilar utilizando anhídrido acético.
El ácido sulfúrico se utiliza comúnmente como catalizador. Esta reacción encuentra aplicación en la síntesis de diversos productos como N,N,N’,N’-tetraacetiletilendiamina ((CH3CO)2NCH2CH2N(COCH3)2) y 2,4,6,8-tetraacetilazabiciclo[3.3.1]nonano-3, 7-diona.
![2,4,6,8-tetraacetylazabicyclo[3.3.1]nonane-3,7-dione.](https://chemcess.com/wp-content/uploads/2023/07/2468-tetraacetylazabicyclo3.3.1nonane-37-dione.jpg)
2.1.3. C-acetilación
Los compuestos con enlaces CH reactivos pueden sufrir acetilación con anhídrido acético, lo que a veces requiere un catalizador. Ejemplos notables incluyen la producción de α-cianoacetoacetato de etilo (CH3COCH(CN)COOC2H5) utilizando carbonato de potasio como catalizador y la reacción de Friedel-Crafts entre anhídrido acético e hidrocarburos aromáticos como el benceno, que da como resultado la formación de acetofenona.
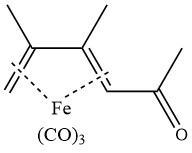
La acetilación de 2,3-dimetilbutadieno tricarbonil hierro en presencia de cloruro de aluminio produce el siguiente complejo:
La reacción de cetonas con anhídrido acético, catalizada por trifluoruro de boro, conduce a la formación de β-dicetonas.
El triacetilmetano se puede sintetizar directamente a partir de acetato de isopropenilo, anhídrido acético y un catalizador de cloruro de aluminio.
De manera similar, se pueden producir metilcetonas insaturadas mediante la acetilación de olefinas con anhídrido acético en presencia de cloruro de zinc como catalizador:
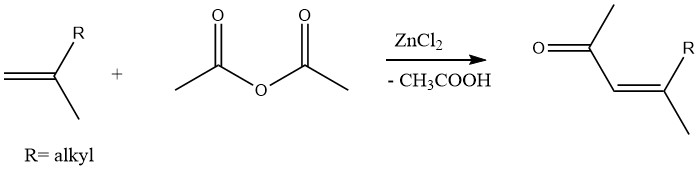
2.1.4. Acetilación de ácidos minerales
La reacción del anhídrido acético con ácido nítrico da como resultado la formación de nitrato de acetilo, frecuentemente empleado como agente nitrante en química orgánica. El nitrato de acetilo también se puede sintetizar utilizando pentóxido de dinitrógeno y anhídrido acético.
Otros ácidos fuertes como el ácido sulfúrico, los ácidos sulfónicos y el ácido clorhídrico pueden formar anhídridos mixtos con anhídrido acético. La reacción de anhídrido acético con ácido fosforoso produce ácido 1-hidroxietano-1,1-difosfónico.

2.1.5. Acetilación de óxidos
El trióxido de antimonio reacciona con anhídrido acético para producir triacetato de antimonio (Sb(OCOCH3)3). Una reacción similar con trióxido de cromo conduce a soluciones de acetato de cromilo, que a menudo se utilizan en la oxidación de olefinas e hidrocarburos, pero se debe tener precaución ya que ocasionalmente pueden ser explosivas.
2.1.6. Acetilación de sales
Varias sales reaccionan con los anhídridos de ácidos carboxílicos de manera similar a sus correspondientes ácidos libres:
Li−C−CR + (CH3CO)2O → CH3CO−C−CR + CH3COOLi
El peróxido de bario tratado con anhídrido acético produce peróxido de diacetilo:
BaO2 + (CH3CO)2O → (CH3CO)2O2 + BaO
Un método general para producir vinilcetonas implica la reacción de bromuros de vinilmagnesio con anhídrido acético.
2.1.7. Producción de acetoxi silanos
El anhídrido acético reacciona con los silanos según la ecuación:

donde X = H, Cl, O, NR2.
2.1.8. Adición a compuestos heterocíclicos con escisión de anillo
Estas reacciones son conceptualmente similares a las descritas anteriormente. Por ejemplo, el diacetato de etilenglicol se puede producir a partir de óxido de etileno en presencia de catalizadores fuertemente ácidos o básicos, y los diacetatos de oximetileno se pueden obtener a partir de trioxano.
2.1.9. Adición oxidativa de dobles enlaces carbono-carbono
Las reacciones de adición oxidativa dan como resultado la formación de los correspondientes diacetatos. Por ejemplo, la adición de etileno al anhídrido acético produce diacetato de etilenglicol. De manera similar, el butadieno se puede convertir en 1,4-diacetoxi-2-buteno mediante un proceso similar.
2.1.10. Producción de peróxidos de diacilo mixtos
Los peróxidos de diacilo se pueden sintetizar haciendo reaccionar oxígeno con mezclas de aldehídos alifáticos y anhídrido acético en presencia de acetato de sodio.
2.1.11. Reacción con N-óxidos
Las reacciones con N-óxidos producen varios productos según el tipo específico de N-óxido. El N-óxido de piridina, por ejemplo, produce 2-acetiloxipiridina, mientras que el N-óxido de 4-picolina forma una mezcla de 4-acetiloximetilenopiridina y 3-acetiloxi-4-metilpiridina. La reacción de Polonovski de N-óxidos da como resultado la formación de formaldehído, aldehídos insaturados y amidas ácidas.
2.1.12. Reacción con S-Óxidos
La reducción de sulfóxidos a sulfuros utilizando anhídrido acético se conoce como reacción de Pummerer. Por ejemplo, CH3SOR reacciona con (CH3CO)2O para producir CH3COOCH2SR y CH3COOH.
Esta reacción también se utiliza para oxidar alcoholes primarios y secundarios, incluso aquellos que están estéricamente impedidos, utilizando mezclas de dimetilsulfóxido o tetrametileno sulfóxido junto con anhídrido acético, dando como resultado la formación de los correspondientes compuestos carbonílicos.
2.1.13. Producción de acilos y acetatos de vinilo
Los aldehídos reaccionan con anhídrido acético en presencia de catalizadores ácidos para formar acilos. Si el aldehído posee un átomo de α-hidrógeno, la eliminación del ácido acético conduce a la formación del correspondiente acetato de vinilo. La adición de zinc facilita la escisión de la fracción de ácido acético. Este proceso es particularmente adecuado para la síntesis de acetato de 2,2-diclorovinilo.
2.1.14. Trifluoruro de boro
El anhídrido acético y los anhídridos acéticos sustituidos se pueden transformar en acetilcetonas utilizando un complejo de trifluoruro de boro que se descompone en agua tibia.
2.2. Deshidración
El anhídrido acético encuentra aplicación como agente deshidratante en diversas industrias, incluida la industria de explosivos. Un ejemplo notable de su propiedad deshidratante es la producción de hexógeno (1,3,5-trinitrohexahidro-1,3,5-triazina).

En la síntesis del nitroéster de 1,2,4,5-tetrahidroxi-3,6-dinitrociclohexano, se emplea anhídrido acético por su capacidad de unión de agua:

Además, el anhídrido acético se utiliza en la producción de cianuros de alquilo deshidratando aldoximas:
RCH=NOH + (CH3CO)2O → RCN + 2 CH3COOH
Además, el anhídrido acético sirve como agente deshidratante en numerosas reacciones de ciclación.
2.3. Reacciones de los protones α
La reacción de Perkin es un método ampliamente utilizado para la síntesis de ácidos α, β-insaturados a partir de aldehídos aromáticos, incluido el benzaldehído. Esta reacción suele tener lugar en presencia de acetato de potasio o acetato de sodio. También se utiliza para la producción de ácido cinamalacético.
Reacciones similares incluyen la carboximetilación oxidativa, donde se utilizan anhídrido acético y agentes oxidantes, y la conversión de alquenos de cadena larga en sus correspondientes derivados de ácido carboxílico.
2.4. Reacciones de un solo grupo carbonilo
En determinados casos es posible que sólo uno de los grupos carbonilo del anhídrido acético participe en una reacción. Por ejemplo, cuando el anhídrido acético reacciona con cianuro de hidrógeno en presencia de una base, forma el compuesto (3). De manera similar, en presencia de un reactivo de Grignard (RMgBr), el anhídrido acético produce el compuesto (4).

2.5. Producción de cetenuro de plata
Cuando el acetato de plata y el anhídrido acético reaccionan en presencia de piridina a temperatura ambiente, experimentan una reacción para formar un complejo de piridina de cetenuro de plata. Si se emplea un exceso de anhídrido acético, la mezcla resultante se puede someter a destilación fraccionada de piridina y ácido acético, lo que lleva al aislamiento de cetenuro de plata.
3. Producción de anhídrido acético
Históricamente, el método más antiguo de producir anhídrido acético implicaba la conversión de acetato de sodio con un exceso de un cloruro inorgánico, como cloruro de tionilo, cloruro de sulfurilo o cloruro de fosforilo.
En este proceso, la mitad del acetato de sodio se convierte en cloruro de acetilo, que luego reacciona con el acetato de sodio restante para formar anhídrido acético.
Otro avance fue la conversión de ácido acético con fosgeno en presencia de cloruro de aluminio, lo que permitió un funcionamiento continuo:
2 CH3COOH + COCl2 → (CH3CO)2O + 2 HCl + CO2
Otros dos métodos utilizados en el pasado incluyeron la escisión de diacetato de etilideno para formar acetaldehído y anhídrido acético en presencia de catalizadores ácidos como cloruro de zinc, así como la reacción de acetato de vinilo con ácido acético sobre catalizadores de paladio (II) para formar acetaldehído y anhídrido acético. Sin embargo, estos procesos ya no tienen importancia industrial.
Actualmente, la producción de anhídrido acético se lleva a cabo principalmente mediante el proceso de cetena o la oxidación de acetaldehído. En 1983 se introdujo otro método, conocido como carbonilación de acetato de metilo (proceso Halcon).
En Europa occidental, aproximadamente el 77% del anhídrido acético se produce mediante el proceso de cetena, mientras que el 23% se produce mediante la oxidación de acetaldehído.
En Estados Unidos, desde la introducción del proceso Halcon en la planta de Tennessee-Eastman, el 25% del anhídrido acético se produce mediante este método, mientras que el 75% se produce mediante el proceso de cetena.
3.1. Proceso de cetena
El proceso de cetena implica dos pasos: la escisión térmica del ácido acético para formar cetena y la posterior reacción de cetena con ácido acético para producir anhídrido acético. Las reacciones generales se pueden resumir de la siguiente manera:
1. Escisión térmica del ácido acético:
CH3COOH → CH2=C=O + H2O (ΔH = 147 kJ/mol)
2. Reacción de cetena con ácido acético:
CH2=C=O + CH3COOH → (CH3CO)2O (ΔH = -63 kJ/mol)
La escisión térmica del ácido acético para producir cetena y agua se lleva a cabo calentando vapor de ácido acético caliente a una temperatura de 700-750°C en presencia de trazas de catalizador de ácido fosfórico.
La presión del reactor normalmente se reduce para permitir el aislamiento de la cetena antes de que reaccione con ácido acético o agua. El proceso de escisión se lleva a cabo en un reactor multicoil con bobinas hechas de aleaciones de acero altamente resistentes al calor, como el Sicromal.
El proceso de cetena implica múltiples pasos y configuraciones de equipos, dependiendo de la capacidad de producción deseada.
En operaciones de pequeña escala, se utilizan hornos de precalentamiento y corte separados, mientras que los hornos de tamaño mediano a menudo se construyen como hornos de una sola cámara calentados con gas o aceite.
Los hornos de gran tamaño funcionan eficazmente con sistemas de tres o cuatro cámaras y flujos parciales de gas. También se pueden operar varios hornos con ácido acético suministrado desde un evaporador central.
Después de la escisión térmica del ácido acético, la cetena resultante se hace reaccionar con ácido acético para producir anhídrido acético. Comúnmente se utilizan dos procesos para esta reacción: el proceso de depuración y el proceso Wacker.
En el proceso de depuración, la cetena se absorbe haciendo circular ácido acético glacial en depuradores llenos de anillos de Raschig. La cetena se absorbe principalmente en el primer depurador y la mezcla líquida que contiene anhídrido bruto se recoge y se enfría.
En el proceso Wacker, la cetena se bombea a través de una bomba de anillo líquido, donde reacciona con ácido acético a temperatura y presión controladas. El anhídrido bruto se recoge continuamente y parte del mismo se devuelve a la bomba de reacción.
El anhídrido bruto obtenido de la reacción se purifica aún más mediante destilación. Se utilizan métodos de destilación tanto continuos como discontinuos.
En la destilación discontinua se obtienen tres fracciones: primera, media y anhídrido puro.
La destilación continua implica múltiples columnas para separar las diferentes fracciones. La pureza del anhídrido suele ser de alrededor del 99 % en la destilación discontinua, pero puede mejorarse operando a presión reducida.
El proceso Wacker también se utiliza para el proceso de procesamiento, lo que permite el procesamiento de ácidos residuales sin necesidad de materiales adicionales. El proceso tiene características de alta confiabilidad y ahorro de energía.
Para la producción de 100 kg de anhídrido acético se requieren aproximadamente 122 kg de ácido acético, considerando el ácido acético diluido reconcentrado. El rendimiento del proceso es superior al 96% con aproximadamente un 75% de escisión.
3.2. Oxidación del acetaldehído
El anhídrido acético también se puede obtener directamente mediante la oxidación del acetaldehído en fase líquida. Este proceso implica la reacción del ácido peracético, formado a partir de oxígeno y acetaldehído, con una segunda molécula de acetaldehído para producir anhídrido acético y agua.
En este proceso son cruciales una refrigeración eficiente y el uso de catalizadores adecuados. Los catalizadores comúnmente utilizados son combinaciones de sales metálicas, tales como acetato de manganeso y acetato de cobre, acetato de cobalto y acetato de níquel, o sales de cobalto y cobre de ácidos grasos superiores.
Para mantener la temperatura de reacción y evitar la rápida hidrólisis del anhídrido acético, el proceso normalmente se opera entre 40°C y 60°C.
Es necesario un enfriamiento eficaz debido a la naturaleza exotérmica de la reacción, y la adición de disolventes de bajo punto de ebullición como acetato de metilo y acetato de etilo, que forman mezclas azeotrópicas con agua, ayuda a la separación del agua de la mezcla de reacción.
La proporción de anhídrido acético a ácido acético en el producto final depende de la proporción inicial de acetato de etilo a acetaldehído.
En la práctica, una mezcla de acetaldehído y acetato de etilo se oxida con la adición de catalizadores de acetato de cobalto y acetato de cobre. Las condiciones de reacción optimizadas pueden conducir a una mayor proporción de anhídrido acético a ácido acético. Se pueden utilizar como diluyentes en el proceso varios disolventes, incluidos cloruro de metileno, éter diisopropílico, ciclohexanona y diacetato de etilideno.
La mezcla de gases que contiene oxígeno y acetaldehído se introduce en el reactor, donde se produce la oxidación en fase líquida en presencia de catalizadores. Luego, el efluente del reactor pasa a través de un condensador enfriado por agua, que también funciona como separador de gases no condensables.
Se introduce acetaldehído nuevo en una columna empaquetada, donde se combina con el gas de escape del condensador. Los condensados del condensador y la columna se destilan para obtener el producto deseado.
El acetaldehído se recupera de la corriente de gas no condensable. Los gases de escape pueden contener productos combustibles de bajo punto de ebullición y disolventes que pueden quemarse.
El proceso descrito anteriormente proporciona un ejemplo, y diferentes fabricantes pueden emplear variaciones de las configuraciones del reactor y de las condiciones de reacción específicas.
3.3. Carbonilación de acetato de metilo
El proceso convencional para la producción de anhídrido acético implica la descomposición térmica del ácido acético para formar cetena, lo que requiere una cantidad significativa de energía.
Sin embargo, se han desarrollado procesos alternativos, como el proceso de producción de ácido acético de Monsanto y la carbonilación del acetato de metilo.
La carbonilación de acetato de metilo para formar anhídrido acético fue patentada por Halcon en 1973, y la primera planta que utilizó este proceso entró en funcionamiento en 1983. En este proceso, el acetato de metilo se carbonila en fase líquida a temperaturas que oscilan entre 160 °C y 190 °C. C y una presión parcial de monóxido de carbono de 2-5 MPa.
Se pueden utilizar varios catalizadores para la reacción de carbonilación, incluidos compuestos de rodio y níquel activados por yoduros u otras sustancias que contienen yodo. Los catalizadores de rodio exhiben una mayor actividad que los catalizadores de níquel y ambos catalizadores muestran una selectividad superior al 95%.
La adición de un pequeño porcentaje de hidrógeno al monóxido de carbono utilizado en la síntesis mejora la actividad y la vida útil de los catalizadores. También se pueden emplear compuestos de cromo para acortar la fase de inducción de la reacción.
El proceso de carbonilación puede comenzar a partir de acetato de metilo o de éter dimetílico, convirtiéndose este último en acetato de metilo antes de su transformación en anhídrido acético.
El proceso Halcon, por ejemplo, implica alimentar continuamente acetato de metilo seco en un reactor revestido con Hastelloy, donde se carbonila a 175°C en presencia de una mezcla de catalizador.

a) Compresor; b) reactor de carbonilación; c) Evaporador; d) Adsorbedor; e) columna de destilación; f) Condensador; g) Depurador
El calor generado durante la reacción se elimina mediante intercambio de calor y se utiliza para precalentar acetato de metilo y generar vapor a baja presión. El monóxido de carbono que no ha reaccionado se recicla tras la eliminación de los gases condensables.
Se lava una corriente lateral con anhídrido acético puro para evitar la acumulación de gases inertes. El producto de reacción líquido que sale del reactor se somete a destilación instantánea para separar el líquido que contiene catalizador para su reciclaje.
El anhídrido bruto se purifica aún más mediante destilación en tres columnas consecutivas, y la columna final produce anhídrido acético con una pureza del 99 %.
Para reducir el contenido de yoduro en el anhídrido puro, se puede añadir una solución de acetato de potasio en anhídrido acético durante el proceso de destilación.
Estos procesos alternativos ofrecen ventajas sobre la ruta de descomposición térmica convencional en términos de consumo de energía y utilización de materia prima, permitiendo la producción de anhídrido acético a partir de fuentes distintas del petróleo, como el carbón.
4. Usos del anhídrido acético
El anhídrido acético se utiliza ampliamente como agente acetilante y deshidratante. Una aplicación destacada es la acetilación de celulosa a gran escala. Sin embargo, existen otras áreas en las que se emplea anhídrido acético:
- Producción de espuma dura de poli(metilacrilimida), donde actúa como agente aglutinante para el amoníaco liberado durante la conversión de grupos amida en grupos imida.
- Auxiliares plásticos acetilados, incluidos triacetato de glicerol, citrato de acetiltributilo y ricinolato de acetilo.
- Producción de explosivos, particularmente en la fabricación de hexógeno.
- Producción de determinados tipos de líquidos de frenos.
- Producción de auxiliares para fluidos de perforación.
- Industria de detergentes, concretamente en la producción de activadores de blanqueo en frío como la tetraacetiletilendiamina.
- Industria del teñido, donde se utiliza el anhídrido acético, en combinación con ácido nítrico, como agente nitrante, aprovechando sus propiedades disolventes y deshidratantes.
- Preparación de diversos intermedios orgánicos, como cloruro de cloroacetilo, peróxido de diacetilo, anhídridos carboxílicos superiores, acetatos y el complejo de trifluoruro de boro.
- Producción de productos farmacéuticos, incluidos ácido acetilsalicílico (aspirina), p-acetilaminofenol, acetanilida, acetofenacetina, teofilina, cloruro de acetilcolina, sulfonamidas, hormonas, vitaminas y el agente de contraste radiológico 2,4,6-triyodo-3,5. -ácido diacetilamidobenzoico.
- Aplicaciones en la industria alimentaria, principalmente en la acetilación de grasas animales y vegetales para lograr las solubilidades deseadas, la producción de acetoestearinas (materiales de embalaje comestibles) y la clarificación de aceites vegetales.
- Sabores y fragancias, cuando se utilice en la producción de ésteres y cumarina.
- Herbicidas como metolaclor (Dual) y alaclor (Lasso).
Referencia
- Acetic Anhydride and Mixed Fatty Acid Anhydrides; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_065
- https://lotus.naturalproducts.net/compound/lotus_id/LTS0216280
Preguntas frecuentes: anhídrido acético
El anhídrido acético es un compuesto orgánico con la fórmula química (CH3CO)2O. Es un líquido incoloro con un olor acre y se usa comúnmente como agente acetilante y deshidratante.
El anhídrido acético reacciona violentamente con agua, alcoholes y otras sustancias que contienen átomos de hidrógeno activos. Esta reacción puede ser exotérmica y provocar riesgos de incendio o explosión.
El anhídrido acético tiene diversas aplicaciones, entre ellas:
- Acetilación de celulosa en la producción de acetato de celulosa, material utilizado en fibras, películas y plásticos.
- Producción de productos farmacéuticos, como ácido acetilsalicílico (aspirina), paracetamol y determinadas hormonas.
- Fabricación de productos químicos, incluidos agentes acetilantes, anhídridos carboxílicos superiores y ciertos ésteres.
- Síntesis de sabores, fragancias y herbicidas.
- Uso como agente deshidratante en diversos procesos industriales.
Al trabajar con anhídrido acético, es importante seguir estas precauciones de seguridad:
– Utilice equipo de protección personal (EPP) adecuado, incluidos guantes, gafas y una bata de laboratorio, para protegerse contra el contacto con la piel y los ojos.
– Trabajar en un área bien ventilada o utilizar campanas extractoras para evitar la inhalación de vapores.
– Mantenga el anhídrido acético alejado de llamas abiertas, chispas o fuentes de ignición ya que es inflamable.
– Manipular con cuidado para evitar el contacto con agua u otras sustancias reactivas.
– Almacene el anhídrido acético en un área fresca, seca y bien ventilada, lejos de materiales incompatibles.
El anhídrido acético es un mejor agente acilante que el ácido acético porque dona fácilmente un grupo acetilo (CH3CO) a los reactivos. El anhídrido acético reacciona más eficientemente debido a la ausencia de agua, lo que puede dificultar la reacción de acilación. La ausencia de agua en el anhídrido acético permite mayores rendimientos y velocidades de reacción más rápidas en las reacciones de acilación.
La densidad del anhídrido acético es de aproximadamente 1,08 gramos por centímetro cúbico (g/cm³) a temperatura ambiente.
Cuando el ácido salicílico reacciona con anhídrido acético en presencia de un catalizador ácido, como el ácido sulfúrico, sufre una reacción de acetilación. El anhídrido acético dona un grupo acetilo al grupo hidroxilo del ácido salicílico, lo que da como resultado la formación de ácido acetilsalicílico, comúnmente conocido como aspirina.
El anhídrido acético en sí no es inherentemente explosivo. Sin embargo, puede formar mezclas explosivas con el aire cuando su concentración alcanza ciertos niveles. El anhídrido acético debe manipularse con precaución debido a su reactividad e inflamabilidad. Es importante almacenar y manipular el anhídrido acético siguiendo los protocolos de seguridad adecuados para minimizar el riesgo de accidentes.
