Acroleína: reacciones, producción y usos
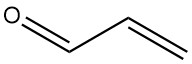
La acroleína, también conocida como propenal o acrilaldehído, es el aldehído insaturado más simple. Es un líquido volátil e incoloro con un fuerte olor que es a la vez tóxico y provoca lágrimas.
El descubrimiento de la acroleína, cuyo nombre deriva de las palabras latinas «acer» que significa acre y «oleum» que significa aceite, se puede atribuir a Redtenbacher en 1843. Se encontró en grasa sobrecalentada.
En 1942, Degussa estableció un método para producir comercialmente acroleína mediante la condensación en fase gaseosa catalizada heterogéneamente de acetaldehído y formaldehído. Actualmente, la acroleína se fabrica predominantemente a gran escala mediante oxidación de propeno en fase gaseosa catalizada de forma heterogénea.
Tabla de contenido
1. Propiedades físicas de la acroleína
La acroleína tiene una solubilidad limitada en agua, pero es soluble en varios disolventes orgánicos, incluidos alcoholes, éteres e hidrocarburos alifáticos o aromáticos. Las propiedades físicas esenciales de la acroleína se presentan a continuación:
| Propiedad | Valor |
|---|---|
| Masa molar | 56,06 g/mol |
| Punto de ebullición (pb) | 52-53°C |
| Punto de fusión (pf) | -87°C |
| Densidad relativa | 0,838 g/cm³ |
| Índice de refracción | 1.418 |
| Viscosidad | 0,40 cP a 25°C |
| Solubilidad en agua | 260 g/kg |
| Presión de vapor | 29 kPa a 20°C |
| Temperatura de autoignición en el aire | 234°C |
| Punto de inflamación | -26 °C |
2. Reacciones químicas de la acroleína
La acroleína exhibe una alta reactividad debido a sus grupos vinilo y aldehído conjugados, lo que la hace sufrir reacciones características tanto de compuestos insaturados como de aldehídos.
La conjugación entre el doble enlace carbono-carbono y el grupo carbonilo potencia la reactividad de ambos grupos, permitiéndoles reaccionar juntos o por separado.
Vale la pena señalar que la acroleína puede sufrir una polimerización espontánea y altamente exotérmica.
2.1. Reacción de Diels-Alder
La acroleína actúa como dieno y dienófilo, permitiendo la formación de un dímero cíclico llamado 3,4-dihidro-2H-piran-2-carboxaldehído. Este dímero se produce mediante la reacción térmica no catalizada de acroleína a aproximadamente 190 °C (1 hora para una conversión de acroleína del 75 %), junto con la formación de productos secundarios poliméricos.
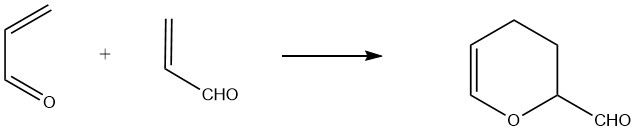
Para lograr altos rendimientos, es necesaria la estabilización con hidroquinona o compuestos complejantes como ácidos orgánicos polivalentes.
El «dímero térmico» resultante es un líquido transparente con un olor desagradable, que hierve a 151,3°C a 101,3 kPa y tiene una densidad relativa de 1,0775. La hidrólisis ácida del dímero produce 2-hidroxiadipaldehído, que puede hidrogenarse aún más para formar 1,2,6-hexanotriol.
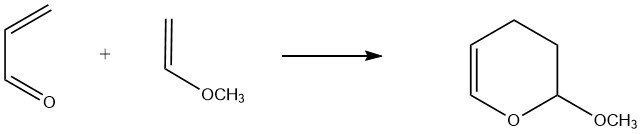
La acroleína actúa como un 1,3-dieno en reacciones con dienófilos donde la densidad electrónica del doble enlace carbono-carbono aumenta mediante sustituyentes liberadores de electrones. Por ejemplo, la acroleína reacciona fácilmente con éteres vinílicos y vinilaminas para formar dihidropiranos.
Un ejemplo comercial importante es la reacción entre metil vinil éter y acroleína, que conduce a la formación de 3,4-dihidro-2-metoxi-2H-pirano. Los rendimientos informados para esta reacción a temperaturas de 160-190°C oscilan entre 80% y 90%.
2.2. Adición al doble enlace carbono-carbono
El átomo de carbono β de la acroleína, polarizado por el grupo carbonilo, actúa como electrófilo. En consecuencia, reactivos nucleofílicos como alcoholes, tioles, agua, aminas, compuestos de metileno activos y ácidos orgánicos e inorgánicos pueden agregarse al doble enlace carbono-carbono en presencia de catalizadores ácidos o básicos.
Unas condiciones cuidadosamente controladas son esenciales para minimizar las reacciones secundarias indeseables. La adición de agua en condiciones ácidas suaves conduce a la formación de 3-hidroxipropionaldehído (HPA) con alta selectividad.
Como catalizadores se utilizan a menudo soluciones tampón con un pH de 4-5 o resinas de intercambio iónico de ácido débil. Una hidrogenación adicional de las soluciones acuosas da como resultado 1,3-propanodiol.
Los catalizadores de metales preciosos facilitan la oxidación directa de soluciones acuosas de HPA a pH 3, produciendo ácido 3-hidroxipropiónico. Por encima de pH 7, el anión malonato se forma con alto rendimiento.
La acroleína reacciona rápidamente con cloruro de hidrógeno o bromuro de hidrógeno para producir 3-cloropropionaldehído o 3-bromopropionaldehído. Sin embargo, estos productos se polimerizan fácilmente en trímeros y tetrámeros en presencia de ácidos.
Para obtener acetales de 3-halopropionaldehído, se prefiere un proceso simultáneo de adición de haluro de hidrógeno y acetalización, lo que da como resultado rendimientos de acetal de aproximadamente el 90%.
El cloro y el bromo se pueden agregar a la acroleína en una solución acuosa diluida, formando 2,3-dihalopropionaldehídos con rendimientos de alrededor del 85%. Estos dihalopropionaldehídos pueden deshidrohalogenarse para producir 2-haloacroleínas. Se sabe que las 2-haloacroleínas son mutágenos potentes y pueden halogenarse aún más para producir 2,2,3-trihalopropionaldehídos, que son valiosos intermediarios en la síntesis de ácido fólico.
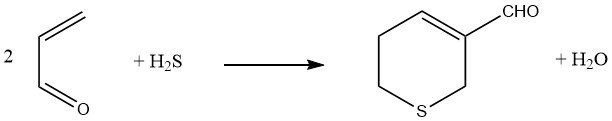
El sulfuro de hidrógeno, cuando se añade a dos equivalentes de acroleína seguido de una reacción aldólica, da como resultado la formación de 3-formil-5,6-dihidrotiopirano.
El metanotiol sufre una adición catalizada por bases a la acroleína, lo que lleva a la formación de 3-(metiltio)propionaldehído, que es una reacción importante utilizada en la síntesis del aminoácido esencial D,L-metionina.
2.3. Reacciones del grupo aldehído
La selectividad de la acetalización catalizada por ácido depende de la naturaleza del alcohol utilizado y de los catalizadores empleados. Las reacciones secundarias pueden producir los correspondientes 3-alcoxipropionaldehídos y 3-alcoxipropionaldehído-acetales.
Los acetales cíclicos, particularmente los formados con dioles ramificados como el 2-metil-1,3-propanodiol, son más fáciles de obtener en comparación con los acetales acíclicos de alcoholes inferiores. Para la preparación de acetales cíclicos se conocen diversos procesos continuos, con rendimientos de más del 90% mediante procesos especiales en combinación con extracción.
Los acetales de acroleína sirven como intermediarios valiosos y han ganado interés como formas más seguras para el transporte de acroleína, especialmente 2-vinil-1,3-dioxolano. Estos acetales se pueden volver a dividir fácilmente en acroleína en soluciones acuosas ácidas, que encuentran utilidad en el uso de acroleína como herbicida acuático y como eliminador de sulfuro de hidrógeno en aguas de campos petrolíferos.
El espirodiacetal, dialilidenpentaeritritol, preparado condensando pentaeritritol con dos moles de acroleína, se puede polimerizar con vinilo u otros monómeros para formar resinas de espirano.
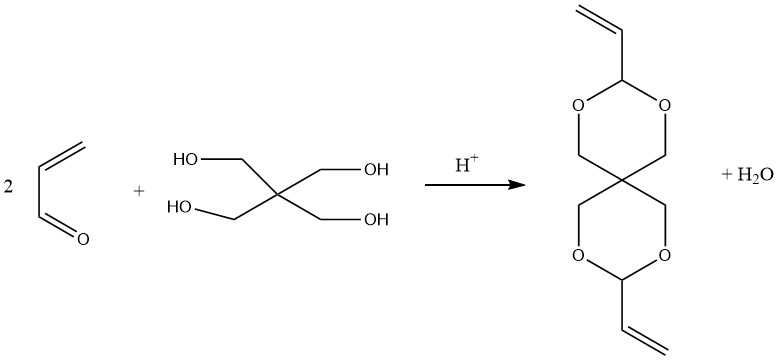
La hidroformilación de acetales de acroleína, particularmente acetales cíclicos, conduce a los monoacetales de 1,4-butanedial. La hidrólisis e hidrogenación posteriores de este producto de hidroformilación dan como resultado la producción de 1,4-butanodiol.
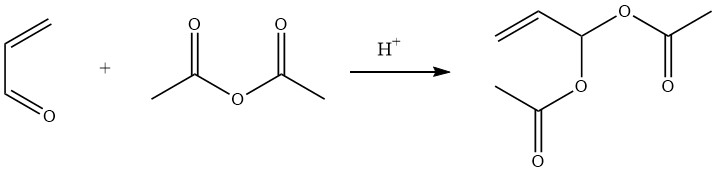
El diacetato de acroleína, también conocido como diacetato de 2-propeno-1,1-diol, se prepara fácilmente con un rendimiento del 90% mediante la reacción catalizada por ácido de anhídrido acético con acroleína.
Cuando se añade cianuro de hidrógeno a la acroleína en presencia de catalizadores alcalinos suaves, se forma acroleína cianhidrina con rendimientos superiores al 90%. El acetato de acroleína cianhidrina, obtenido mediante reacción con anhídrido acético, sirve como un valioso intermediario en la síntesis de sustancias farmacéutica y biológicamente activas.
2.4. Reacción simultánea de los grupos aldehído y vinilo
Aunque la acroleína y la metacroleína se reconocen como intermediarios en la síntesis Skraup de quinolinas a partir de aminas aromáticas y glicerol, su utilización comercial como materiales de partida para esta reacción sigue siendo limitada.
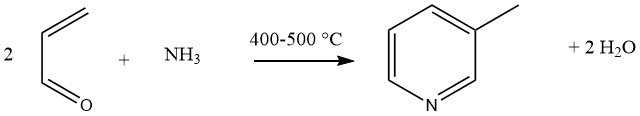
La condensación en fase gaseosa de acroleína y amoníaco, catalizada por catalizadores multicomponente Al2O3 o SiO2-Al2O3, produce un 45% de 3-metilpiridina y un 20-25% de piridina como subproducto. Esta reacción se ha generalizado como una síntesis universal de piridinas sustituidas.
La acroleína reacciona con el ácido isocianúrico para formar un aducto útil como agente reticulante. La reactividad bifuncional de la acroleína se ha explotado en diversas síntesis de heterociclos, como las reacciones con fenoles para producir cromenos o cromanos sustituidos, y la reacción con 2-aminofenoles para producir 8-quinolinoles.
Cuando la acroleína se hace reaccionar con un exceso de fenol en condiciones ácidas, se obtiene una mezcla de polifenoles, con 1,1,3-tris(4-hidroxifenil)propano como producto primario.
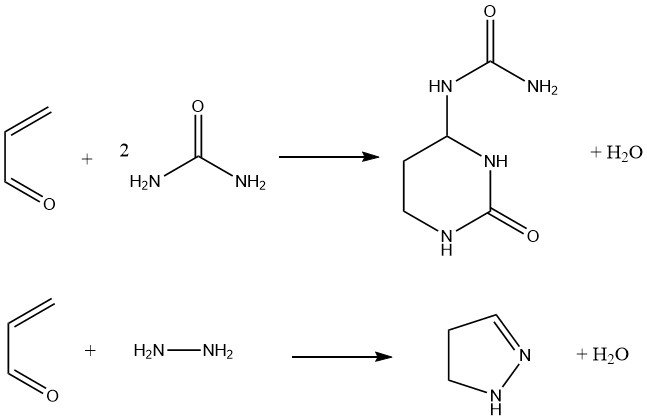
Además, la acroleína reacciona con la urea para producir hexahidro-2-oxo-4-pirimidinilurea, que se ha propuesto como fertilizante. La condensación de acroleína con hidrazina e hidrazinas sustituidas da pirazolinas con un rendimiento del 80%.
La acroleína puede hacerse reaccionar con formaldehído en condiciones alcalinas para producir pentaeritritol. Sin embargo, los rendimientos son menores en comparación con la síntesis comercial de pentaeritritol mediante acetaldehído y formaldehído.
El bisulfito de sodio reacciona con la acroleína para formar un aducto estable llamado sal disódica del ácido 1-hidroxipropano-1,3-disulfónico. Esta reacción encuentra una aplicación conveniente para la desodorización de acroleína derramada.
2.5. Reducción
La reducción selectiva de acroleína a alcohol alílico con altos rendimientos (90 %) se puede lograr mediante la transferencia de hidrógeno desde alcoholes secundarios, como el 2-propanol, en una reacción de Meerwein-Ponndorf en fase líquida.
En la fase gaseosa, la transferencia de hidrógeno desde etanol o 2-propanol sobre catalizadores de óxido de magnesio o catalizadores de óxido de tierras raras a temperaturas que oscilan entre 300 y 500 °C también conduce a la producción de alcohol alílico.
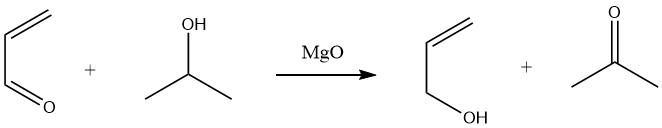
Sin embargo, la hidrogenación catalítica de acroleína es menos selectiva o sólo selectiva en conversiones muy bajas.
2.6. Oxidación
Al hacer reaccionar acroleína con peróxido de hidrógeno acuoso a pH 8-8,5, se puede obtener glicidaldehído con rendimientos del 80-90%:
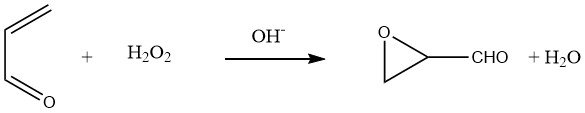
La hidratación del grupo oxirano en glicidaldehído conduce a una solución acuosa de D,L-gliceraldehído.
El ácido acrílico se produce comercialmente mediante la oxidación de acroleína con oxígeno molecular.
2.7. Polimerización
La acroleína se polimeriza fácilmente cuando se calienta, se expone a la luz o en presencia de varios iniciadores. Las propiedades del polímero de acroleína resultante dependen de las condiciones de polimerización, como el tipo de iniciador, el disolvente y la temperatura de reacción.
Los grupos funcionales de la acroleína (vinilo y aldehído) pueden polimerizarse por separado o juntos. La polimerización iniciada por radicales ocurre exclusivamente en el grupo vinilo, lo que da como resultado polímeros con grupos aldehído que forman fácilmente estructuras de tetrahidropirano. La polimerización iónica produce principalmente polímeros con grupos vinilo, junto con polímeros que contienen grupos aldehído y vinilo.
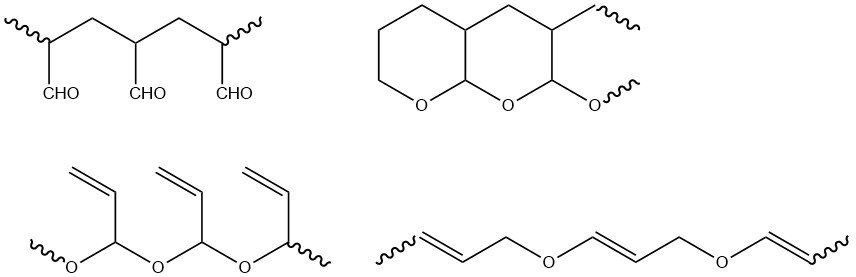
Los polímeros radicales son infusibles e insolubles en disolventes comunes, mientras que los productos de iniciación aniónica son solubles en muchos disolventes orgánicos. Además de los homopolímeros, se han sintetizado copolímeros con diversos comonómeros vinílicos y acrílicos.
Los grupos carbonilo de la poliacroleína se pueden modificar químicamente en condiciones suaves. Muchos derivados de poliacroleína son solubles en disolventes orgánicos o incluso en agua. Estos polímeros han despertado interés debido a su actividad biocida, ya que liberan lentamente acroleína.
El método fotoquímico (láser) se ha utilizado para sintetizar partículas ultrafinas a partir de mezclas gaseosas de acroleína y ciertos compuestos organosilícicos. Se están explorando las partículas de poliacroleína por sus posibles aplicaciones en nanotecnología.
3. Producción de acroleína
3.1. Acroleína por oxidación de propeno
El primer proceso comercial para la producción de acroleína fue desarrollado por Degussa en 1942. Implicaba la condensación en fase de vapor de acetaldehído y formaldehído, catalizada por silicato de sodio sobre soportes de sílice a temperaturas de 300-320°C.
Este método se utilizó hasta 1959, cuando Shell introdujo un nuevo proceso basado en la oxidación en fase de vapor de propeno sobre un catalizador de óxido cuproso. Sin embargo, el rendimiento del catalizador en este proceso fue pobre.
En 1957, Standard Oil de Ohio (Sohio) descubrió el sistema catalizador de molibdato de bismuto, que mostraba una selectividad mejorada pero aún tenía una baja conversión de propeno.
La oxidación de propeno a acroleína cobró impulso con el descubrimiento del sistema bismuto molibdato-fosfomolibdato de bismuto (Bi9PMo12O52 sobre un soporte de SiO2) por Sohio. Los catalizadores comerciales también incluyen óxidos de bismuto-molibdeno.
La catálisis de la oxidación de propeno a acroleína implica dos ciclos de reacción: un ciclo de reducción del catalizador (formación selectiva de productos) y un ciclo de reoxidación del catalizador (regeneración de red-oxígeno). Los sitios activos de los catalizadores son interfaces entre Fe2(MoO4)3 y β-CoMoO4, siendo el molibdato de bismuto el responsable de la selectividad.
Los catalizadores modernos para la producción de acroleína son sistemas de óxidos metálicos multicomponentes.
La optimización de estos sistemas catalíticos es un desafío continuo, y varias empresas químicas trabajan continuamente para mejorar las composiciones de los catalizadores y las técnicas de preparación. Se añaden óxidos metálicos adicionales como Co, Ni, P, Sb, W o K para equilibrar las propiedades redox del catalizador y mejorar su rendimiento.
En los procesos de producción actuales, el propeno se mezcla con aire y vapor y se alimenta a un reactor multitubular de lecho fijo que funciona a temperaturas de 300-400°C. Luego se enfría el efluente del reactor y el gas se lava con agua o mezclas de agua/disolvente para eliminar los subproductos.
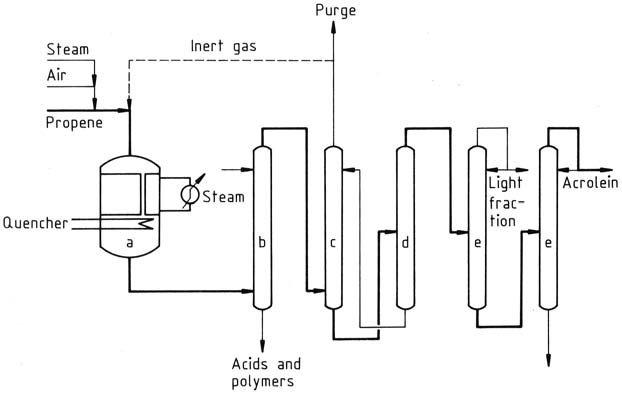
a) Reactor de oxidación; b) Depurador; c) Absorbedor; d) Desorbedor; e) Fraccionadores
La acroleína se obtiene absorbiendo el gas en agua fría en un absorbente. La solución acuosa de acroleína se procesa adicionalmente en una columna de desorción para obtener acroleína cruda, que luego se destila para purificar el producto.
Los nuevos avances en la producción de acroleína se centran en mejorar la selectividad y el rendimiento del catalizador y al mismo tiempo reducir el consumo de energía y las emisiones de CO2.
Se están explorando rutas alternativas para obtener acroleína a partir del propano y se está investigando la combinación de deshidrogenación del propano y oxidación selectiva del propeno a acroleína.
El proceso de metanol a propeno (MTP), que utiliza metanol como materia prima para la producción de propeno, también está ganando importancia en la industria química.
4. Usos de la acroleína
La acroleína tiene una amplia gama de usos como producto químico intermedio en diversas industrias. Algunos de los principales usos de la acroleína incluyen:
1. Biocida: La acroleína se utiliza como biocida de amplio espectro muy eficaz en concentraciones bajas, alrededor de 10 ppm. Se utiliza para controlar el crecimiento de malezas acuáticas, algas, moluscos y como desinfectante en sistemas de agua. También se utiliza en aguas de campos petrolíferos para eliminar el maloliente sulfuro de hidrógeno.
2. Producción de metionina: La acroleína se utiliza principalmente en la producción de metionina, que es un aminoácido esencial y un suplemento alimentario para animales. La acroleína también se utiliza para producir un análogo hidroxi de metionina, que es un complemento alimenticio con una bioeficacia ligeramente menor que la metionina.
3. Ácido acrílico: la acroleína es un precursor para la producción de ácido acrílico, que es una sustancia química importante que se utiliza para fabricar acrilatos. El ácido acrílico se usa ampliamente en la fabricación de recubrimientos, adhesivos, textiles y diversos polímeros.
4. 1,3-propanodiol: la acroleína se puede utilizar para producir 1,3-propanodiol mediante un proceso de hidrólisis e hidrogenación. El 1,3-propanodiol encuentra aplicaciones en la producción de materiales compuestos, adhesivos, disolventes y anticongelantes.
5. Glutaraldehído: la acroleína se utiliza en la producción de glutaraldehído, que es un dialdehído versátil. El glutaraldehído se utiliza en el curtido de cuero, tratamiento de agua, aplicaciones en campos petroleros y como desinfectante y esterilizador de equipos médicos.
6. Piridinas: la acroleína se puede utilizar para sintetizar varios derivados de piridina, incluida la 3-metilpiridina y otras piridinas sustituidas, que tienen aplicaciones en las industrias farmacéutica, de pesticidas y de fragancias.
7. Tetrahidrobenzaldehído: la acroleína se puede utilizar en la producción de tetrahidrobenzaldehído, que se utiliza en la síntesis de productos farmacéuticos, fungicidas y fragancias.
8. Sabores y fragancias: La acroleína y sus derivados se utilizan en la producción de una amplia gama de sabores y fragancias, incluidos compuestos como lyral, myrac aldehído y 5-norborneno-2-carbaldehído.
9. Herbicidas: El acetato de acroleína cianhidrina se utiliza como intermediario en la producción de fosfinotricina, un herbicida no selectivo utilizado en la protección de cultivos.
10. Otras aplicaciones: La acroleína se ha utilizado en el pasado para la producción de alcohol alílico y glicerol, pero estos procesos se han descontinuado. También se puede utilizar para producir D,L-gliceraldehído, que tiene aplicaciones en el curtido del cuero y diversas síntesis. Los polímeros de acroleína, como el ácido poli(aldehído carboxílico), tienen aplicaciones industriales como agentes secuestrantes, tratamientos textiles, refuerzo de papel y biocidas.
Estos son sólo algunos de los principales usos de la acroleína, y su versatilidad como intermediario químico permite aplicaciones potenciales en diversas industrias.
Referencia
- Acrolein and Methacrolein; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_149.pub2
Preguntas frecuentes: acroleína
La acroleína es un compuesto orgánico volátil (COV) que es un líquido incoloro con un olor acre. Es un aldehído insaturado con la fórmula química C3H4O.
La acroleína tiene diversas aplicaciones industriales. Se utiliza principalmente como intermediario químico para la producción de metionina, ácido acrílico, 1,3-propanodiol, glutaraldehído, piridinas, sabores y fragancias. También se utiliza como biocida en el tratamiento de agua, aplicaciones en campos petroleros y como desinfectante para equipos médicos.
La acroleína se puede formar mediante la condensación en fase de vapor de acetaldehído y formaldehído, catalizada por silicato de sodio sobre soportes de sílice. También se puede producir mediante la oxidación en fase de vapor de propeno sobre un catalizador de óxido cuproso.
Sí, la acroleína es tóxica. Se considera un compuesto altamente irritante y corrosivo. La inhalación o exposición a la acroleína puede causar irritación respiratoria, irritación de los ojos, quemaduras en la piel y otros efectos sobre la salud. Es importante manipular la acroleína con las precauciones de seguridad adecuadas y en áreas bien ventiladas.
Cuando se trabaja con acroleína, es fundamental utilizar equipo de protección personal (EPI) adecuado. Por lo general, esto incluye guantes, gafas protectoras o protectores faciales resistentes a químicos, una bata de laboratorio o ropa resistente a químicos y zapatos cerrados. Es posible que se requiera un respirador dependiendo de la concentración y la duración de la exposición.
La acroleína se puede encontrar en diversas fuentes, tanto naturales como antropogénicas. Puede formarse durante la combustión de materia orgánica, como el humo del tabaco, los gases de escape de los vehículos y las emisiones industriales. También lo producen determinadas plantas como mecanismo de defensa. Además, la acroleína puede estar presente en algunos alimentos, particularmente durante el calentamiento o fritura de grasas y aceites.
