Ácido ftálico: Propiedades, Producción y Usos
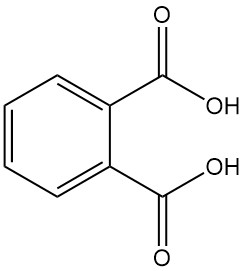
El ácido ftálico, también conocido como ácido o-ftálico o ácido 1,2-bencenodicarboxílico, es un ácido dicarboxílico aromático con la fórmula química C8H6O4. Es un sólido cristalino de color blanco que no tiene importancia industrial. Se forma como subproducto en la fabricación de anhídrido ftálico.
El ácido ftálico se encuentra naturalmente en algunas plantas, como Papaver somniferum, Cocos nucifera y otros organismos y animales. Fue descubierto por primera vez en 1836 por el químico francés A. Laurent como producto de la oxidación de la naftaleno.
Tabla de contenido
1. Propiedades físicas del ácido ftálico
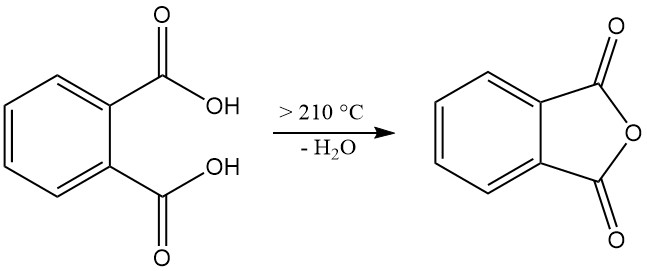
El ácido ftálico [88-99-3] es un ácido diprótico débil con constantes de disociación pKa1 = 2,89 y pKa2 = 5,51. Forma cristales monoclínicos incoloros con un punto de fusión de 191 °C en un tubo sellado que se convierten en anhídrido ftálico con eliminación de agua a temperaturas superiores a 210 °C.
El ácido ftálico es soluble en agua hirviendo (100 °C), 18 g/100 ml, y es mucho menos soluble en agua fría (14 °C), 0,54 g/100 ml. Es soluble en etanol (10 g/100 ml) y metanol (19,5 g/100 ml) e insoluble en cloroformo y éter.
Algunas de las propiedades físicas importantes del ácido ftálico se enumeran en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Fórmula | C8H6O4 |
| Peso molecular | 166,14 g/mol |
| Punto de fusión | 191 °C (en tubo sellado) Descomposición a 210 °C |
| Densidad a 15 °C | 1,593 g/cm3 |
| Densidad de vapor | 5.7 |
| Calor de fusión | 315,3 J/g |
| Calor específico del sólido (0–99 °C) | 1,214 J g-1 K-1 |
| Calor de combustión | 19657,03 J/g |
| Calor de formación | 43714,34 J/g |
| Calor de la solución a 25 °C | 123,55 J/g |
| Punto de inflamación | 168 °C |
2. Reacciones del ácido ftálico
El ácido ftálico sufre reacciones químicas típicas de los ácidos carboxílicos y los compuestos aromáticos.
El ácido ftálico es un ácido diprótico débil que reacciona con bases como NaOH o KOH y óxidos metálicos para formar sales llamadas ftalatos. Estas sales pueden ser solubles en agua (sales formadas con metales alcalinos (por ejemplo, sodio, potasio)) o insolubles, como los ftalatos de calcio y magnesio.
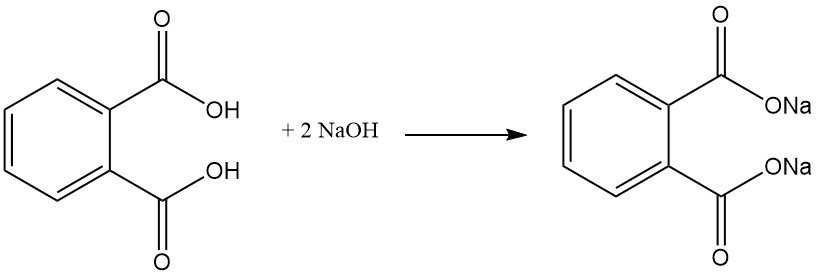
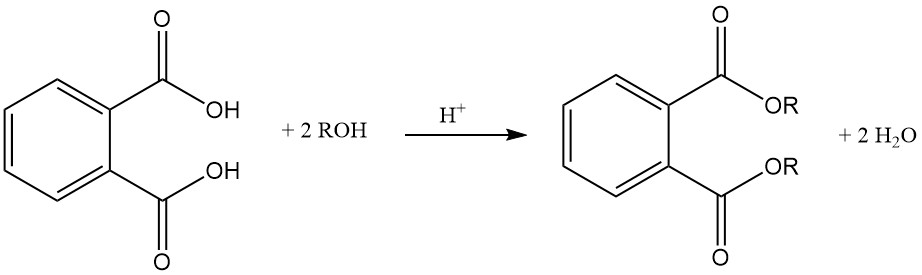
El ácido ftálico reacciona con alcoholes en presencia de un catalizador ácido (ácido sulfúrico) para formar diésteres de ftalato. Estos ésteres son productos químicos industriales útiles con diversas aplicaciones.
Cuando se calienta a 210 °C o más, el ácido ftálico se deshidrata para producir anhídrido ftálico.
El ácido ftálico puede sufrir reacciones de sustitución aromática; sin embargo, la presencia de los dos grupos de ácido carboxílico lo desactiva. En condiciones específicas y duras, podría ser posible una mayor funcionalización del anillo aromático.
3. Producción de ácido ftálico
El ácido ftálico se forma como subproducto en la fabricación de anhídrido ftálico mediante hidrólisis. El ácido ftálico no es importante en la industria. En cambio, el anhídrido ftálico se produce industrialmente y luego se convierte en ácido ftálico si es necesario.
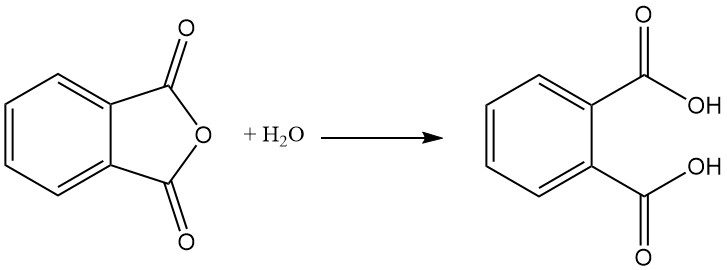
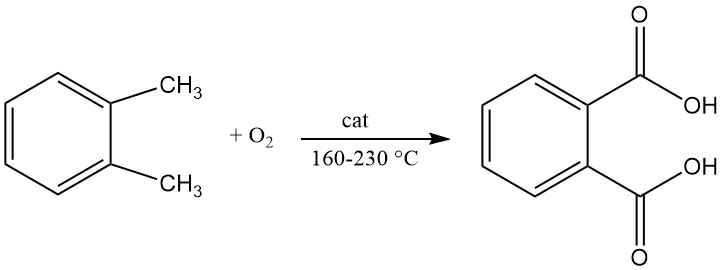
El anhídrido ftálico se prepara mediante oxidación catalítica de naftaleno u ortoxileno (o-xileno) a altas temperaturas y, a menudo, utiliza una configuración de reactor tubular de lecho fijo.
Una patente de 1979 describía la producción de ácido ftálico mediante oxidación líquida continua de o-xileno con aire en un reactor agitado. La reacción se lleva a cabo a una temperatura entre 160 °C y 200 °C y una presión entre 21 y 29 kg/cm2.
El catalizador utilizado en este proceso contenía una mezcla de cobalto, manganeso y bromo y el contenido de agua en el medio de reacción está entre 0,2% y 7%.
El aire se utiliza como oxidante y la mezcla líquida resultante contiene entre un 8% y un 40% de ácido ftálico y entre un 6% y un 30% de o-xileno. Esta mezcla líquida se alimenta continuamente, junto con aire adicional, a un segundo reactor agitado.
La temperatura en este segundo reactor se mantiene entre 210 °C y 230 °C. Es importante tener en cuenta que aquí se agrega catalizador nuevo, que contiene al menos 1 átomo de miligramo de cobalto por mol de xileno procesado (en comparación con la primera etapa).
Esta reacción de dos etapas produce un efluente líquido rico en ácido ftálico (85% a 92%). Sin embargo, también contiene agua, impurezas como el ácido benzoico y compuestos de mayor punto de ebullición.
4. Usos del ácido ftálico
El ácido ftálico se utiliza como reactivo analítico y de laboratorio y para fabricar medicamentos, colorantes, ftalimida, ácido antranílico, ésteres de ácido ftálico y perfumes sintéticos.
El ácido ftálico se puede utilizar como precursor del anhídrido ftálico, que es más valioso y se utiliza en diversas industrias como pinturas, plásticos, textiles y productos farmacéuticos.
5. Toxicología y peligros del ácido ftálico
El ácido ftálico es un intermedio que se produce y se utiliza en la industria en condiciones bien controladas. Puede ocurrir exposición ocupacional, pero se espera que sea baja. La exposición del público en general al ácido ftálico es baja e insignificante.
A pesar del número limitado de estudios toxicológicos disponibles, los datos existentes sugieren una baja toxicidad del ácido ftálico. Los estudios de toxicidad aguda en ratones (inyección intraperitoneal) indican una dosis letal media (LD50) de 550 mg/kg.
Después de la exposición, la mayor parte del ácido ftálico se excreta en la orina, ya sea directamente (como en los perros) o parcialmente conjugado (como en las ratas y los conejos). Una pequeña porción puede sufrir descarboxilación y eliminarse como ácido benzoico.
Referencias
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://patents.google.com/patent/US4215053A/en
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalic-acid
