Ácido Dicloroacético: producción y aplicaciones

El ácido dicloroacético es un líquido incoloro y altamente corrosivo, emite vapores ácidos que pueden provocar irritación en las mucosas. Muestra completa miscibilidad con agua y puede disolverse fácilmente en diversos disolventes orgánicos como alcoholes, cetonas, hidrocarburos e hidrocarburos clorados.
Tabla de contenido
1. Propiedades físicas del ácido dicloroacético
Las propiedades físicas del ácido dicloroacético, también conocido como ácido 2,2-dicloroetanoico, incluyen:
- Masa molar: 128,95 g/mol
- Punto de ebullición: 192 °C (101,3 kPa)
- Punto de congelación: 13,5 °C
- Densidad: 1.564
- Presión de vapor: 0,19 kPa (a 20 °C)
- Constante de disociación: 5×10-2 mol/L (a 18 °C)
2. Reacciones químicas del ácido dicloroacético
El ácido dicloroacético posee dos átomos de cloro que son susceptibles a reacciones de desplazamiento.
Cuando reacciona con compuestos aromáticos, forma ácidos diarilacéticos, mientras que en presencia de fenol, se producen ácidos difenoxiacéticos.
En comparación con el ácido cloroacético, el ácido dicloroacético muestra una menor susceptibilidad a la hidrólisis. Sin embargo, la presencia de impurezas de ácido dicloroacético en el ácido cloroacético puede provocar reticulación durante la producción de carboximetilcelulosa (CMC) y almidones. El efecto de reticulación resultante puede ser deseable o indeseable, dependiendo de la aplicación prevista del producto final.
3. Métodos de producción de ácido dicloroacético
El enfoque más económicamente viable para producir ácido dicloroacético implica la hidrólisis del cloruro de dicloroacetilo.

Además, se puede lograr un rendimiento del 90% de ácido dicloroacético puro al 98% mediante la hidrólisis de pentacloroetano utilizando ácido sulfúrico al 88-99% o oxidando 1,1-dicloroacetona con ácido nítrico y aire.
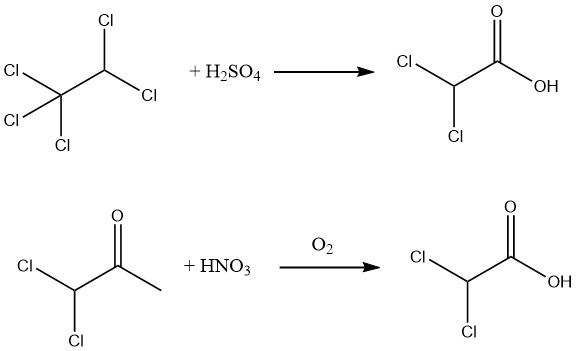
La hidrólisis del éster metílico, fácilmente obtenible mediante la esterificación del ácido dicloroacético bruto, permite la producción de ácido dicloroacético excepcionalmente puro.

La decloración catalítica de ácido tricloroacético o tricloroacetato de etilo con hidrógeno sobre un catalizador de paladio proporciona un método para obtener ácido dicloroacético y dicloroacetato de etilo.

La separación del ácido dicloroacético puro de otros ácidos cloroacéticos resulta desafiante mediante medios físicos como la destilación fraccionada, principalmente debido a las ligeras diferencias en los puntos de ebullición, especialmente entre el ácido dicloroacético y el ácido tricloroacético.
Sin embargo, las columnas de destilación eficaces pueden fraccionar satisfactoriamente mezclas de ésteres. Además, las mezclas de las sales derivadas de los tres ácidos cloroacéticos se pueden lavar con agua, alcohol o soluciones agua-alcohol para disolver preferentemente el dicloroacetato, que luego se puede acidificar para obtener ácido dicloroacético puro.
En entornos de laboratorio, el ácido dicloroacético se puede sintetizar haciendo reaccionar hidrato de cloral con cianuro de potasio o sodio:
Cl3CCH(OH)2 + KCN → HCN + KCl + Cl2CHCOOH
4. Usos del ácido dicloroacético
El ácido dicloroacético resulta útil como reactivo de prueba en mediciones analíticas durante la fabricación de fibras, específicamente para la producción de poli(tereftalato de etileno). También sirve como desinfectante medicinal, actuando como sustituto de la formalina.
Además, el ácido dicloroacético desempeña un papel vital como agente desbloqueador en la síntesis de oligonucleótidos en fase sólida. Para cumplir esta función, se requiere un ácido dicloroacético de alta pureza, sustancialmente desprovisto de cloral (tricloroacetaldehído).
En la síntesis orgánica, el ácido dicloroacético, especialmente en forma de sus ésteres, sirve como material de partida reactivo. Se utiliza en la producción de ácido glioxílico, dialcoxi y diaroxiácidos, así como sulfonamidas, por lo que sirve como un compuesto intermedio crucial.
Referencia
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
