Cos’è l’acido dicloroacetico?
L’acido dicloroacetico è un derivato dell’acido acetico con formula chimica CHCl2COOH. È un liquido altamente corrosivo che emette vapori acidi, che possono causare irritazione alle mucose.
L’acido dicloroacetico è completamente miscibile con acqua e può dissolversi facilmente in vari solventi organici come alcoli, chetoni, idrocarburi e idrocarburi clorurati.
Sommario
1. Proprietà fisiche dell’acido dicloroacetico
Le proprietà fisiche dell’acido dicloroacetico, noto anche come acido 2,2-dicloroetanoico, includono:
- Massa molare: 128,95 g/mol
- Punto di ebollizione: 192 °C (101,3 kPa)
- Punto di congelamento: 13,5 °C
- Densità: 1,564
- Pressione di vapore: 0,19 kPa (a 20 °C)
- Costante di dissociazione: 5×10-2 mol/L (a 18 °C)
2. Reazioni chimiche dell’acido dicloroacetico
L’acido dicloroacetico possiede due atomi di cloro che sono suscettibili alle reazioni di spostamento.
Quando reagisce con composti aromatici, forma acidi diarilacetici, mentre in presenza di fenolo, vengono prodotti acidi difenossiacetici.
Rispetto all’acido cloroacetico, l’acido dicloroacetico dimostra una minore suscettibilità all’idrolisi. Tuttavia, la presenza di impurità di acido dicloroacetico nell’acido cloroacetico può portare alla reticolazione durante la produzione di carbossimetilcellulosa (CMC) e amidi. L’effetto di reticolazione risultante può essere desiderabile o indesiderabile, a seconda dell’applicazione prevista del prodotto finale.
3. Metodi di produzione dell’acido dicloroacetico
L’approccio più economicamente fattibile per produrre acido dicloroacetico prevede l’idrolisi del cloruro di dicloroacetile.

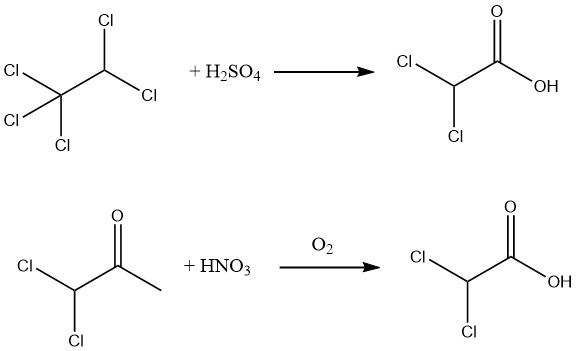
Inoltre, una resa del 90% di acido dicloroacetico puro al 98% può essere ottenuta mediante l’idrolisi del pentacloroetano utilizzando acido solforico all’88-99% o ossidando l’1,1-dicloroacetone con acido nitrico e aria.
L’idrolisi dell’estere metilico, facilmente ottenibile tramite l’esterificazione dell’acido dicloroacetico grezzo, consente la produzione di acido dicloroacetico eccezionalmente puro.

Inoltre, la declorazione catalitica dell’acido tricloroacetico o del tricloroacetato di etile con idrogeno su un catalizzatore al palladio fornisce un metodo per ottenere acido dicloroacetico e dicloroacetato di etile.

La separazione dell’acido dicloroacetico puro da altri acidi cloroacetici si rivela difficile attraverso mezzi fisici come la distillazione frazionata, principalmente a causa delle lievi differenze nei punti di ebollizione, in particolare tra acido dicloroacetico e tricloroacetico.
Tuttavia, efficaci colonne di distillazione possono frazionare in modo soddisfacente le miscele di esteri. Inoltre, le miscele dei sali derivati dai tre acidi cloroacetici possono essere lavate con acqua, alcol o soluzioni idroalcoliche per sciogliere preferibilmente il dicloroacetato, che può quindi essere acidificato per ottenere acido dicloroacetico puro.
In laboratorio, l’acido dicloroacetico può essere sintetizzato facendo reagire l’idrato di cloralio con cianuro di potassio o di sodio:
Cl3CCH(OH)2 + KCN → HCN + KCl + Cl2CHCOOH
4. Applicazioni dell’acido dicloroacetico
L’acido dicloroacetico trova utilità come reagente di prova nelle misurazioni analitiche durante la fabbricazione delle fibre, in particolare per la produzione di poli(etilene tereftalato). Serve anche come disinfettante medicinale, agendo come sostituto della formalina.
Inoltre, l’acido dicloroacetico svolge un ruolo fondamentale come agente di deblocking nella sintesi in fase solida di oligonucleotidi. Per svolgere questa funzione, è necessario un acido dicloroacetico ad alta purezza, sostanzialmente privo di cloralio (tricloroacetaldeide).
Nella sintesi organica, l’acido dicloroacetico, specialmente sotto forma di esteri, funge da materiale di partenza reattivo. Viene utilizzato nella produzione di acido gliossilico, dialcossi e diarossiacidi, nonché di sulfonamidi, fungendo quindi da composto intermedio cruciale.
Riferimento
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3