Ácido Crotónico: Propiedades, Reacciones, Producción y Usos
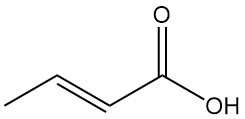
El ácido crotónico es el isómero trans del ácido 2-butenoico. Es un ácido carboxílico insaturado de cadena corta con la fórmula química CH3CH=CHCOOH. El isómero cis del ácido 2-butenoico se conoce como ácido isocrotónico.
El ácido crotónico aparece como un sólido de color blanco a amarillento con un olor acre y sofocante, mientras que el ácido isocrotónico es un líquido aceitoso e incoloro con un olor característico que se asemeja al azúcar moreno.
El término «ácido crotónico» proviene del aceite de croton, un aceite derivado de las semillas de Croton tiglium. Inicialmente, el ácido crotónico se identificó erróneamente como un producto formado durante la saponificación de este aceite.
El ácido crotónico se puede encontrar en el destilado de madera cruda y se produce como metabolito durante la degradación de los ácidos grasos.
Tabla de contenido
1. Propiedades físicas del ácido crotónico
Cuando cristaliza, el ácido crotónico forma agujas blancas o cristales prismáticos en el sistema monoclínico. Es ligeramente soluble en agua y soluble en etanol, acetona, acetato de etilo y tolueno, y forma un azeótropo con agua que contiene 96,86% de ácido crotónico a 99,7°C.
El ácido isocrotónico es miscible con agua y disolventes polares y forma una mezcla eutéctica con el ácido crotónico (30% de ácido crotónico), que se funde a -3°C.
La tabla 1 resume algunas de las propiedades físicas del ácido crotónico y del ácido isocrotónico.
| Propiedad | Ácido crotónico | Ácido isocrotónico |
|---|---|---|
| Peso molecular | 86,09 g/mol | 86,09 g/mol |
| Punto de ebullición | 189°C | 169°C |
| Punto de fusión | 72°C | 15°C |
| Densidad (20°C) | 1.018 | 1,0267 |
| Índice de refracción | 1,4228 (80 °C) | 1,4456 (20 °C) |
| Solubilidad en agua, g/kg | 41,5 (0°C), 94 (25°C) | 656 (40°C), 1260 (42°C) |
| Punto de inflamación | 88 °C | - |
| Temperatura de encendido automático | 396°C | - |
| Presión de vapor | 24 Pa (20 °C), 880 Pa (70 °C) | - |
| Calor específico | 3.031 J g-1 K-1 (sólido) 2.072 J g-1 K-1 (líquido) |
- |
| Calor de combustión | 2,00 MJ/mol | 2,03 MJ/mol |
| Calor de fusión | 150,9 J/g | - |
| pKa | 4,817 (25°C) | - |
2. Reacciones químicas del ácido crotónico
El ácido crotónico es un ácido débil en soluciones acuosas, por lo que puede reaccionar con bases orgánicas e inorgánicas.
El ácido crotónico sufre diversas transformaciones al calentarse, exponerse a ácidos, bases, radiación ultravioleta u otros reactivos. Estas reacciones incluyen isomerización, oligomerización y polimerización.
El ácido isocrotónico se isomeriza a ácido crotónico y alcanza el equilibrio a 140-180 °C. Se forma ácido 3-butenoico como subproducto, conteniendo la mezcla final una proporción de ácido isocrotónico a ácido crotónico de aproximadamente 0,17:1.
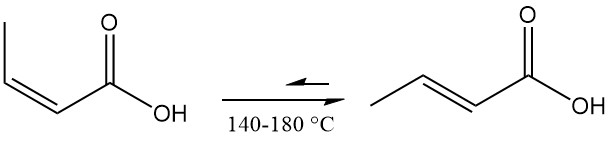
Tanto el ácido crotónico como el isocrotónico se pueden reducir a alcohol crotílico o ácido butírico. Por el contrario, se pueden oxidar al correspondiente perácido.
El ácido crotónico se copolimeriza fácilmente con varios monómeros mediante un mecanismo radicalario. Los copolímeros con acetato de vinilo tienen importancia industrial.
Las reacciones de adición al doble enlace del ácido crotónico producen ácidos butíricos 2-sustituidos o 2,3-disustituidos.
La hidrogenación catalítica convierte el ácido crotónico en ácido butanoico.
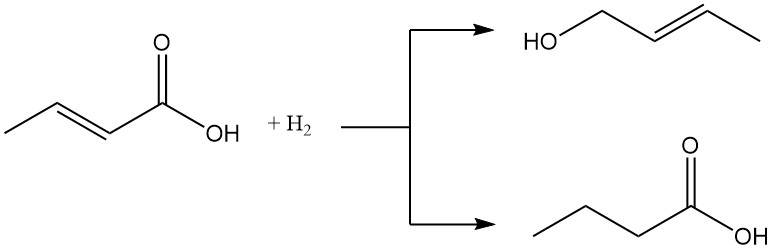
La halogenación o la adición de halogenuros de hidrógeno conduce a la formación de ácidos 2,3-dihalobutíricos o ácidos 3-halobutíricos.
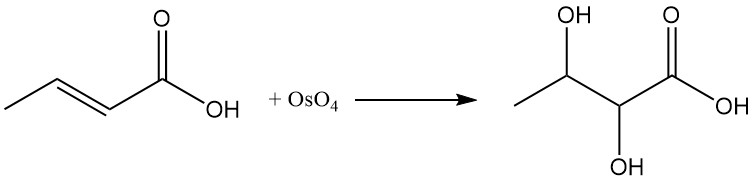
La reacción del ácido crotónico con tetróxido de osmio (OsO4) o ácido peroxibenzoico produce ácido 2,3-dihidroxibutanoico.
En condiciones de reacción adecuadas, la adición de amoníaco produce ácido β-aminobutírico.
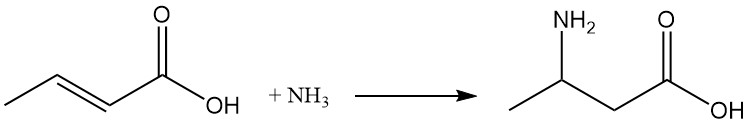
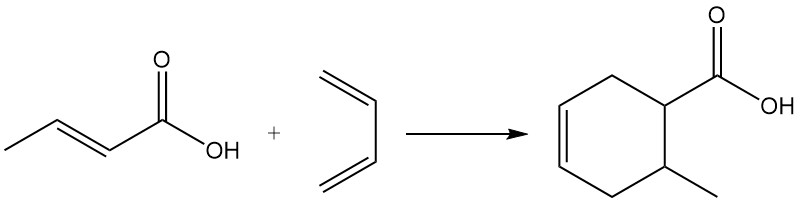
Por su carácter dienófilo, el ácido crotónico participa en las reacciones de Diels-Alder.
La esterificación del ácido crotónico es posible mediante métodos convencionales. Sin embargo, la presencia del doble enlace conjugado a menudo conduce a velocidades de reacción más lentas en comparación con el ácido butírico.
Los haluros de crotonilo se pueden sintetizar haciendo reaccionar ácido crotónico con el haluro de acilo correspondiente.
El anhídrido crotónico se obtiene mediante la reacción de cloruro de crotonilo con crotonato de sodio o tratando el ácido crotónico con anhídrido acético.
3. Producción de ácido crotónico
El ácido crotónico se produce industrialmente mediante la oxidación del crotonaldehído. Este proceso lo utilizan empresas como Weylchem Frankfurt y emplea una secuencia de reacción de dos pasos:
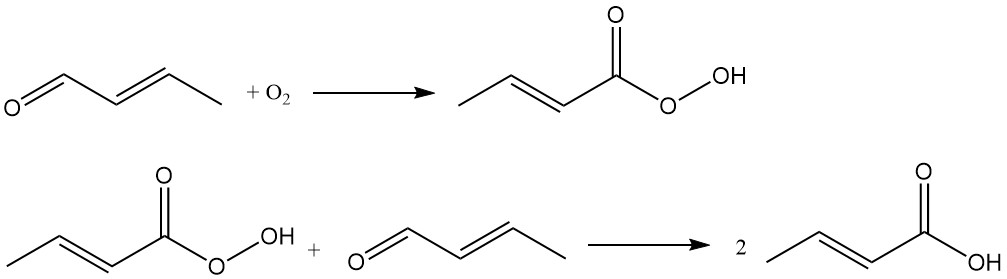
El crotonaldehído se oxida para formar ácido peroxocrotónico como intermediario, que reacciona con otra molécula de crotonaldehído para producir ácido crotónico.
La reacción suele ocurrir a temperaturas moderadas (20 a 45 °C) y presiones (100 a 500 kPa). Se añaden sales metálicas, particularmente de manganeso, cobalto, cobre o talio, como catalizadores para evitar la acumulación no deseada de peróxidos. Los subproductos incluyen ácido fórmico, ácido acético, agua y dióxido de carbono de la oxidación completa.
Un proceso histórico de Hoechst utilizó un catalizador de sal de manganeso para la oxidación del crotonaldehído a 20-30 °C. La mezcla de reacción resultante contenía aproximadamente:
- 20-30% de ácido crotónico
- 1-3% de ácido fórmico y acético
- 3-5% de agua
- Trazas de ácido 3-butenoico, compuestos desconocidos y entre 0,5 y 1 % de ácido isocrotónico
El exceso de crotonaldehído se recupera mediante destilación al vacío y se recicla nuevamente a la reacción. El residuo de la destilación, rico en ácido crotónico (60-70%), se purifica adicionalmente mediante una segunda destilación al vacío.
La fracción de bajo punto de ebullición y el residuo se desechan como residuos. La fracción principal del producto contiene ácido crotónico con algo de ácido isocrotónico (3-5%). Luego se utiliza la cristalización fraccionada para eliminar el ácido isocrotónico, produciendo ácido crotónico de alta pureza (hasta 99,9%).
Si bien la producción industrial se basa en la oxidación del crotonaldehído, existen varios métodos alternativos para la síntesis de ácido crotónico a escala de laboratorio. Éstas incluyen:
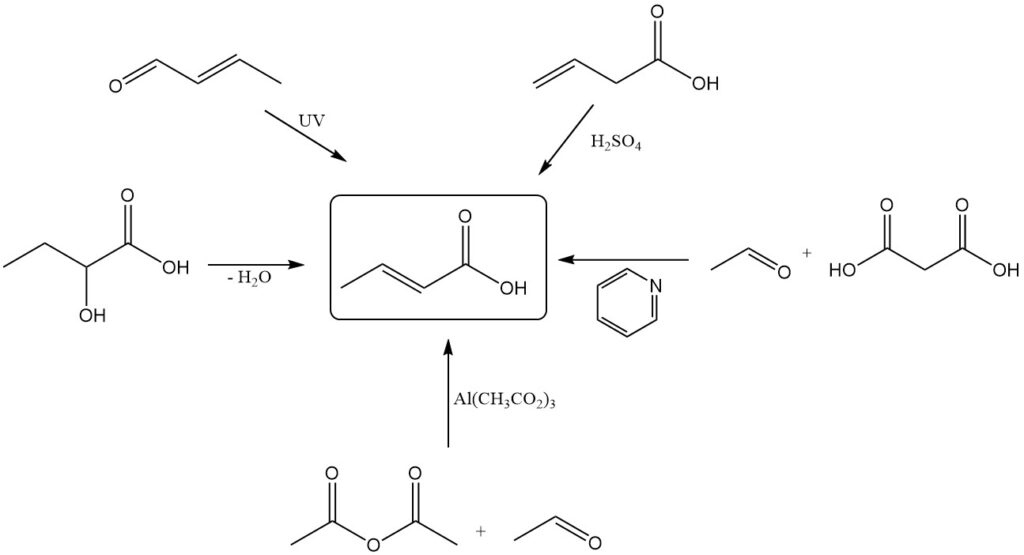
- Deshidratación del ácido 2-hidroxibutanoico
- Oxidación fotoquímica o irradiación oxidativa (con ultrasonidos) del crotonaldehído
- Isomerización del ácido vinilacético con ácido sulfúrico
- Condensación de acetaldehído y ácido malónico utilizando piridina como catalizador
- Oxidación de buteno con un sistema catalizador de ácido heteropolimolíbdico
- Oxicarbonilación de propeno con catalizadores complejos de metales de transición
- Carbonilación de óxido de propileno
- Reacción de anhídrido acético con acetaldehído utilizando un catalizador de acetato de aluminio básico
- Carbonilación de alcohol alílico con catalizadores a base de níquel o paladio
El ácido isocrotónico se puede separar de mezclas que contienen ácido crotónico mediante técnicas como cristalización fraccionada, rectificación (destilación) o cromatografía de filtración en gel.
Un método estereoespecífico para la preparación de ácido isocrotónico en laboratorio implica la bromación de 2-butanona (metil etil cetona), seguido de reordenamiento de Favorskii.
4. Usos del ácido crotónico
La aplicación principal del ácido crotónico es la producción de copolímeros con varios comonómeros. Los copolímeros de ácido crotónico y acetato de vinilo tienen importancia industrial. Estos copolímeros suelen comercializarse con nombres comerciales como Mowilith, Vinnapas y Vinac.
Los copolímeros de ácido crotónico se utilizan en pinturas, revestimientos, pinturas termofusibles, adhesivos y adhesivos termofusibles. También se utilizan para recubrimientos de papel y textiles, como floculantes, aglutinantes para explosivos, cerámicas y agroquímicos, y como aditivos para perforación.
Otras aplicaciones del ácido crotónico incluyen:
- Como agente antimicrobiano en forma de éster para desodorantes.
- En absorbentes de UV y pigmentos de interferencia con efecto metálico.
- Los ésteres de alcoholes grasos del ácido crotónico se emplean en la industria del cuero.
- El ácido libre tiene aplicaciones en combustibles para motores, grabado de superficies metálicas, deposición electroquímica de metales y estabilización térmica del PVC.
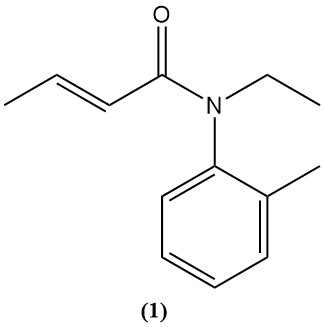
El ácido crotónico y sus derivados, como el anhídrido y el cloruro, sirven como precursores de diversos productos agroquímicos y farmacéuticos. Un ejemplo es el crotamitón (1), un fármaco utilizado para tratar la sarna (escabicida) y aliviar el picor (antipruriginoso).
5. Toxicología del ácido crotónico
El ácido crotónico es una sustancia corrosiva y puede causar irritación grave o quemaduras al entrar en contacto con los ojos, la piel o el tracto respiratorio. La inhalación puede provocar sensación de ardor, tos, dolor de cabeza, náuseas, dolor de garganta y dificultad para respirar (los síntomas pueden tardar). La ingestión causa dolor, sensación de ardor, dolor de garganta, diarrea y vómitos.
Los datos toxicológicos de estudios en animales se enumeran a continuación:
- LD50 (rata, oral): 1000 mg/kg
- LD50 (rata, i.p.): 100 mg/kg
- LD50 (conejo, dérmica): 600 mg/kg
El cuerpo puede producir ácido crotónico de forma natural durante el metabolismo de las grasas y descomponerlo rápidamente mediante enzimas en el hígado y otros tejidos. Es poco probable que la exposición a concentraciones no irritantes cause efectos acumulativos.
El ácido crotónico puede afectar el crecimiento de las plantas y la germinación de las semillas.
Referencia
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
