Zimtsäure
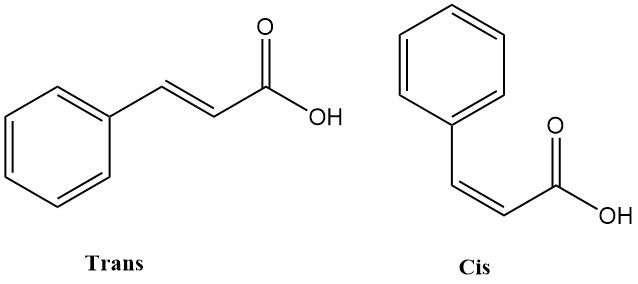
Zimtsäure (3-Phenylpropensäure) ist eine organische Verbindung mit der chemischen Formel C6H5CH=CHCOOH, die in der Natur vorkommt und im Handel erhältlich ist. Es liegt in zwei isomeren Formen vor: cis und trans. Das trans-Isomer ist stabiler und die vorherrschende Form, die natürlicherweise und kommerziell vorkommt.
Im Jahr 1780 isolierte Trommsdorf Zimtsäure in Form von Kristallen aus Zimtöl, der sie mit Benzoesäure verwechselte. Später, im Jahr 1835, identifizierten Dumas und Péligot es. Bertagnini synthetisierte 1856 erfolgreich Zimtsäure aus Benzaldehyd und Acetylchlorid.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Zimtsäure
Die physikalischen Eigenschaften von trans-Zimtsäure sind wie folgt:
- CAS-Nummer: 140-10-3
- Molekulargewicht: 148,16 g/mol
- Physikalisches Erscheinungsbild: Farblose Kristalle mit einem schwach balsamischen Geruch
- Schmelzpunkt: 133 °C
- Siedepunkt: 300 °C (101,3 kPa) und 173 °C (13,3 kPa)
- Dichte: 1,2475 g/cm³ bei 4 °C und 1,0270 g/cm³ bei 180 °C
- pKa bei 25 °C: 4,46
- Verbrennungswärme: 30,5 kJ/g
- Löslichkeit: Leicht löslich in Wasser, gut löslich in polaren organischen Lösungsmitteln wie Ethanol, Methanol, Chloroform und Aceton.
Die cis-Zimtsäure [102-94-3] liegt in drei kristallinen Formen vor: cis-Allozimtsäure (Schmelzpunkt 68 °C). ) und zwei cis-Isozimtsäuren (Schmelzpunkt 58 °C und 42 °C).
Die niedriger schmelzende cis-Isozimtsäure ist sehr instabil und wandelt sich leicht in cis-Allozimtsäure um. Eine gegenseitige Umwandlung zwischen den drei Formen ist durch Beimpfen ihrer Schmelzen möglich.
2. Chemische Reaktion von Zimtsäure
Zimtsäure weist eine Reaktivität auf, die sowohl für ihre Carboxylgruppe als auch für die olefinische Doppelbindung charakteristisch ist.
Zimtsäure reagiert mit Alkoholen unter Bildung von Zimtsäureestern, von denen einige bedeutende Geschmacks- und Dufteigenschaften besitzen. Es reagiert mit anorganischen Säurechloriden (Thionylchlorid und Phosphorchloride) zu Cinnamoylchlorid.
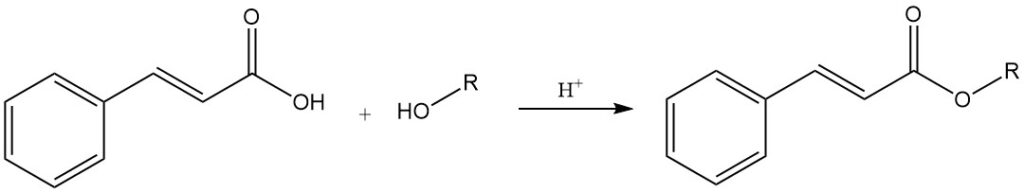
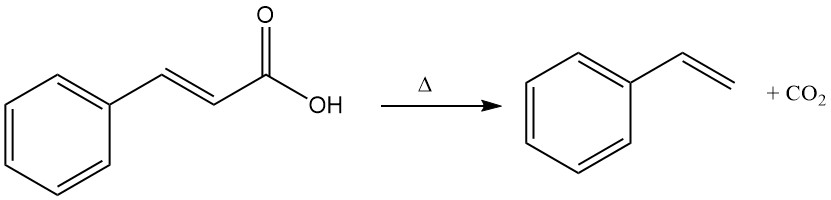
Zimtsäure unterliegt einer thermischen Zersetzung (Decarboxylierung) unter Bildung von Styrol und Kohlendioxid.
Benzaldehyd kann durch Spaltung der Doppelbindung mit Oxidationsmitteln oder durch Erhitzen mit Alkali hergestellt werden.
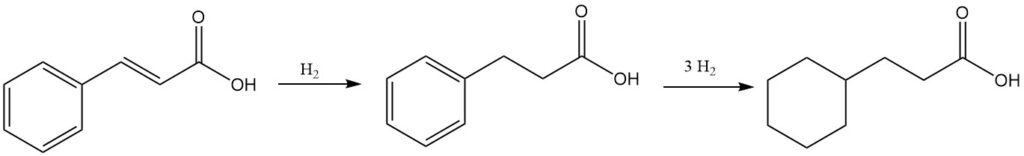
Zimtsäure kann je nach Reaktionsbedingungen entweder zu 3-Phenylpropionsäure oder 3-Cyclohexylpropionsäure hydriert werden.
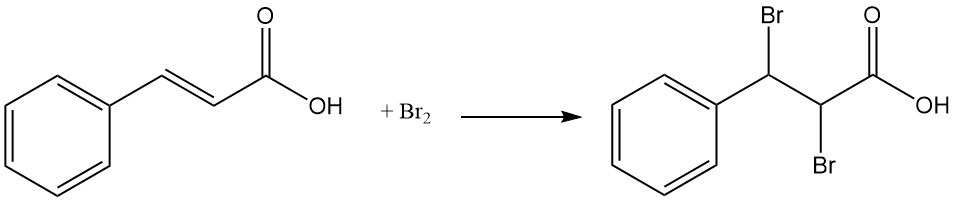
Unter Sonnenlicht bildet Zimtsäure Dimere, darunter Truxinsäure und α-Truxillinsäure.
Substitutionsreaktionen am Benzolring der Zimtsäure werden selten zur Herstellung neuer Derivate eingesetzt.
3. Vorkommen in der Natur
Zimtsäure, überwiegend in ihrer trans-Form, kommt natürlicherweise sowohl in freier als auch in veresterter Form (Zimtsäureester) in verschiedenen Pflanzenmaterialien vor.
Die freie Form findet sich in:
- Cassiaöl
- Extrahieren Sie Öl aus Populus balsamifera
- Ätherische Öle aus Blättern und Schalen von Citrus bigaradia
In Pflanzenmaterialien kommen verschiedene Zimtsäureester vor, darunter Methylzimtester, der in den Ölen von Alpinia-Arten und Ocimum canum-Sorten vorkommt, sowie Benzyl-, Zimtsäure- und Hydrozimtsäureester, die in Peru-, Tolu- und Storaxbalsamölen vorkommen. Auch Benzoeharze aus Siam und Sumatra enthalten Zimtsäureester.
4. Herstellung von Zimtsäure
Die kommerzielle Produktion von Zimtsäure begünstigt durch verschiedene etablierte Verfahren überwiegend das trans-Isomer:
4.1. Herstellung von Zimtsäure durch Perkin-Reaktion
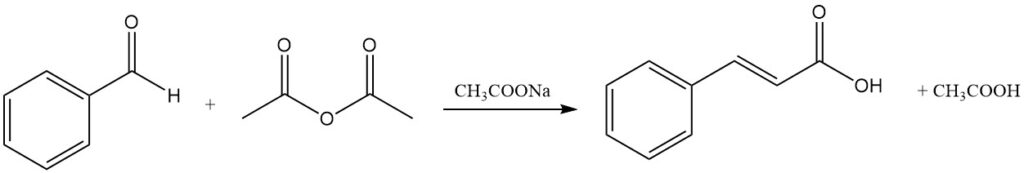
Die Perkin-Reaktion ist die traditionelle kommerzielle Methode zur Herstellung von Zimtsäure durch Kondensation von Benzaldehyd mit Essigsäureanhydrid in Gegenwart eines Katalysators, typischerweise Natriumacetat. Andere Katalysatoren wie Kaliumacetat, tertiäre Amine, Kaliumphosphat und Trimethylborat können ebenfalls verwendet werden.
4.2. Herstellung von Zimtsäure durch Claisen-Kondensation
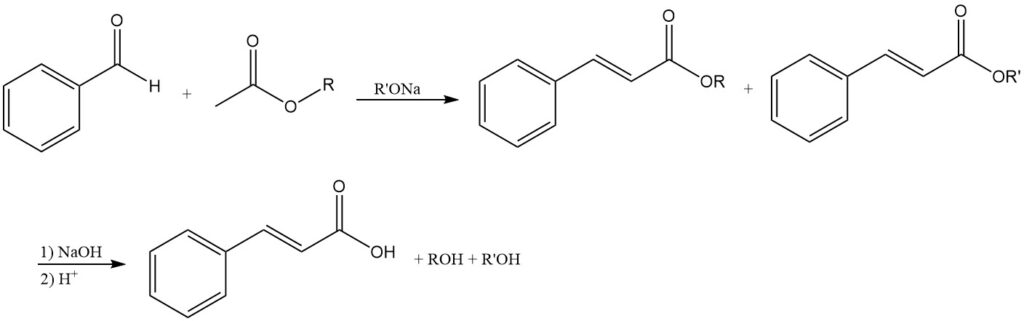
Bei der Kondensation von Benzaldehyd mit Essigsäureestern unter Verwendung von Alkalialkoholaten entstehen als Ausgangsprodukte Zimtsäureester, die nach Verseifung Zimtsäure ergeben.
4.3. Herstellung von Zimtsäure aus Benzalchlorid
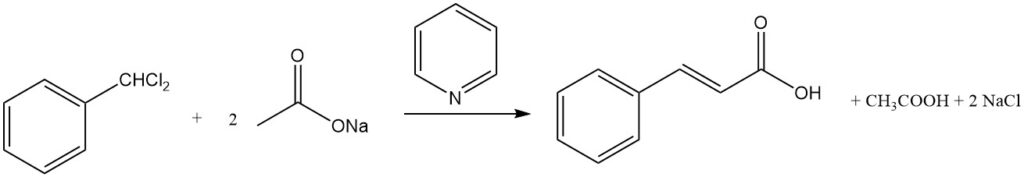
Zimtsäure kann in hohen Ausbeuten durch die Reaktion von Benzalchlorid und Alkaliacetat in alkalischem Medium synthetisiert werden. Die Anwesenheit von Aminen wie Pyridin kann die Ausbeute weiter auf über 80 % steigern.
4.4. Herstellung von Zimtsäure durch Oxidation von Zimtaldehyd
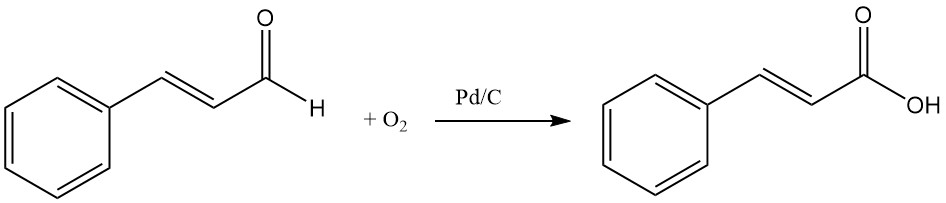
Zimtsäure kann durch Oxidation von Zimtaldehyd mit Sauerstoff und Katalysatoren wie Silber oder Palladium auf Holzkohle hergestellt werden.
4.5. Herstellung von Zimtsäure aus ihren Estern
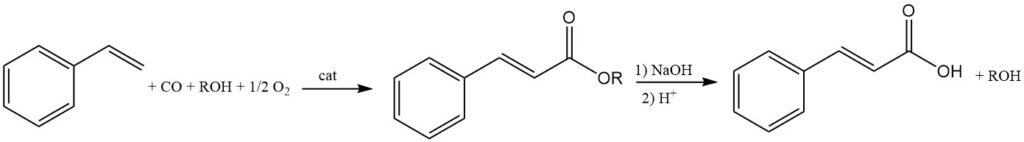
Zimtsäureester entstehen durch die Reaktion von Styrol, Alkoholen, Kohlenmonoxid und Sauerstoff unter Verwendung von Platin- oder Palladiumkatalysatoren. Durch die Hydrolyse dieser Ester kann dann die gewünschte Zimtsäure gewonnen werden.
5. Verwendungsmöglichkeiten von Zimtsäure
Zimtsäure wird als Vorstufe für die Herstellung künstlicher Süßstoffe (Aspartam) und Aromastoffe in Lebensmitteln und Getränken verwendet und hat aufgrund ihrer Eigenschaften potenzielle Anwendungen in Kosmetika und Pharmazeutika antimikrobielle und entzündungshemmende Eigenschaften.
Zimtsäureester, abgeleitet von Zimtsäure, werden aufgrund ihrer angenehmen Aromen häufig in Parfüms und Kosmetika verwendet.
Zimtsäure wird als Zwischenprodukt bei der enzymatischen Produktion von L-Phenylalanin verwendet, einem Schlüsselbestandteil von Peptidsüßstoffen (Aspartam).
Natriumcinnamat hemmt wirksam Korrosion und findet in verschiedenen Anwendungen Verwendung.
Zimtsäure wirkt als Korrosionsinhibitor beim Galvanisieren mit Zink (ohne Zyanid) und beim Entfernen von Zunder auf Zinkoberflächen und in Aerosoldosen.
Zimtsäure wird als Wärmestabilisator mit geringer Toxizität für PVC, als Vernetzungsmittel für verschiedene Polymere, einschließlich Polyurethane und Dimethylterephthalat-Ethylenglykol-Copolymere, und als Flammschutzmittel für Polycaprolactam verwendet.
Darüber hinaus wird es zur Herstellung von waschbeständigen Polyurethanklebstoffen für Polyesterfasern und zur Verbesserung der Lagerstabilität von Trockenöl-modifizierten Alkydharzbeschichtungen eingesetzt.
6. Toxikologie von Zimtsäure
Akute Toxizität
- Oral (Ratten): LD50 = 2,5 g/kg (relativ niedrig, was auf eine mäßige orale Toxizität hinweist)
- Dermal (Kaninchen): LD50 > 5 g/kg (relativ hoch, was auf eine geringe dermale Toxizität hinweist)
Hautreizung
- Unverdünnte Zimtsäure verursacht bei intakter oder abgeschürfter Kaninchenhaut nach 24-stündiger Einwirkung leichte Reizungen.
Hautsensibilisierung
- Eine 4 %ige Lösung von Zimtsäure in Vaseline verursachte bei Menschen keine Sensibilisierung.
Referenz
- Cinnamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_099
