Produktionsmethoden von Hydrazin
In einem industriellen Umfeld sind nur drei Oxidationsmittel von Bedeutung: Chlor, Sauerstoff und Wasserstoffperoxid.
Eine zusätzliche Herausforderung ergibt sich aus der Tatsache, dass Hydrazin, ein viel stärkeres Reduktionsmittel als Ammoniak, auch mit dem Oxidationsmittel reagieren kann.
Chlor wurde in großem Umfang im Raschig-Verfahren eingesetzt, das noch immer in Betrieb ist. Um eine weitere Oxidation von Hydrazin durch Chlor zu verhindern, müssen stark verdünnte Bedingungen verwendet werden, was zu Ausbeuten von nicht mehr als 60 % führt.
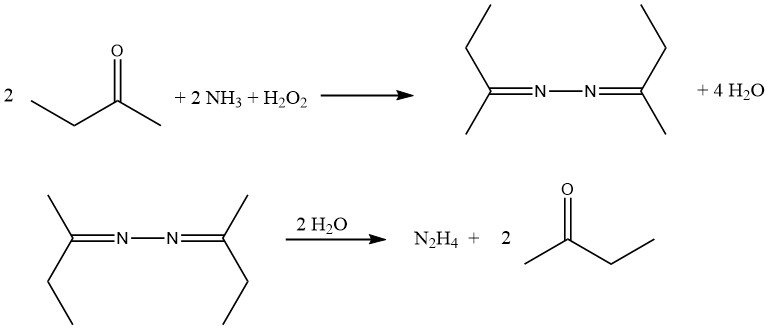
Die Hydrolyse von aus Aceton und Methylethylketon abgeleiteten Azinen unter Druck bietet eine Möglichkeit, Hydrazin herzustellen und gleichzeitig das Keton zu regenerieren.
Bayer hat die Ausbeuten durch die Einführung von Aceton im Raschig-Verfahren deutlich verbessert.
In den 1970er Jahren entwickelte PCUK (heute Atochem) ein neues, effizientes und umweltfreundliches Verfahren, das auf der Oxidation von Ammoniak durch Wasserstoffperoxid in Gegenwart eines Ketons basiert. Derzeit wird das meiste Hydrazin durch den Ketazin-Prozess hergestellt, bei dem Ammoniak entweder durch Chlor oder Wasserstoffperoxid oxidiert wird.
Inhaltsverzeichnis
1. Raschig-Prozess
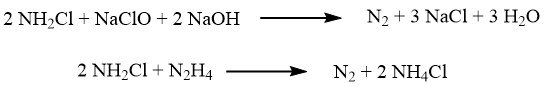
Beim Raschig-Verfahren erfolgt die Oxidation von Ammoniak mithilfe von Natriumhypochlorit, das durch Reaktion von Chlor mit Natriumhydroxid gewonnen wird.
Die Oxidation erfolgt in zwei Schritten. Im ersten Schritt, der bei ca. 5 °C durchgeführt wird, erfolgt eine schnelle Reaktion zur Bildung von Chloramin:
Anschließend wird das Reaktionsgemisch mit einem deutlichen Überschuss an Ammoniak (im Verhältnis 40:1) versetzt und die langsame Reaktion, die zu Hydrazin führt, findet bei Temperaturen zwischen 130 und 150 °C und einem Druck von 3,0 MPa statt:
Es können mehrere bemerkenswerte Nebenreaktionen auftreten, darunter:
Beim Verlassen des Reaktors enthält die Reaktionslösung etwa 1 % Hydrazinhydrat und etwa 4 % Natriumchlorid. Anschließend wird der Druck mithilfe einer Reihe von Verdampfern auf Atmosphärendruck reduziert.
Ammoniak wird kondensiert, konzentriert und recycelt. Die am Boden der Strippkolonnen gesammelte Lösung wird in einem herkömmlichen Zwangsumlauf-Salzverdampfer entsalzt. Das resultierende Destillat wird weiter konzentriert, um 100 % Hydrazinhydrat zu erhalten.
Um bei diesem Verfahren angemessene Ausbeuten zu erzielen, ist es wichtig, verdünnte Lösungen zu verwenden und ein hohes Verhältnis von Ammoniak zu Hypochlorit einzuhalten. Allerdings bleiben die mit der Verdampfung verbundenen Kosten trotz möglicher Dampfeinsparungen hoch.
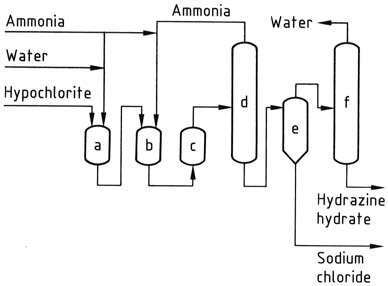
a) Chloraminreaktor; b), c) Hydrazinreaktoren; d) Ammoniakverdampfer; e) Hydrazin-Natriumchlorid-Abscheider; f) Hydrazinhydrat-Konzentrator
2. Olin-Raschig-Prozess
Beim Olin-Raschig-Verfahren zur Herstellung von wasserfreiem Hydrazin in Luft- und Raumfahrtanwendungen wird die Erzeugung von Natriumhypochlorit präzise gesteuert. Es wird eine niedrige Temperatur eingesetzt, um Zersetzung und Chloratbildung zu verhindern und gleichzeitig einen minimalen Überschuss an Natriumhydroxid aufrechtzuerhalten.
Die Natriumhypochloritlösung wird mit der dreifachen Menge Ammoniak bei 5 °C vermischt, um Chloramin zu erzeugen. Dieses Chloramin wird dann unter Druck (20–30 MPa) schnell in einen 30-fachen Überschuss an wasserfreiem Ammoniak eingeleitet und auf 130 °C erhitzt.
Die resultierende Reaktionsmischung, die 1–2 % Hydrazinhydrat enthält, wird einer Behandlung ähnlich dem herkömmlichen Raschig-Verfahren unterzogen, um Hydrazinhydrat zu erhalten. Wasserfreies Hydrazin wird durch Entfernung von Wasser durch azeotrope Destillation mit Anilin in einer bei Atmosphärendruck betriebenen Kolonne erhalten.
Durch die Kondensation des Dampfes entsteht ein Destillat mit zwei Schichten, wobei die wässrige Phase entfernt und die Anilinphase zum Kopf der Kolonne zurückgeleitet wird. Wasserfreies Hydrazin wird als Gemisch mit Anilin gewonnen, das dann durch Destillation abgetrennt werden kann.
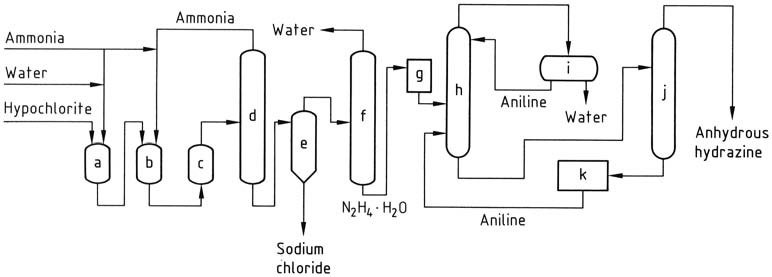
a) Chloraminreaktor; b), c) Hydrazinreaktoren; d) Ammoniakverdampfer; e) Hydrazin-Natriumchlorid-Abscheider; f) Hydrazinhydratkonzentration; g) Hydrazin-Hydrat-Speicherung; h) Hydrazinhydrat-Dehydratisierung; i) Anilin – Wasserdekantierung; j) Destillation von wasserfreiem Hydrazin; k) Anilinspeicherung
3. Harnstoffprozess
Harnstoff kann im Raschig-Verfahren als alternative Ammoniakquelle dienen. Obwohl dieser Ansatz derzeit nicht für die kommerzielle Produktion von Hydrazinhydrat eingesetzt wird, wurde er im kommerziellen Maßstab genutzt.
Es erwies sich zunächst als die kostengünstigste Methode für kleinere Produktionsmengen. Mit zunehmender Pflanzengröße wurde jedoch das traditionelle Raschig-Verfahren günstiger, wodurch die auf Harnstoff basierende Methode obsolet wurde.
Seit 1990 wurden in Asien erhebliche Mengen Hydrazodicarbonamid unter Verwendung der rohen Reaktionsmischung aus Harnstoff und Natriumhypochlorit als Hydrazinquelle hergestellt.
Dieser spezielle Prozess bringt jedoch die erhebliche Erzeugung von Nebenprodukten mit sich und erfordert eine teure Behandlung der Abwässer. Daher ist es wahrscheinlich, dass es mit der Zeit veraltet.
4. Bayer-Ketazin-Verfahren
Das Bayer-Verfahren ist eine modifizierte Version des Raschig-Verfahrens, bei dem Chloramin mit Ammoniak in Gegenwart von Aceton in einem pH-Bereich von 12–14 reagiert:
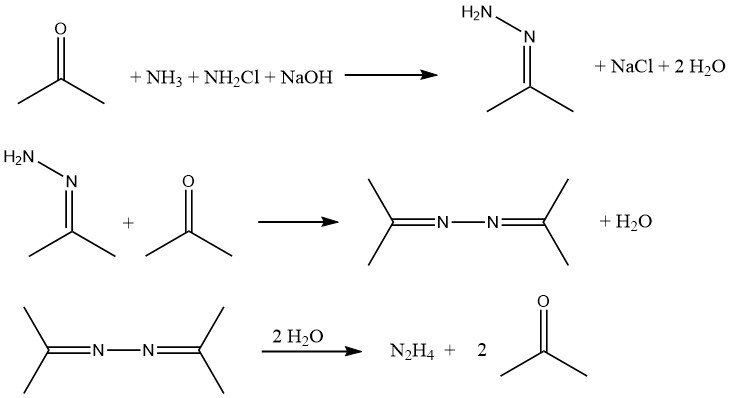
Gleichzeitig und kontinuierlich werden Natriumhypochlorit, Aceton und eine 20 %ige wässrige Ammoniaklösung (jeweils im Molverhältnis 1:2:20) bei etwa 35 °C und 200 kPa in einen Reaktor eingeleitet.
Überschüssiges Ammoniak wird durch Strippen aus der Reaktionsmischung entfernt, dann mit Wasser gequencht und als wässrige Lösung in den Reaktor zurückgeführt.
Die resultierende wässrige Lösung, die Dimethylketazin sowie restliches Aceton, Natriumchlorid und organische Verunreinigungen enthält, wird in eine Destillationskolonne eingespeist. In dieser Kolonne wird das Dimethylketazin als wässriges Azeotrop (bestehend aus 55 % Dimethylketazin) bei Atmosphärendruck (Siedepunkt 95 °C bei 101,3 kPa) gewonnen.
Durch die Einleitung von Aceton in die Destillationskolonne soll eine vorzeitige Hydrolyse des Ketazins verhindert werden. Das aus der Destillieranlage gewonnene Nebenprodukt ist eine Natriumchloridlösung, die Spuren von Hydrazin und organischen Verbindungen enthält. Diese Lösung muss vor der Entsorgung oder dem Recycling zur Elektrolyse behandelt werden.
Anschließend wird das Dimethylketazin in einer Druckdestillationskolonne (bei 0,8–1,2 MPa betrieben) hydrolysiert, wodurch Aceton entsteht, das in den Reaktor zurückgeführt wird, und eine 10 %ige wässrige Hydrazinlösung. Anschließend wird die Hydrazinlösung auf einen Hydrazingehalt von 64 % konzentriert.
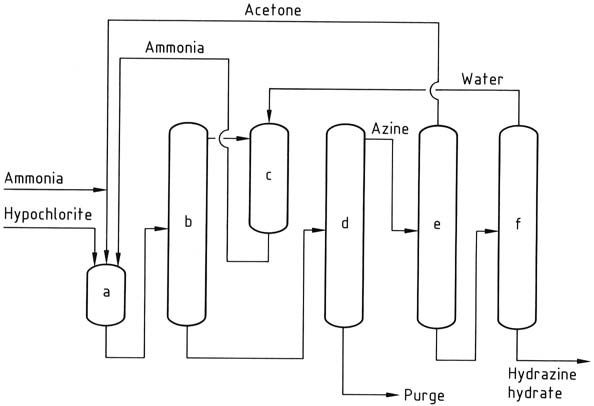
a) Azinreaktor; b) Ammoniak-Stripping; c) Abschrecken mit Ammoniak; d) Azin-Destillation; e) Azinhydrolyse; f) Hydrazinhydratkonzentration
5. Fisons-Prozess
Das ursprünglich von Whiffen and Sons implementierte Verfahren wurde von Fisons weiterentwickelt und in den 1960er Jahren in Betrieb genommen. Bei diesem Verfahren wurde Methylethylketon anstelle von Aceton eingesetzt, um das Hydrazin abzufangen, und der Hydrolyseschritt umfasste die Verwendung von Schwefelsäure.
Dieser spezielle Prozess ist jedoch nicht mehr in Betrieb.
6. Peroxidprozess
Das neueste Hydrazinverfahren, das von PCUK entwickelt wurde und derzeit von ATOFINA in Frankreich und Mitsubishi Gas in Japan eingesetzt wird, nutzt Wasserstoffperoxid als Oxidationsmittel. Die Reaktion findet bei Atmosphärendruck und 50 °C in Gegenwart von Methylethylketon (MEK) mit einem Verhältnis von H2O2:MEK:NH3 von 1:2:4 statt.
Zur Aktivierung des Wasserstoffperoxids setzt ATOFINA Acetamid und Dinatriumhydrogenphosphat ein, während Mitsubishi Gas eine Arsenverbindung verwendet. Die Gesamtreaktion führt mit hoher Ausbeute zur Bildung von Methylethylketazin.
Der Reaktionsmechanismus beinhaltet die Aktivierung sowohl von Ammoniak als auch von Wasserstoffperoxid, da diese beiden Reaktanten im Gegensatz zu Ammoniak und Hypochlorit im Bayer-Verfahren nicht auf natürliche Weise miteinander reagieren. Die Reaktion verläuft über die Bildung eines Oxaziridin-Zwischenprodukts, das Ammoniak zu einem Hydrazinderivat oxidieren kann.
Aufgrund der Unlöslichkeit von Methylethylketazin im Reaktionsgemisch kann es durch Dekantieren leicht abgetrennt werden. Das abgetrennte Ketazin wird anschließend durch Destillation gereinigt. Unter Druck (0,8–10 MPa) wird das gereinigte Ketazin hydrolysiert, was zu konzentriertem wässrigem Hydrazin und Methylethylketon im Kopf führt, das recycelt wird.
Die den Aktivator enthaltende wässrige Schicht wird konzentriert, um Wasser zu entfernen, und anschließend in die Reaktoren zurückgeführt, nachdem wasserlösliche Verunreinigungen durch eine Spülung entfernt wurden. Das Peroxidverfahren bietet gegenüber anderen Verfahren mehrere Vorteile, darunter das Fehlen von Salznebenprodukten, hohe Ausbeuten, geringer Energieverbrauch, minimaler molarer Überschuss und keine Notwendigkeit einer wässrigen Abwasserbehandlung.
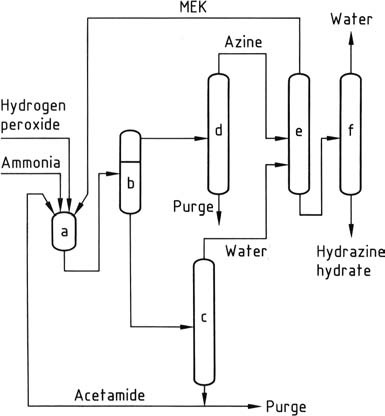
a) Azinreaktor; b) Phasentrenner; c) Konzentration der wässrigen Phase; d) Azinreinigung; e) Azinhydrolyse; f) Hydrazinhydratkonzentration
Referenz
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
