Mandelsäure: Eigenschaften, Herstellung und Verwendung
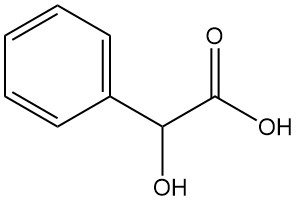
Was ist Mandelsäure?
Mandelsäure, auch bekannt als α-Hydroxyphenylessigsäure oder Phenylglykolsäure, ist eine aromatische Alpha-Hydroxysäure mit der chemischen Formel C8H8O3. Es ist ein weißes kristallines Pulver mit einem schwach süßen Geruch.
Mandelsäure wurde erstmals 1831 vom deutschen Apotheker Ferdinand Ludwig Winckler entdeckt. Er isolierte sie, indem er Amygdalin, eine in Bittermandeln vorkommende Verbindung, mit verdünnter Salzsäure erhitzte.
Der Name „Mandelsäure“ leitet sich vom deutschen Wort „Mandel“ ab.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Mandelsäure
Racemische (R,S)-Mandelsäure ist ein farbloser, kristalliner Feststoff, der in Ethanol und Diethylether gut löslich, in Chloroform weniger löslich und in Petrolether unlöslich ist. Alkalische Lösungen lösen Mandelsäure in die entsprechenden Salze auf.
Racemische (R,S)-Mandelsäure kann durch Reaktion mit Cinchonin in einer wässrigen Lösung in ihre Enantiomere getrennt werden, was zur Ausfällung von (S)-(+)-Mandelsäure als Salz führt, während (R)-(-)-Mandelsäure in Lösung bleibt.
Alternativ führt die Verwendung von S-(+)-Aminodiol für den Trennungsprozess zur Kristallisation von (R)-(-)-Mandelsäure, wobei das (S)-(+)-Enantiomer in Lösung verbleibt.
Tabelle 1 fasst die physikalischen Eigenschaften von Mandelsäure zusammen.
| Eigenschaft | (R,S)-Mandelsäure | (R)-(-)-Mandelsäure |
|---|---|---|
| CAS-Nummer | [611-72-3] | [611-71-2] |
| Chemische Formel | C8H8O3 | C8H8O3 |
| Molekular Gewicht | 152,15 g/mol | 152,15 g/mol |
| Schmelzpunkt | 118-121 °C | 132-135 °C |
| Siedepunkt | 321,8 °C | |
| Dichte | 1,30 g/cm3 | |
| Brechungsindex | 1,5204 | |
| Löslichkeit in Wasser | 15 g/100 ml | |
| pKa | 3,41 | |
| Flammpunkt | 163 °C | |
| Spezifische Drehung (c = 5) | [α]D20 =-154 bis -157° |
2. Chemische Reaktionen von Mandelsäure
Mandelsäure verfärbt sich bei Lichteinwirkung braun. Sie reagiert mit Basen zu Salzen wie Natriummandelat.
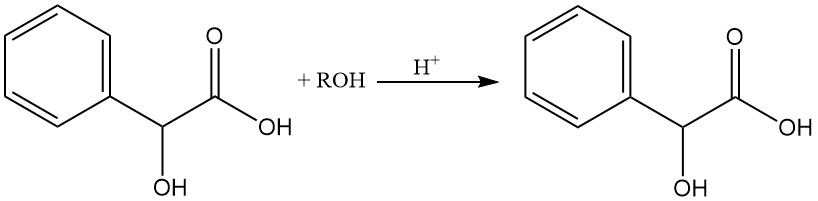
Mandelsäure lässt sich in Gegenwart von Chlorwasserstoff leicht mit Alkoholen verestern.
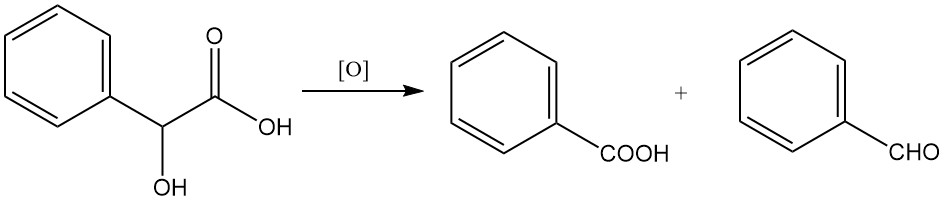
Die Oxidation mit starken Oxidationsmitteln wie Kaliumpermanganat oder Chromsäure kann zur Bildung von Benzaldehyd oder Benzoesäure führen.
Unter bestimmten Bedingungen kann Mandelsäure zu Benzol decarboxyliert werden.
Mandelsäure kann typische aromatische Substitutionsreaktionen wie Halogenierung, Alkylierung, Acylierung, Nitrierung und Sulfonierung durchlaufen.
3. Herstellung von Mandelsäure
Racemische (R,S)-Mandelsäure wird durch die Hydrolyse von Mandelsäurenitril mit Salzsäure hergestellt.
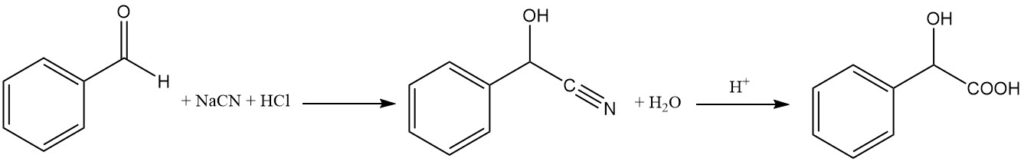
Mandelonitril wird durch die Reaktion von Benzaldehyd und entstehendem Cyanwasserstoff (NaCN + HCl) bei einer Temperatur unter 10 °C hergestellt. Natriumbisulfit wird als Katalysator verwendet. Das resultierende Mandelonitril ist eine ölige Flüssigkeit, die von der wässrigen Phase getrennt wird.
Das erhaltene Mandelonitril wird bei Raumtemperatur etwa 12 Stunden lang mit konzentrierter Salzsäure behandelt, und dann werden das überschüssige Wasser und die Salzsäure verdampft. Dieser Schritt führt zur Bildung von Rohmandelsäure.
Rohmandelsäure wird entweder durch Benzol- oder Etherextraktion gereinigt. Der feste Rückstand, der Mandelsäure enthält, wird mehrmals mit heißem Benzol oder Ether extrahiert und durch Abkühlen kristallisiert.
Die typische Ausbeute an reiner Mandelsäure beträgt etwa 50–52 %, basierend auf Benzaldehyd.
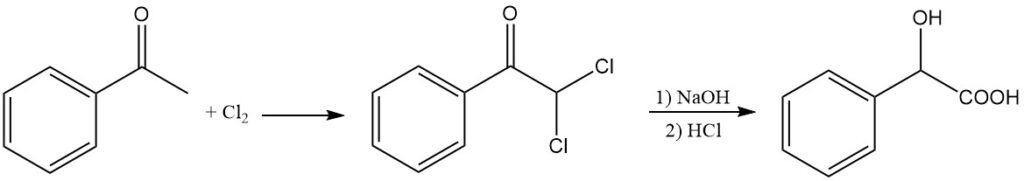
Mandelsäure kann alternativ durch die alkalische Hydrolyse von α,α-Dichloracetophenon synthetisiert werden. Durch die Reaktion von Acetophenon mit Chlor entsteht Dichloracetophenon, das bei 65 °C einer alkalischen Hydrolyse durch Natriumhydroxid und anschließender Acidolyse mit HCl unterzogen wird.
(R)-Mandelsäure kann durch einen Biosyntheseprozess hergestellt werden, der Styrol, L-Phenylalanin, Glycerin oder Glucose als Ausgangsstoffe verwendet. Durch die Kombination mehrerer enzymatischer Schritte kann (R)-Mandelsäure effizient aus diesen erneuerbaren Rohstoffen hergestellt werden.
Darüber hinaus ermöglicht die Integration der L-Phenylalanin-Biosynthese in den Prozess die direkte Umwandlung von Glucose oder Glycerin in (R)-Mandelsäure innerhalb eines einzigen Organismus. Diese biokatalytische Methode bietet eine vielversprechende Alternative zu herkömmlichen chemischen Synthesemethoden, befindet sich jedoch noch in der Entwicklung.
4. Verwendung von Mandelsäure
Mandelsäure wird hauptsächlich zur Herstellung ihrer Ester verwendet, die analgetische, antirheumatische und spasmolytische Mittel sind. Beispielsweise wird cis-3,5,5-Trimethylcyclohexylmandelat als spasmolytisches Mittel und Vasodilatator verwendet. Mandelsäure-Tropinester (Homatropin-HBr) wird in der Augenheilkunde zur Pupillenerweiterung verwendet.
Hexamethylentetraminmandelat, auch bekannt als Mandelin, Mandropin, Diuramin oder Hexydalin, wird zur Behandlung von Harnwegsinfektionen eingesetzt.
Mandelsäure wird auch in der Hautpflege zur Aknebehandlung, zum Peeling, zur Hyperpigmentierung, gegen Alterung und zur Verbesserung der Hautstruktur verwendet.
Mandelsäure hat bakteriostatische Eigenschaften und wird zur Behandlung von Harnwegsinfektionen eingesetzt. Oral verabreicht als Ammonium- oder Calciumsalz hemmt sie wirksam das Wachstum gramnegativer Bakterien und bestimmter grampositiver Mikroorganismen.
Optimale antimikrobielle Aktivität wird unter sauren Urinbedingungen (pH unter 5,5) beobachtet. Eine 1%ige Mandelsäurelösung wird als Spüllösung zur Pflege von Dauerkathetern verwendet.
5. Toxikologie der Mandelsäure
Studien zur akuten oralen Toxizität von Mandelsäure bei Ratten zeigen eine LDLo (oral, Ratte) von 3000 mg/kg.
Das Einatmen von Mandelsäure kann zu Reizungen der Atemwege führen, die bei längerer Einwirkung möglicherweise asthmaähnliche Symptome, Bronchitis oder Pneumokoniose hervorrufen. Personen mit bereits bestehenden Atemwegserkrankungen sind besonders gefährdet.
Mandelsäure ist ein starker Augenreizstoff.
Hautkontakt kann Hautentzündungen hervorrufen oder eine bestehende Dermatitis verschlimmern. Kontakt mit offenen Wunden vermeiden.
Wiederholte oder längere Einwirkung kann zu Nierenschäden und kumulativen gesundheitlichen Auswirkungen führen.
Referenzen
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Method for synthesizing mandelic acid. – https://patents.google.com/patent/CN112321410A/en
- https://bioresourcesbioprocessing.springeropen.com/articles/10.1186/s40643-021-00374-6
- https://www.orgsyn.org/demo.aspx?prep=CV1P0336
- https://pubs.rsc.org/en/content/articlelanding/2017/ra/c6ra25562k
- https://www.sciencedirect.com/science/article/abs/pii/S1075628002290072
- https://patents.google.com/patent/DE2936416A1/en
- https://www.lgcstandards.com/DE/en/Resources/Articles/Pharma_roots_mandelic_acid
- https://datasheets.scbt.com/sc-205481.pdf
