Maleinsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Maleinsäure?
Maleinsäure, auch bekannt als cis-Butendisäure, ist eine Dicarbonsäure mit der Formel C4H4O4. Sie erscheint als farbloser, kristalliner Feststoff mit schwachem Geruch.
Maleinsäure kommt in der Natur nicht vor und wurde erstmals 1834 durch Erhitzen von Apfelsäure synthetisiert. Maleinsäure erlangte industriell Bedeutung, nachdem 1919 die kommerzielle Produktion durch die katalytische Gasphasenoxidation von Benzol begann.
Maleinsäure und ihr Anhydrid wurden 1928 bzw. 1933 kommerziell erhältlich. Maleinsäure hat für sich genommen nur begrenzte industrielle Anwendungen, wird jedoch als Vorläufer für Maleinatharze und Copolyester verwendet.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Maleinsäure
Maleinsäure bildet bei Kristallisation monokline Prismenkristalle. Sie ist sehr gut löslich in Wasser und Ethanol, löslich in Aceton und Eisessig, schwach löslich in Ether und unlöslich in Benzol.
Tabelle 1 fasst die physikalischen Eigenschaften von Maleinsäure zusammen.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [110-16-7] |
| Chemische Formel | C4H4O4 |
| Molekulargewicht | 116,07 g/mol |
| Schmelzpunkt | 130,5 °C |
| Dichte | 1,590 g/cm3 |
| pKa1 bei 25 °C | 1,94 |
| pKa2 bei 25 °C | 6,23 |
| Bildungswärme | -788,3 kJ/mol |
| Verbrennungswärme | -1358,9 kJ/mol |
| Löslichkeit in Wasser |
|
| Flammpunkt | 127 °C |
2. Reaktionen von Maleinsäure
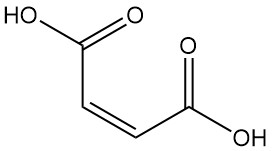
Maleinsäure weist aufgrund der Anwesenheit von Carboxylgruppen und einer Doppelbindung eine hohe Reaktivität auf. Über 100 °C wird sie durch Wasserabspaltung dehydratisiert und es entsteht Maleinsäureanhydrid. Weiteres Erhitzen, insbesondere mit Katalysatoren, fördert die Decarboxylierung und führt zur Acrylsäure.
Maleinsäure nimmt an typischen Carbonsäurereaktionen wie Veresterung und Amidierung teil, kann aber kein Säurechlorid bilden.
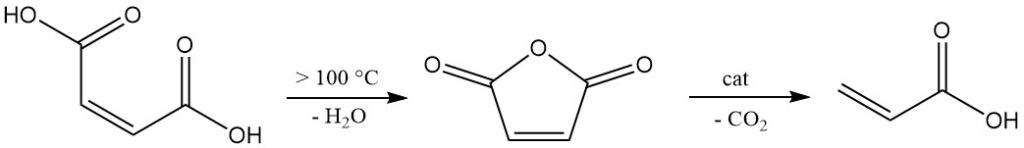
Die Anwesenheit der Doppelbindung ermöglicht verschiedene Reaktionen, wie etwa die Zugabe von Wasser bei erhöhter Temperatur und erhöhtem Druck, was zur Bildung von Apfelsäure führt.
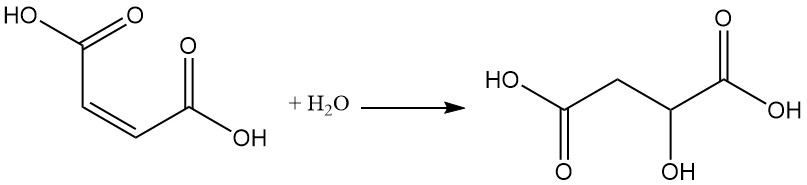
Durch die Reaktion von Maleinsäure mit Ozon entsteht Glyoxylsäure.
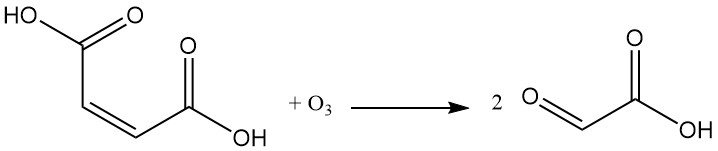
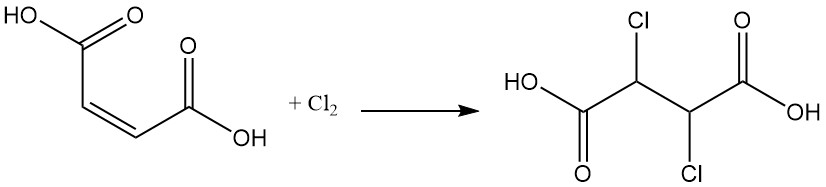
Durch Halogenaddition entstehen Dihalogenbernsteinsäureverbindungen; durch die Addition von Dichlor an Maleinsäure entsteht beispielsweise Dichlorbernsteinsäure.
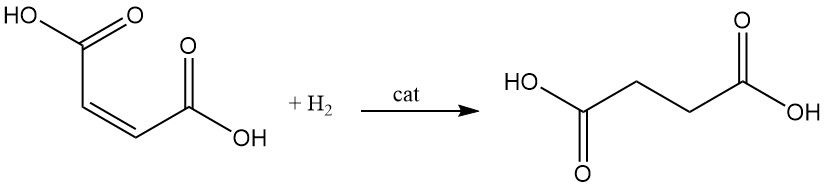
Die katalytische Hydrierung der Doppelbindung der Maleinsäure führt zur Bildung von Bernsteinsäure.
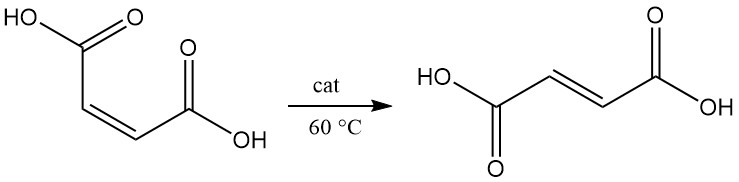
Die Isomerisierung von Maleinsäure zu Fumarsäure erfolgt schon bei 100 °C langsam. In Gegenwart eines Katalysators verläuft die Umwandlung schon bei 60 °C nahezu quantitativ.
3. Herstellung von Maleinsäure
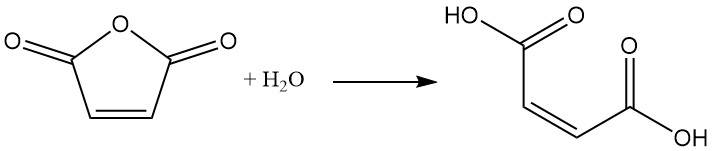
Die gängigste Methode zur Herstellung von Maleinsäure ist die kontrollierte Hydratisierung von Maleinsäureanhydrid mit einer kleinen Menge Wasser. Nach dem Abkühlen des Reaktionsgemisches fällt das Produkt, Maleinsäure, als Feststoff aus.
Anschließend wird die überstehende Flüssigkeit (Mutterlauge) abgetrennt. Die feste Maleinsäure wird unter Vakuum getrocknet.
Die Mutterlauge kann entweder verdünnt und zur weiteren Maleinsäureproduktion in die Hydratationsstufe zurückgeführt oder zur Dehydratationseinheit zur Maleinsäureanhydridproduktion geleitet werden, wodurch eine separate Abwasserbehandlung entfällt. Aufgrund der rauen Bedingungen erfordert dieses Verfahren jedoch korrosionsbeständige Stahlgeräte.
Alternativ kann Maleinsäure direkt aus dem bei der Maleinsäureanhydridproduktion entstehenden Waschwasser gewonnen werden. Dieses Verfahren spart die für die Dehydratation zur Anhydridform erforderliche Energie. Es erfordert jedoch die Reinigung und Konzentration des Waschwassers.
Das Waschwasser muss mit Aktivkohle behandelt werden, um Verunreinigungen zu entfernen. Die verbrauchte Kohle wird dann entsorgt. Die gereinigte Lösung muss unter Vakuum konzentriert werden, da erhöhte Temperaturen die Bildung von Fumarsäure fördern und die bei diesem Verfahren verwendeten Chrom-Nickel-Stahlgeräte über 80 °C korrodieren.
Angereicherte Waschwasserströme aus Oxidationsprozessen wie o-Xylol und Naphthalin, die bei der Herstellung von Phthalsäureanhydrid verwendet werden, können neben Fumarsäure und Maleinsäureanhydrid auch als Ausgangsstoff für die Herstellung von Maleinsäure verwendet werden.
4. Verwendung von Maleinsäure

Maleinsäure ist ein wichtiger Bestandteil bei der Herstellung von Polyestern, die für faserverstärktes Laminat und Fahrzeuglacke verwendet werden.
Sie wird als Ausgangsstoff für die Synthese zahlreicher anderer Chemikalien verwendet.
Maleinsäure kann in Fumarsäure umgewandelt werden, eine weitere wertvolle Industriechemikalie.
Aufgrund ihrer sauren Eigenschaften kann sie als Säureregulator in bestimmten Lebensmitteln und Getränken verwendet werden.
Sie verbessert die Haftung zwischen verschiedenen Materialien, wie z. B. verzinkten Metallen (verzinktem Stahl) und Nylon, und wird mit Klebstoffen auf Methylmethacrylat-Basis verwendet.
Maleinsäure wird in Färbe- und Veredelungsprozessen für Naturfasern eingesetzt.
Die ionisierte Form (Maleat-Ion) wirkt als Inhibitor für Transaminasereaktionen in der biochemischen Forschung.
Maleinsäure wird als Puffermittel, Schaumbildner und pH-Regulator in Reinigungsprodukten und Haushaltspflegeprodukten verwendet.
5. Toxikologie der Maleinsäure
Das wichtigste toxikologische Problem bei Maleinsäure ist ihre lokale Reiz- und Ätzwirkung auf Haut, Schleimhäute und Augen. Studien zeigen, dass eine 20%ige wässrige Lösung bei Menschen leichte und reversible Hautreizungen verursachen kann, während niedrigere Konzentrationen (<5%) die Augen erheblich reizen können.
Tierversuche bestätigen diese lokale Reizwirkung als wichtigstes toxikologisches Merkmal.
Maleinsäure zeigt eine mäßige akute orale und dermale Toxizität. Die angegebenen LD50-Werte sind:
- 708 mg/kg (Ratte, oral)
- 2400 mg/kg (Maus, oral)
- 1560 mg/kg (Kaninchen, dermal)
- >1000 mg/kg (Meerschweinchen, dermal)
Nierenschäden sind eine mögliche systemische toxische Wirkung von Maleinsäure. Bei Ratten und Hunden wurden nach intraperitonealer Injektion und Inhalation morphologische und funktionelle Veränderungen der Nieren beobachtet.
Diese Schädigung ähnelt dem Fanconi-Syndrom, das möglicherweise durch die Wechselwirkung von Maleinsäure mit Glutathion in Nierenzellen verursacht wird, was zur Bildung von freien Radikalen und Peroxiden führt. Darüber hinaus scheint Maleinsäure die Transportmechanismen von Natrium- und Wasserstoffionen zu beeinflussen.
Chronische Expositionsstudien an männlichen Ratten (250–750 mg/kg/Tag für bis zu zwei Jahre) zeigten in allen Dosierungsgruppen eine erhöhte Sterblichkeit, Nierenschäden und verzögertes Wachstum. In der Gruppe mit der höchsten Dosierung wurden auch Leber- und Hodenschäden beobachtet.
In diesen Studien wurde keine Karzinogenität oder Genotoxizität festgestellt, obwohl sie nicht speziell für diesen Zweck konzipiert wurden.
Referenzen
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Acid
