Hydroxylamin: Reaktionen, Produktion und Verwendung

Hydroxylamin, erstmals 1865 von LOSSEN beschrieben, wurde später 1891 von LOBRY DE BRUYN als freie Base isoliert. RASCHIG erhielt ein Patent für das erste industrielle Verfahren zur Herstellung von Hydroxylammoniumsulfat in Deutschland (1908) und den Vereinigten Staaten (1911).
Die Bedeutung von Hydroxylaminsalzen und ihren Lösungen liegt in ihrer wesentlichen Rolle als Zwischenprodukte in verschiedenen industriellen Prozessen, insbesondere bei der Herstellung von Caprolactam. Die weltweite jährliche Kapazität zur Hydroxylaminproduktion wird auf 800.000 Tonnen geschätzt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Hydroxylamin
Hydroxylamin mit der chemischen Formel NH2OH hat die Eigenschaft, transparente Kristalle zu bilden, die farblos und geruchlos sind.
Diese Verbindung weist eine hohe Löslichkeit in Wasser sowie in Methanol und Ethanol auf. Mehrere mit Hydroxylamin verbundene physikalische Eigenschaften sind wie folgt:
| Eigenschaft | Wert |
|---|---|
| Molmasse | 33,03 g/mol |
| Schmelzpunkt (mp) | 32,05 °C |
| Siedepunkt (Siedepunkt) bei 29 kPa | 56 °C |
| Dampfdruck bei 0 °C | 0,36 kPa |
| Dampfdruck bei 32 °C | 7,1 kPa |
| Bildungsenthalpie | -114 kJ/mol |
1.1. Hydroxylammoniumsulfat
Die Hydroxylammoniumsulfatverbindung, auch bekannt als (NH3OH)2SO4 oder (NH2OH)2·H2SO4, liegt in kristalliner Form vor, die sich leicht in Wasser löst, in organischen Lösungsmitteln jedoch nur eine geringe Löslichkeit aufweist.
Die feste Form dieser Verbindung hat eine Dichte von 1,883 g/cm3, während die Schüttdichte etwa 1,10 g/cm3 beträgt.
Es ist wichtig zu beachten, dass sich Hydroxylammoniumsulfat zersetzt, wenn es Temperaturen über 120 °C ausgesetzt wird.
Wässrige Lösungen von Hydroxylammoniumsulfat sind klar und farblos. In einer 1 Gew.-%igen wässrigen Lösung beträgt der pH-Wert bei 20 °C 3,6.
1.2. Hydroxylammoniumchlorid
Kristallines Hydroxylammoniumchlorid, auch als (NH3OH)Cl oder NH2OH·HCl bezeichnet, ist ein hygroskopisches Salz, das Kristalle bildet. Es weist sowohl in Wasser als auch in Methanol eine hohe Löslichkeit auf.
Durch den Zusatz von 0,5 Gew.-% pyrogener Kieselsäure wird ein Zusammenbacken wirksam verhindert, wobei das Kieselgel als unlösliche und inerte Komponente fungiert.
Hydroxylammoniumchlorid hat eine Dichte von 1,676 g/cm3 und eine Schüttdichte von etwa 0,780 g/cm3.
Seine Zersetzung erfolgt bei Temperaturen über 120 °C. In Wasser gelöst hat eine 1 Gew.-%ige wässrige Lösung von Hydroxylammoniumchlorid bei 20 °C einen pH-Wert von 3,2.
2. Chemische Reaktionen von Hydroxylamin
Beim Erhitzen zersetzen sich Hydroxylammoniumsalze, und wenn lokales Erhitzen auftritt, kann es zu einer außer Kontrolle geratenen exothermen Zersetzung kommen. Die Anwesenheit von Schwermetallverunreinigungen, insbesondere Kupfer, kupferhaltigen Legierungen und Kupfersalzen, fördert die Zersetzung.
Bei der Zersetzung von Hydroxylammoniumsulfat entstehen Schwefeldioxid, Distickstoffmonoxid (Lachgas), Wasser und Ammoniumsulfat. Andererseits zerfällt Hydroxylammoniumchlorid in Chlorwasserstoff, Stickstoff, Wasser und Ammoniumchlorid.
Wenn Hydroxylammoniumsalze mit Alkali reagieren, entsteht Hydroxylamin, das leicht zersetzt wird. Die Reaktion mit Nitriten führt zur Zersetzung zu Distickstoffmonoxid.
Wässrige Lösungen von Hydroxylammoniumsalzen weisen einen Säuregehalt auf. Längere Einwirkung von 80 °C führt zu einer langsamen Zersetzung. Hydroxylamin und seine Salze wirken in Lösung als Radikalfänger und führen zur Bildung von Ammoniak und Stickstoff.
Bei der Oxidation von Hydroxylamin entstehen je nach Oxidationsmittel und Reaktionsbedingungen Stickstoffverbindungen in verschiedenen Oxidationsstufen.
Starke Reduktionsmittel wie Zink- oder Eisenpulver ergeben Ammoniak. Viele Metallionen bilden Komplexe mit Hydroxylamin.
Hydroxylammoniumsalze können bei Reaktion mit Oleum oder Chlorsulfonsäure in Hydroxylamin-O-sulfonsäure umgewandelt werden. Diese Säure dient als geeignetes Reagenz für Prozesse wie Aminierung, reduktive Desaminierung, Hydroxymethylierung und die Bildung von Heterozyklen.
Hydroxylamin kann sowohl an Stickstoff- als auch an Sauerstoffatomen reagieren. Bei der Herstellung von O-substituierten Hydroxylaminen ist der Schutz des Stickstoffatoms erforderlich, um eine N-Alkylierung zu vermeiden.
Hydroxylammoniumverbindungen reagieren mit Aldehyden und Ketonen unter Bildung von Oximen. β-Diketone und β-Dialdehyde ergeben Hydroxylamin-Isoxazole.
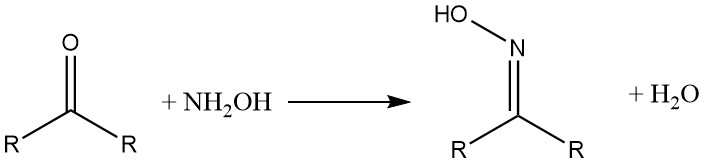
Hydroxylamin bildet mit Carbonsäuren und deren Derivaten die entsprechenden Hydroxamsäuren.

Die Reaktion mit Isocyanaten und Nitrilen führt zur Bildung von N-Hydroxyharnstoffen bzw. Amidoximen.

Hydroxylamin reagiert auch mit olefinischen Doppelbindungen:
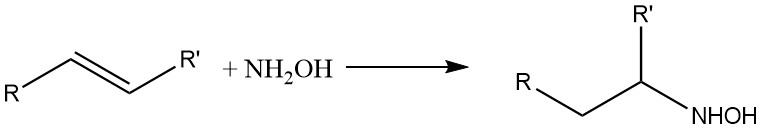
3. Produktion von Hydroxylamin
Bei der industriellen Herstellung von Hydroxylamin werden die höheren Oxidationsstufen des Stickstoffs reduziert. Beispielsweise können Stickstoffmonoxid oder Salpetersäure einer katalytischen Hydrierung unterzogen werden, um Hydroxylamin zu ergeben.
Die Reduktion von salpetriger Säure zu Hydroxylamin erfordert den Einsatz von schwefliger Säure. Bei all diesen Verfahren ist das resultierende Produkt eine wässrige Lösung eines Salzes, NH2OH·HX (wobei HX eine Säure wie Schwefel- oder Phosphorsäure darstellt) oder (NH3OH)X, und nicht freies Hydroxylamin.
Die saure Hydrolyse primärer Nitroalkane, bei der gleichzeitig die entsprechende Carbonsäure entsteht, spielt bei der Gesamtproduktion von Hydroxylamin eine untergeordnete Rolle.
3.1. Katalytische Hydrierung von Stickoxid
Um hochreines Stickoxid zu erhalten, wird ein zweistufiger Prozess eingesetzt. Zunächst werden Ammoniak und Sauerstoff an einem Platin-Rhodium-Katalysator bei Temperaturen über 900 °C zur Reaktion gebracht.
Um die Sicherheit zu gewährleisten, wird das Reaktionsgas mit ausreichend Wasser oder Wasserdampf verdünnt, sodass das Gemisch unter die untere Explosionsgrenze gebracht wird. Bei dieser Reaktion entstehen Stickoxid sowie Stickstoffdioxid und überschüssiger Sauerstoff als Nebenprodukte.
Im zweiten Schritt erfolgt die Hydrierung von Stickstoffdioxid und überschüssigem Sauerstoff an einem Silberkatalysator. Das Stickstoffdioxid wird in Stickstoffmonoxid umgewandelt, während der überschüssige Sauerstoff in Wasser umgewandelt wird.
Nach der Kondensation und gleichzeitiger Rückgewinnung von Wasserdampf wird das Stickoxid mithilfe eines Wäschers gereinigt.
Anschließend wird es durch Reaktion mit Wasserstoff unter 50 °C an einer teilweise vergifteten Platinkatalysatorsuspension in Schwefelsäure in Hydroxylamin umgewandelt. Als Nebenprodukte entstehen geringe Mengen Ammoniumsulfat und Distickstoffmonoxid.
Der industrielle Prozess folgt einem kontinuierlichen mehrstufigen Ansatz mit umfassender Rückführung der Abgase.
Das Restgas, das Wasserstoff, Stickstoff, Stickoxid und Distickstoffmonoxid enthält, kann zur Dampfrückgewinnung verbrannt werden. Durch sorgfältige Auswahl der Gaszusammensetzung können bei der Synthese von Hydroxylamin explosive Gasgemische vermieden werden.
Darüber hinaus umfasst ein modifizierter Prozess die katalytische Hydrierung von Stickstoffmonoxid, was zur Produktion von Cyclohexanonoxim und Hydroxylamin führt. Diese Methode wird als saure Oximierung bezeichnet.
3.2. Katalytische Hydrierung von Nitraten
Hydroxylamin wird üblicherweise durch das Hydroxylamin-Phosphat-Oxim-Verfahren (HPO) hergestellt. Bei diesem Verfahren wird eine Ammoniumnitratlösung in Gegenwart von Phosphorsäure hydriert.
Der HPO-Prozess wird typischerweise parallel zur Synthese von Cyclohexanonoxim durchgeführt, das bei der Herstellung von Caprolactam verwendet wird.
3.3. Der Raschig-Prozess
Das häufig modifizierte Raschig-Verfahren bleibt eine bedeutende Methode zur industriellen Herstellung von Hydroxylamin.
Beim Raschig-Prozess reagieren Wasser, Ammoniak und Kohlendioxid in einer Absorptionskolonne. Diese Reaktion führt zur Bildung einer Ammoniumcarbonatlösung, die bei niedrigen Temperaturen mit Stickoxiden reagiert und eine alkalische Lösung von Ammoniumnitrit erzeugt:
NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + NO + NO2 → 2 NH4NO2 + CO2
Im darauffolgenden Schritt wird das Ammoniumnitrit durch Reaktion mit Schwefeldioxid in Ammoniumhydroxylamindisulfonat umgewandelt:
NH4NO2 + 2 SO2 + NH3 + H2O → HO–N(SO3NH4)2
Bei diesem Verfahren wird überschüssiges Ammoniumhydroxylamindisulfonat recycelt. Die Ammoniumhydroxylamindisulfonat enthaltende Lösung wird abgezogen, das Salz hydrolysiert und neutralisiert, wodurch als Endprodukte Hydroxylammoniumsulfat und Ammoniumsulfat entstehen.
HO–N(SO3NH4)2 + H2O → (NH3OH)2SO4 + (NH4)2SO4
3.4. Säurespaltung von Nitroalkanen
Die Spaltung von Gemischen, die Nitropropan und Nitromethan enthalten, kann durch Behandlung mit Schwefelsäure bei erhöhten Temperaturen erreicht werden. Diese Reaktion ergibt Hydroxylammoniumsulfat und die entsprechende Carbonsäure:
Nitropropan + Nitromethan + Schwefelsäure → Hydroxylammoniumsulfat + Carbonsäure
Aufgrund der hohen Kosten und der begrenzten Verfügbarkeit der erforderlichen Rohstoffe wurde dieses Verfahren jedoch nur in begrenztem Umfang eingesetzt.
4. Verwendung von Hydroxylamin
Mehr als 95 % der Hydroxylaminproduktion sind für die Herstellung von Cyclohexanonoxim oder Caprolactam bestimmt.
Verschiedene Hersteller nutzen entweder die Hydrierung oder das Raschig-Verfahren, wobei Unterschiede hauptsächlich in der Menge an Ammoniumsulfat beobachtet werden, die während der Oximierung erzeugt wird.
Hydroxylammoniumsalze dienen als stabile Form von Hydroxylamin und finden in verschiedenen Bereichen der chemischen Industrie Anwendung. Einige bemerkenswerte Verwendungszwecke sind:
1. Chemische Industrie: Fungiert als Reaktant zur Herstellung von Oximen als Zwischenprodukten und fungiert je nach pH-Wert auch als Oxidations- oder Reduktionsmittel.
2. Farben und Beschichtungen: Wird zur Herstellung spezieller Oxime verwendet, die als Anticrememittel verwendet werden.
3. Arzneimittel: Wird bei der Herstellung von Antibiotika, Steroiden, Beruhigungsmitteln, Spasmolytika und Arzneimitteln gegen Tuberkulose eingesetzt.
4. Fotografie: Wird als Stabilisator für Entwickler und als Zusatz in Farbemulsionen verwendet.
5. Gummiindustrie: Fungiert als Regulator bei der Polymerisation von Synthesekautschuk, als Antioxidans für Naturkautschuk und als Beschleuniger bei der Vulkanisation von Synthesekautschuk.
6. Seife: Dient als Hilfsmittel bei der Raffinierung von Fetten zur Seifenherstellung.
7. Kunststoffe: Fungiert als Regulator und Inhibitor bei verschiedenen Polymerisationsprozessen.
8. Metallurgie: Wird als Zusatzstoff für die Oberflächenbehandlung von Stahl, als Hilfsmittel für die Metallextraktion aus Elektrolyse-Ablauge und zur Rückgewinnung von Abraumhalden verwendet. Dient auch als Flotationsmittel für Kupfererze.
9. Nuklearindustrie: Dient als Hilfsmittel zur Trennung von Uran und Plutonium.
10. Textilien: Fungiert als Hilfsmittel in bestimmten Färbeprozessen, als Fixiermittel für Textilfarben und als Ausgangsmaterial für Textilfarben auf Basis von Isatin und Isoxazol.
11. Pflanzenschutz: Dient als Ausgangsstoff für die Herstellung von Insektiziden, Herbiziden und Pflanzenwachstumsregulatoren.
12. Lebensmittel: Fungiert als Zwischenprodukt bei der Herstellung von Süßungsmitteln.
Diese Anwendungen unterstreichen die Vielseitigkeit und Bedeutung von Hydroxylammoniumsalzen in einem breiten Spektrum von Branchen.
5. Toxikologie und Arbeitsmedizin
Hydroxylammoniumverbindungen gelten als gesundheitsschädlich und können Reizungen hervorrufen. Die LD50 (oral, Ratte) für Hydroxylammoniumverbindungen beträgt etwa 600–640 mg/kg. Was die aquatische Toxizität betrifft, liegt der LC50-Wert (Goldorfe, 48 Stunden) für Hydroxylammoniumsulfat zwischen 1 und 10 mg/L.
Bei Hautkontakt kann Hydroxylamin zu leichten bis mäßigen Reizungen führen, eine Sensibilisierung ist möglich. Es hat auch eine mäßige bis starke Reizwirkung auf Schleimhäute, beispielsweise die Augen.
Hydroxylamin kann über die Haut aufgenommen werden und kann Methämoglobin bilden.
Studien zur teratogenen Wirkung von Hydroxylamin (bei Ratten) haben keine schädlichen Auswirkungen auf die Nachkommen gezeigt. Während Hydroxylamin und seine Salze nach aktuellen Daten nicht als krebserregend gelten, wurde festgestellt, dass sie für niedere Organismen mutagen sind.
Es ist wichtig, den Kontakt mit Hydroxylammoniumsalzen zu vermeiden, da diese reizend wirken und der Staub möglicherweise Auswirkungen auf Haut, Augen und Rachen haben kann. Bei Haut- oder Augenkontakt sollten die betroffenen Stellen gründlich mit Wasser gespült werden.
Das Verschlucken von Hydroxylammoniumsalzen sollte unbedingt vermieden werden und gegebenenfalls ein Arzt konsultiert werden. Hydroxylammoniumsalze sollten als gefährliche Stoffe gekennzeichnet werden.
Referenz
- Hydroxylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a13_527
FAQ: Hydroxylamin
Hydroxylamin kann je nach Reaktion und Umgebung sowohl als Säure als auch als Base wirken.
Die konjugierte Säure von Hydroxylamin ist das Hydroxylammoniumion (NH3OH+).
Hydroxylamin wird in verschiedenen Anwendungen eingesetzt, unter anderem bei der Herstellung von Oximen als Zwischenprodukte in der chemischen Industrie, als Antioxidans und Regulator in der Gummiindustrie, bei der Synthese von Pharmazeutika, Farbstoffen und Pflanzenschutzmitteln sowie als Ausgangsstoff für die Herstellung von Caprolactam.
Hydroxylamin kann schädlich und reizend für Haut, Augen und Schleimhäute sein. Es sollte mit Vorsicht und angemessenen Sicherheitsmaßnahmen gehandhabt werden. Der Kontakt mit Hydroxylaminsalzen sollte vermieden und die Exposition minimiert werden.
Hydroxylamin selbst wird nicht als Medikament verwendet. Es kann jedoch als Zwischenprodukt bei der Synthese bestimmter Arzneimittel verwendet werden.
Der Stickstoff in Hydroxylamin hat eine formale Ladung von 0 (neutral).
Wenn Hydroxylamin als Base fungiert, nimmt das Stickstoffatom im Hydroxylamin ein Proton auf.
Keton reagiert mit Hydroxylamin unter Bildung eines Oxims.
Hydroxylamin kann durch verschiedene Methoden hergestellt werden, beispielsweise durch die Hydrierung von Stickstoffmonoxid oder Salpetersäure, den Raschig-Prozess oder die Hydrolyse und Neutralisation von Ammoniumnitrit. Die konkrete Methode hängt von der gewünschten Anwendung und der verfügbaren Technologie ab.
