Herstellungsprozess von Acetaldehyd
Die folgenden Rohstoffe wurden für die Herstellung von Acetaldehyd verwendet: Ethanol, das durch die Fermentation von Kohlenhydraten oder die Hydratisierung von Ethylen, Acetylen, Ethylen, niederen Kohlenwasserstoffen, Kohlenmonoxid sowie Wasserstoff und Methanol gewonnen wird.
Die Wirtschaftlichkeit kommerzieller Prozesse hängt von der Verfügbarkeit und den Preisen der Rohstoffe ab. In hochindustrialisierten Ländern, in denen es schwierig war, die hohen Ethanolpreise durch steuerliche Maßnahmen aufrechtzuerhalten, oder in denen petrochemisches Ethanol nicht verfügbar war (wie es vor 1939 in Deutschland oder Japan der Fall war), wurde Acetylen zum bevorzugten Ausgangsmaterial für Acetaldehyd.
Das Acetylenverfahren wird weiterhin in einigen osteuropäischen Ländern und von Unternehmen eingesetzt, die Zugang zu kostengünstigem Acetylen haben. In anderen Ländern wurde jedoch petrochemisch hergestelltes Ethanol zum bevorzugten Rohstoff, während aus Fermentation gewonnenes Ethanol in Ländern mit einer weniger bedeutenden chemischen Industrie in geringerem Umfang verwendet wurde und immer noch wird.
In westlichen Ländern, darunter Japan, wurden diese Verfahren weitgehend durch das Ende der 1950er Jahre von Wacker-Chemie und Hoechst entwickelte Direktoxidationsverfahren ersetzt. Diese Verschiebung erfolgte, weil Ethylen im Vergleich zu Acetylen zu geringeren Kosten erhältlich ist.
Selbst zweistufige Verfahren, bei denen aus Ethylen gewonnenes Ethanol als Ausgangsstoff zum Einsatz kommt, sind aufgrund der abnehmenden Bedeutung von Acetaldehyd als organischem Zwischenprodukt nicht mehr konkurrenzfähig.
Im Allgemeinen weisen Prozesse auf Basis von Acetylen, Ethylen und Ethanol eine höhere Selektivität auf als die Oxidation gesättigter Kohlenwasserstoffe. Denn im letzteren Fall entstehen neben Acetaldehyd noch weitere Oxidationsprodukte.
Wirtschaftlich sinnvoll sind diese Verfahren jedoch nur im Großbetrieb, bei dem alle im Prozess anfallenden Primär- und Sekundärprodukte verwertet werden, da die Trennung des Produktgemisches kostspielig sein kann.
Inhaltsverzeichnis
1. Herstellung von Acetaldehyd aus Ethanol
Zur Herstellung von Acetaldehyd gibt es zwei Methoden mit Ethanol: Dehydrierung und Oxidation in Gegenwart von Sauerstoff. Zwischen 1918 und 1939 wurde die Dehydrierung aufgrund der gleichzeitigen Produktion von Wasserstoff bevorzugt. Später wurde jedoch die katalytische Dampfphasenoxidation von Ethanol zum bevorzugten Verfahren, wahrscheinlich aufgrund der längeren Lebensdauer des Katalysators und der Möglichkeit der Energierückgewinnung.
1.1. Dehydrierung von Ethanol
Die ersten Studien zur Ethanoldehydrierung, die 1886 dokumentiert wurden, umfassten die Durchleitung von Ethanol durch Glasrohre bei 260 °C.
CH3CH2OH → CH3CHO + H2 ΔH = +82,5 kJ/mol
Verbesserte Ausbeuten werden mit Katalysatoren wie Platin-, Kupfer- oder Zink-, Nickel- oder Kobaltoxiden erzielt. Nachfolgende Patente erwähnen Zink- und Chromkatalysatoren, Seltenerdmetalloxide und Mischungen aus Kupfer- und Chromoxiden. Kupferkatalysatoren erzeugen die geringste Menge an Zersetzungsprodukten, es ist jedoch eine häufige Regenerierung des Katalysators erforderlich.
1.1.1. Prozessbeschreibung
Ethanoldampf wird durch einen Rohrreaktor geleitet, der einen Katalysator aus Kupferschwamm oder mit Chromoxid aktiviertem Kupfer bei Temperaturen von 260–290 °C enthält. Jeder Lauf führt zu einer Conversion-Rate von 25–50 %.
Acetaldehyd und Ethanol werden durch Alkohol- und Wasserwäsche aus dem Abgas, das hauptsächlich aus Wasserstoff besteht, abgetrennt. Reiner Acetaldehyd wird durch Destillation gewonnen, während Ethanol durch Destillation von Wasser und höhersiedenden Produkten getrennt und in den Reaktor zurückgeführt wird.
Die endgültige Acetaldehydausbeute beträgt etwa 90 %. Zu den Nebenprodukten gehören Buttersäure, Crotonaldehyd und Ethylacetat.
1.2. Oxidation von Ethanol
Die Oxidation von Ethanol ist die älteste und effektivste Labormethode zur Synthese von Acetaldehyd. Im kommerziellen Verfahren wird Ethanol in der Dampfphase katalytisch mit Sauerstoff (oder Luft) oxidiert.
CH3CH2OH + 0,5 O2 → CH3CHO + H2O ΔH = -242 kJ/mol
Kupfer, Silber und deren Oxide oder Legierungen sind häufig verwendete Katalysatoren.
1.3. Veba-Chemie-Prozess
Beim Veba-Chemie-Verfahren wird Ethanol mit Luft kombiniert und bei Temperaturen von 500 bis 650 °C über einen Silberkatalysator geleitet. Die spezifische Temperatur hängt vom Alkohol-Luft-Verhältnis und der Gasströmungsgeschwindigkeit durch den Katalysator ab.
Der Alkoholumsatz liegt zwischen 50 und 70 %, die Ausbeute variiert je nach Reaktionsbedingungen zwischen 97 und 99 %. Acetaldehyd und nicht umgewandelter Alkohol werden durch kalte Alkoholwäsche und fraktionierte Destillation aus dem Abgas abgetrennt.
Nach der Konzentration gelangt der Alkohol zurück in den Reaktor. Die während der Reaktion entstehende Wärme wird zur Dampferzeugung mithilfe eines Abwärmerückgewinnungssystems unmittelbar nach der Reaktionszone genutzt.
Das Abgas besteht überwiegend aus Stickstoff, Wasserstoff, Methan, Kohlenmonoxid und Kohlendioxid und wird als niederkalorisches Schwachgas in Dampferzeugern verbrannt. Als Nebenprodukt entstehen geringe Mengen Essigsäure.
2. Herstellung von Acetaldehyd aus Acetylen
Der Einsatz von Quecksilberverbindungen dient als Primärkatalysator für den industriellen Wasserzugabeprozess (Hydratation) bei der Acetylenproduktion.
Für eine erfolgreiche industrielle Umsetzung dieser Methode ist es wichtig, die in saurer Umgebung gebildeten Polymerisations- und Kondensationsprodukte von Acetaldehyd zu eliminieren.
Im Jahr 1912 schlug das Consortium für elektrochemische Industrie ein Verfahren vor, das überschüssiges Acetylen bei erhöhter Temperatur nutzte. Dabei wurde das Acetaldehydprodukt sofort aus der Reaktionsflüssigkeit entfernt.
Gleichzeitig wurde die bei der Reaktion entstehende Wärme durch Abdestillieren einer entsprechenden Menge Wasser abgeführt. Sekundärreaktionen wie die Oxidation von Acetaldehyd zu Essigsäure und Kohlendioxid führten zur Reduktion von Hg2+ zu metallischem Quecksilber. Die Produktion von Acetaldehyd aus Acetylen wurde in westlichen Ländern inzwischen eingestellt.
2.1. Nassoxidationsverfahren (Hoechst)
Das Nassoxidationsverfahren bot eine Lösung, um den direkten Umgang mit giftigen Quecksilberverbindungen zu vermeiden. Es wurde unter anderem von der Wacker-Chemie eingesetzt, bis 1962 auf Ethylen als Ausgangsstoff umgestellt wurde.
Bei dieser Methode wurde Eisen(III)-sulfat zugesetzt, um das Quecksilbermetall zum Quecksilber(II)-Salz zu reoxidieren und so ausreichende Konzentrationen des aktiven Katalysators sicherzustellen. Acetylen reagierte mit der wässrigen Katalysatorlösung bei 90–95 °C.
Ungefähr 30–50 % des injizierten Acetylens reagierten in jedem Durchgang. Das aus dem Reaktor austretende Gas wurde abgekühlt, wodurch hauptsächlich Wasser und Spuren von Quecksilber abgeschieden wurden, die dann in den Reaktor zurückgeführt wurden.
Acetaldehyd und Wasser wurden in weiteren Kühlern kondensiert und der Acetaldehyd schließlich mit Wasser aus dem gekühlten Kreisgas ausgewaschen. Dieser Prozess ergab eine 8–10 %ige wässrige Acetaldehydlösung.
Stickstoff wurde mit dem Speisegas eingeführt, während Kohlendioxid als Nebenprodukt entstand. Um eine übermäßige Ansammlung zu verhindern, wurden diese Gase durch Entnahme eines kleinen Stroms des Kreisgases entfernt.
Bei der Reaktion entstand Eisen(II)sulfat, das in einem separaten Reaktor mit 30 %iger Salpetersäure bei 95 °C oxidiert wurde. Reiner Acetaldehyd wurde durch fraktionierte Destillation der wässrigen Lösung bei etwa 200 kPa gewonnen.
2.2. Chisso-Prozess
Beim Chisso-Verfahren wurde eine Schwefelsäure/Quecksilbersulfatlösung als Katalysator eingesetzt. Das Acetylen reagierte bei 68–78 °C und einem Überdruck von 140 kPa vollständig mit der Katalysatorlösung.
Eine Kombination aus Druck- und Vakuumverfahrensstufen, die bei niedrigen Temperaturen und ohne überschüssiges Acetylen durchgeführt wurden, ermöglichte die Isolierung und Destillation von reinem Acetaldehyd unter Nutzung der während der Reaktion entstehenden Wärme.
Ähnlich wie beim Hoechst-Verfahren konnte der Katalysator mit Salpetersäure regeneriert werden. Allerdings wurde die Produktion von Acetaldehyd nach dieser Methode bei Chisso Corp. vor über einem Jahrzehnt eingestellt.
2.3. Produktion über Vinylether
REPPE bei BASF führte ein Verfahren mit Vinylether ein, das vollständig auf den Einsatz giftiger Quecksilberverbindungen verzichtet. Methanol wurde bei 150–160 °C und 1600 kPa in Gegenwart von Kaliumhydroxid zu Acetylen gegeben, was zur Bildung von Methylvinylether führte. Anschließend wurde der Methylvinylether mit verdünnter Säure hydrolysiert.
2.4. Herstellung über Ethylidendiacetat
Die Zugabe von Essigsäure zu Acetylen in Gegenwart von Quecksilber(II)-Salzen ergab Ethylidendiacetat (CH3CH(OCOCH3)2). Diese Verbindung zerfiel bei 130–145 °C mit Hilfe saurer Katalysatoren wie ZnCl2 in Acetaldehyd und Essigsäureanhydrid.
Obwohl dieses Verfahren ursprünglich 1914 von der Societe Chimique des Usines du Rhone im industriellen Maßstab entwickelt wurde, hat es in jüngster Zeit an Bedeutung verloren.
3. Herstellung aus Ethylen
Ethylen ist zum Hauptrohstoff für die Acetaldehydproduktion geworden, wobei das Wacker-Verfahren die vorherrschende Methode zur Direktoxidation von Ethylen ist.
3.1. Direkte Oxidation von Ethylen
Das Wacker-Verfahren, das zwischen 1957 und 1959 von Wacker-Chemie und Hoechst entwickelt wurde, beinhaltet die folgende Reaktion:
CH4 + 0,5 O2 → CH3CHO ΔH= -244 kJ/mol
Es wird eine Katalysatorlösung verwendet, die PdCl2 und CuCl2 enthält. Es wurde festgestellt, dass die Reaktion zwischen Ethylen und wässrigem Palladiumchlorid nahezu quantitativ Acetaldehyd erzeugt:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
Beim Wacker-Hoechst-Verfahren wird metallisches Palladium durch CuCl2 reoxidiert und anschließend mit Sauerstoff regeneriert:
Pd+2CuCl2 → PdCl2 + 2CuCl
2CuCl + 0,5 O2 + 2HCl → 2CuCl2 + H2O
Daher wird für die Ethylenumwandlung nur eine geringe Menge PdCl2 benötigt und der geschwindigkeitsbestimmende Schritt ist die Reaktion von Ethylen mit Palladiumchlorid.
Der Prozess kann ein- oder zweistufig durchgeführt werden. Beim einstufigen Verfahren reagiert ein Ethylen-Sauerstoff-Gemisch mit der Katalysatorlösung. Es stellt sich ein stationärer Zustand ein, in dem die Acetaldehydbildung und die CuCl2-Reduktion mit der gleichen Geschwindigkeit erfolgen. Der Oxidationsgrad des Katalysators, ausgedrückt als Verhältnis von CCu2+/(CCu2+ + CCu+), bestimmt diesen stationären Zustand.
Beim zweistufigen Verfahren reagieren Ethylen und Sauerstoff getrennt voneinander in verschiedenen Reaktoren und die Katalysatorlösung wird abwechselnd reduziert und oxidiert. Für die Katalysatoroxidation wird typischerweise Luft anstelle von reinem Sauerstoff verwendet.
3.1.1. Einstufiger Prozess
Beim einstufigen Verfahren werden Ethylen und Sauerstoff in einen Reaktionsturm eingeleitet. Die Katalysatorlösung wird nach dem Airlift-Prinzip umgewälzt und mit dem Gas vermischt. Die Reaktion findet bei etwa 130 °C und 400 kPa statt.
Das resultierende Gemisch aus Acetaldehyd, Wasserdampf und nicht umgewandeltem Gas wird getrennt, gekühlt und gewaschen, um die Reaktionsprodukte abzutrennen.
Nicht umgewandeltes Gas wird in den Reaktor zurückgeführt, wobei ein kleiner Teil als Abgas abgeführt wird, um eine Ansammlung von Inertgas zu verhindern. Der beim Waschen erhaltene rohe Acetaldehyd wird dann in zwei Stufen destilliert, um gereinigten Acetaldehyd zu erhalten.
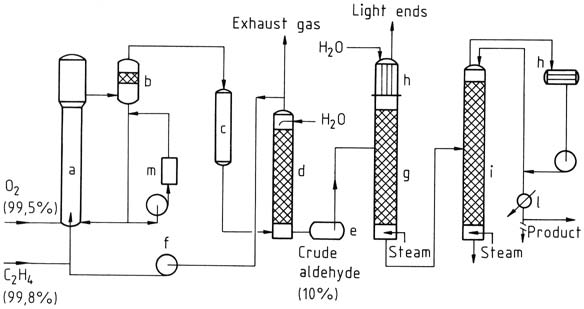
a) Reaktor; b) Trenngefäß; c) Kühler; d) Wäscher; e) Rohaldehydtank; f) Kreisgaskompressor; g) Leichtdestillation; h) Kondensatoren; i) Reinigungskolonne; l) Produktkühler; m) Regeneration
3.1.2. Zweistufiger Prozess
Beim zweistufigen Verfahren werden sowohl für die Reaktions- als auch für die Oxidationsschritte Rohrreaktoren eingesetzt. In Gegenwart des Katalysators reagieren die Gase nahezu vollständig. Ethylen reagiert bei niedrigeren Temperaturen und Drücken, und die Acetaldehyd enthaltende Katalysatorlösung wird dann in einem Entspannungsturm entspannt.
Das Acetaldehyd-Wasserdampf-Gemisch wird destilliert und der Katalysator für die Reaktion mit Ethylen zurückgeführt. Das Prozesswasser wird wiederverwendet, ein Teil dient der Abluft- und Gaswäsche zur Entfernung von Verunreinigungen. Der rohe Acetaldehyd wird einer zweistufigen Destillation unterzogen, um reinen Acetaldehyd zu erhalten.
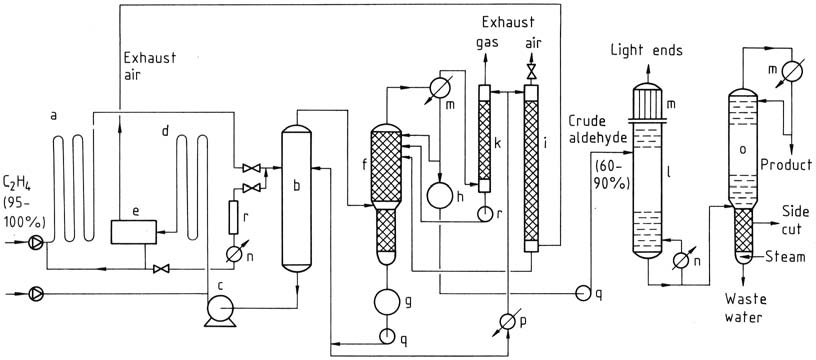
a) Reaktor; b) Blitzturm; c) Katalysatorpumpe; d) Oxidationsreaktor; e) Abluftabscheider; f) Rohaldehydsäule; g) Prozesswassertank; h) Rohaldehydbehälter; i) Abluftwäscher; k) Abgaswäscher; l) Leichtdestillation; m) Kondensatoren; n) Heizung; o) Reinigungssäule; p) Kühler; q) Pumpen; r) Regeneration
Sowohl das einstufige als auch das zweistufige Verfahren weisen eine ähnliche Acetaldehydausbeute von rund 95 % und vergleichbare Produktionskosten auf. Die Wahl zwischen den Methoden hängt von Faktoren wie der Rohstoffverfügbarkeit, Energieaspekten und den Sauerstoffkosten ab.
3.2. Bildung von Acetaldehyd als Nebenprodukt
Bei der Herstellung von Vinylacetat aus Ethylen oder Acetylen entsteht Acetaldehyd. Durch Destillation wird Acetaldehyd abgetrennt, der anschließend für Recyclingzwecke in Essigsäure umgewandelt wird.
In einer speziellen Variante des Verfahrens ausgehend von Ethylen werden sowohl Vinylacetat als auch Acetaldehyd in gleichen Molverhältnissen von 1:1 erhalten. Diese Eigenschaft macht das Verfahren hinsichtlich der Essigsäureproduktion nahezu autark.
3.3. Ethylenoxid-Isomerisierung
Bevor die direkte Oxidation von Ethylen zur bevorzugten Methode wurde, wurden umfangreiche Untersuchungen zu diesem Verfahren durchgeführt. Zum Einsatz kamen Katalysatoren wie Al2O3, SiO2 und saure Salze, die von Mineralsäuren wie Schwefelsäure, Phosphorsäure oder Molybdänsäure abgeleitet waren. Obwohl Ausbeuten von 90–95 % gemeldet wurden, hat dieser Ansatz keine nennenswerte industrielle Bedeutung erlangt.
4. Produktion aus C1-Quellen
Nach den Ölpreiserhöhungen in den Jahren 1973/74 und 1977 erregten C1-Materialien Interesse als Rohstoff für organische Chemikalien und als Alternativen zu Petrochemikalien. Im Hinblick auf die Acetaldehydproduktion scheinen C1-Materialien jedoch nur von begrenzter Bedeutung zu sein, da die meisten herkömmlichen Acetaldehydderivate aus C1-Quellen synthetisiert werden können.
4.1. Direkte Produktion aus Synthesegas
Acetaldehyd wird mit relativ geringer Selektivität gebildet und ergibt eine Ausbeute von etwa 30 % aus Synthesegas. Die resultierende Mischung enthält außerdem Essigsäure, Ethanol und gesättigte Kohlenwasserstoffe, hauptsächlich Methan.
Es werden Katalysatoren verwendet, die durch Jodverbindungen oder Magnesiumchlorid aktivierte Kobalt- und Rhodiumverbindungen auf einem Silikatträger umfassen. Bisher hat dieses Verfahren keine industrielle Anwendung gefunden.
4.2. Herstellung mittels Methanol, Methylacetat oder Essigsäureanhydrid
Die Hydroformylierung von Methanol mit CO/H2, das so genannte Oxo-Verfahren, ist gut etabliert. Diese Reaktion findet in Gegenwart von Hydroformylierungskatalysatoren wie Kobalt-, Nickel- und Eisensalzen (z. B. CoBr2, CoI2) oder den entsprechenden Metallcarbonylen statt.
Es wird bei erhöhten Temperaturen (180–200 °C) und hohem Druck (30–40 MPa) durchgeführt. Bei Verwendung von Eisen-Kobalt-Carbonyl- oder Kobalt-Nickel-Katalysatoren in Verbindung mit tertiären Aminen, Phosphinen oder Nitrilen wurde eine Acetaldehyd-Selektivität von 80 % oder mehr berichtet.
In ähnlicher Weise wurde eine hohe Selektivität für die Hydrocarbonylierung von Methylacetat unter Verwendung von Palladium- oder Rhodiumkatalysatoren, begleitet von tertiären Phosphinen und Iodverbindungen, oder Kobalt-Ruthenium-Katalysatoren in Gegenwart von Methyl- und Natriumiodiden beansprucht.
Bestimmte Patente beschreiben die Erzeugung von Acetaldehyd durch die Reduktion von Essigsäureanhydrid mit Wasserstoff über Palladium- oder Platinkatalysatoren auf einem Träger, die bei niedrigen Drücken und moderaten Temperaturen durchgeführt werden.
Sollte die Bedeutung von Acetaldehyd als organisches Zwischenprodukt in Zukunft abnehmen, könnte sich diese Methode als interessant für die wirtschaftliche Produktion kleiner Mengen Acetaldehyd erweisen.
5. Produktion aus Kohlenwasserstoffen
Acetaldehyd ist ein Nebenprodukt bei der Herstellung von Acrolein, Acrylsäure und Propenoxid aus Propen. Darüber hinaus entsteht es durch die Oxidation gesättigter Kohlenwasserstoffe (z. B. Propan oder Butan) in der Gasphase, wie sie von Celanese in den USA durchgeführt wird.
Referenz
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
