Gluconsäure: Eigenschaften, Reaktion, Herstellung und Verwendung
Was ist Gluconsäure?
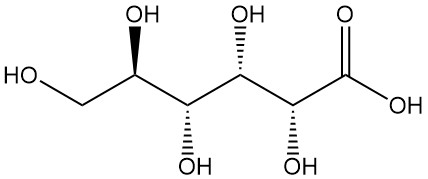
Gluconsäure, auch bekannt als 1,2,3,4,5-Pentahydroxypentan-1-carbonsäure, ist eine organische Säure mit der Formel C6H12O7. Sie ist ein weißes, geruchloses, kristallines Pulver, das natürlicherweise im Menschen und anderen Organismen sowie in Lebensmitteln wie Wein und Honig vorkommt.
Gluconsäure wurde erstmals in den 1870er Jahren von Hlasiwetz und Habermann bei der Oxidation von Glucose mit Chlor entdeckt und in Form ihrer Barium- und Calciumsalze isoliert.
Später fanden Forscher heraus, dass Gluconsäure durch Behandlung verschiedener Mono-, Di- und Polysaccharide mit Oxidationsmitteln wie elementarem Halogen, Kupfer(II)- oder Hexacyanoferrat(III)-Salzen oder Quecksilber(II)-oxid hergestellt werden kann.
Die Nebenprodukte dieser Reaktionen hängen von der Art des Zuckers und dem verwendeten Oxidationsmittel ab, können aber Ameisensäure, Glykolsäure, Oxalsäure und Kohlendioxid umfassen.
In den 1880er Jahren entdeckte Butroux, dass Gluconsäure zusammen mit Essigsäure durch die oxidative Wirkung von Acetobacter aceti auf Glucose entsteht, was auch für andere Bakterien charakteristisch ist.
Molliard war der erste, der das Vorkommen von Gluconsäure in Kulturen von Aspergillus niger, früher bekannt als Sterigmatocystis nigra, feststellte. Die heute bevorzugte Methode zur Herstellung von Gluconsäure und ihren Derivaten beruht auf der Arbeit mehrerer Forscher auf Aspergillus-Stämmen.
Die anodische Oxidation wurde in den 1930er Jahren als Methode zur Herstellung von Calciumgluconat vorgeschlagen, später folgten Studien zur katalytischen Oxidation von Glucose mit Luft oder Sauerstoff.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Gluconsäure
Die Kristallisation von D-Gluconsäure in ihrer freien Form ist schwierig und einigen Studien zufolge ist die Kristallisation der wasserfreien Substanz nur unter 30 °C und die des Monohydrats bei 0–3 °C möglich.
Die Molekülmasse von Gluconsäure beträgt 196,16 g/mol.
Die wasserfreie Form von Gluconsäure ist ein weißes, geruchloses, kristallines Pulver mit einem Schmelzpunkt von 120 bis 131 °C aufgrund der Bildung intramolekularer Anhydride und einer spezifischen Drehung von [α]D20 = -6,7° und [α]D25 = -5,4°.
Es ist gut wasserlöslich, wenig löslich in Ethanol und unlöslich in unpolaren Lösungsmitteln. Die handelsübliche 50%ige wässrige Gluconsäurelösung hat einen pH-Wert von 1,82 und eine Dichte von 1,23 g/cm3.
D-Gluconsäure bildet bei Lagerung über Trockenmittel bei Raumtemperatur oder Erhitzen über 50 °C Lactone und unterliegt bei über 200 °C einer Pyrolyse.
Es existiert im Gleichgewicht mit zwei Lactonen (1,5-Lacton (1) und 1,4-Lacton (2)) in wässriger Lösung und im festen Zustand. Die freie Säure hat eine Dissoziationskonstante (KA) von 1,99 x 10-4 und einen pKa von 3,70.
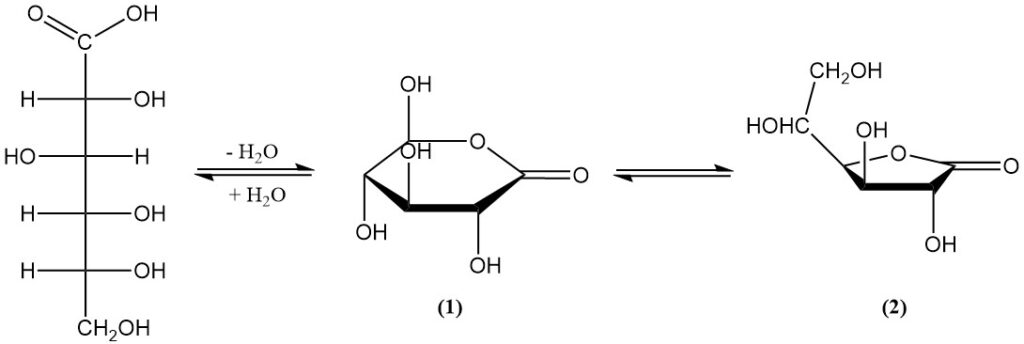
1,5-Lacton (1) ist ein weißer, kristalliner Feststoff mit einer schwachen Süße, einem Schmelzpunkt von 153 °C und einer spezifischen Drehung: [α]D20 = +66,2°. Es ist in Wasser sehr gut löslich (und seine Löslichkeit nimmt mit der Temperatur zu) und in einigen organischen Lösungsmitteln leicht löslich.
1,4-Lacton (2) erscheint als feine Nadeln mit einem Schmelzpunkt von 134–136 °C und einer spezifischen Drehung: [α]D20 = +67,8°. Es ist in den meisten Lösungsmitteln schlecht löslich.
2. Chemische Reaktionen von Gluconsäure
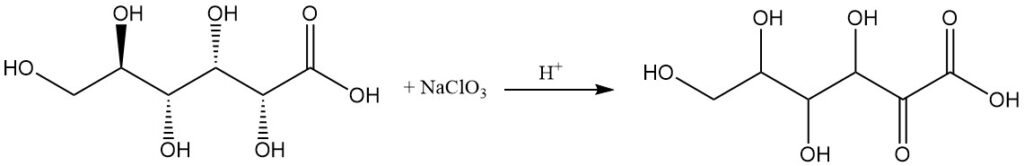
Die Oxidation von Gluconsäurelactonen oder Calciumsalzen mit milden Oxidationsmitteln wie Salpetersäure oder Wasserstoffperoxid führt zu einer Mischung von Oxogluconsäuren, hauptsächlich mit Ketongruppen an den Positionen 2 und 5.
Anodische Oxidation, Oxidation mit Natriumchlorat in einer sauren Lösung oder Fermentation durch bestimmte Bakterien wie Acetobacter-Arten können 2-Oxo-D-Gluconsäure als Hauptprodukt erzeugen.
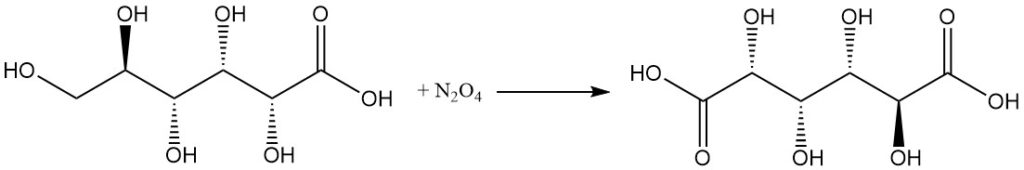
Die Reaktion mit konzentrierter Salpetersäure oder N2O4 wandelt Gluconsäure in Glucarsäure um.
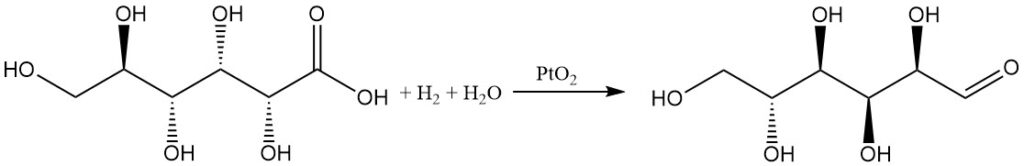
Die Hydrierung von Gluconsäure in Wasser mit einem Platinoxidkatalysator ergibt D-Glucose in mäßiger Ausbeute, während 1,5-Lacton eine hohe Ausbeute ergibt.
Durch Rückfluss von Gluconsäure mit konzentrierter Iodwasserstoffsäure und rotem Phosphor entsteht Hexansäure.
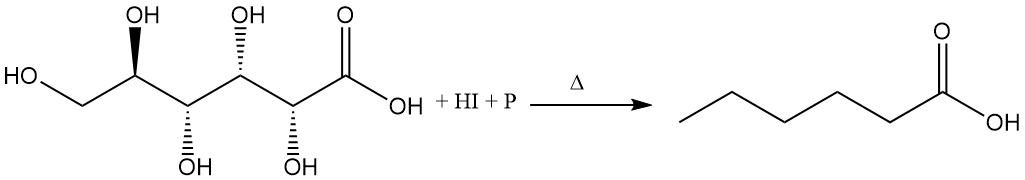
Funktionelle Gruppen der Gluconsäure können theoretisch mit verschiedenen Reagenzien (Alkoholen, Säuren usw.) reagieren; für stabile Derivate ist jedoch eine vollständige Reaktion erforderlich. Teilreaktionen erzeugen instabile, hydrolyseanfällige Gemische und haben nur einen begrenzten praktischen Wert.
Gluconsäure und ihre Alkalisalze sind aufgrund ihrer Fähigkeit, stabile Komplexe mit mehrwertigen Kationen zu bilden, wertvoll. Beispiele hierfür sind Gluconatsalze von Calcium, Kupfer, Eisen und Mangan.
Kernspinresonanzstudien legen nahe, dass sowohl Carboxyl- als auch Hydroxylgruppen an der Komplexbildung mit diesen Kationen beteiligt sind.
3. Herstellung von Gluconsäure
D-Gluconsäure wird industriell durch die Oxidation von Glucose oder glucosereichen Rohstoffen hergestellt. Der Oxidationsprozess kann chemisch, elektrolytisch, katalytisch oder biochemisch sein.
3.1. Herstellung von Gluconsäure durch chemische Oxidation von Glucose
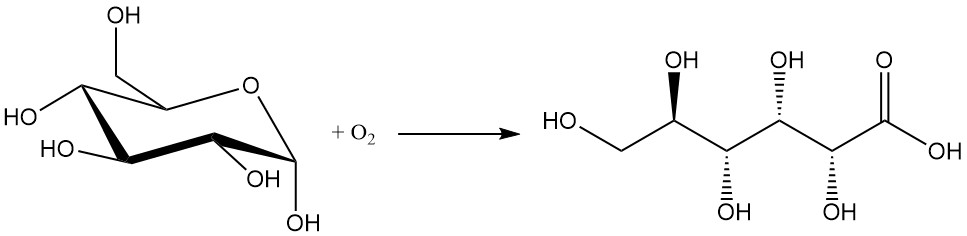
Die chemische Oxidation von Glucose ist aufgrund der geringen Ausbeute (zwischen 60 und 80 %) und der Bildung unerwünschter Nebenprodukte die am wenigsten bevorzugte Methode. Die Isolierung und Reinigung des gewünschten Produkts ist schwierig.
Zu den in diesem Verfahren verwendeten Oxidationsmitteln gehören häufig Wasserstoffperoxid, Ozon und Sauerstoff.
3.2. Herstellung von Gluconsäure durch elektrochemische Oxidation von Glucose
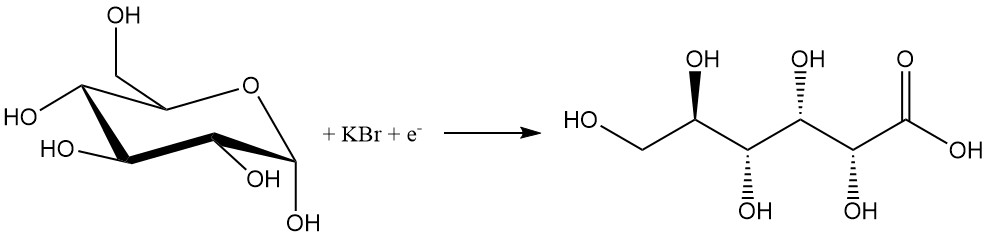
Ähnlich wie chemische Verfahren weist der elektrochemische Prozess aufgrund der Verwendung von Halogenen eine geringe Selektivität auf.
Eine Glukoselösung mit 10 % Bromid wird bei einer Stromdichte von 1–20 A/dm2 elektrolysiert, um 80–97 % Gluconsäure zu erzeugen. Basen wie Calciumcarbonat oder Hydroxide werden hinzugefügt, um die entstehende
Säure zu neutralisieren.
Die hohen Stromkosten machen diese Methode weniger wettbewerbsfähig.
3.3. Herstellung von Gluconsäure durch katalytische Oxidation von Glucose
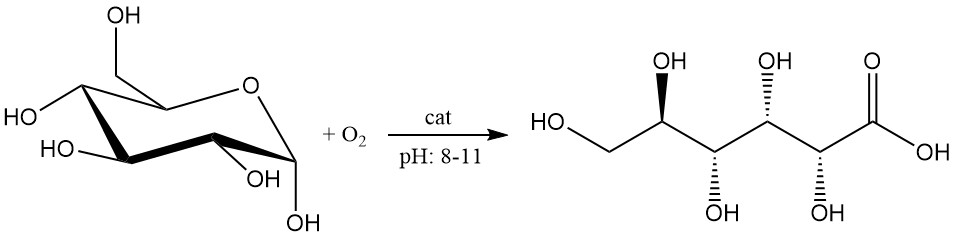
Die katalytische Oxidation von Glucose hat in jüngster Zeit Fortschritte gemacht und gilt als vielversprechend für die Produktion im industriellen Maßstab.
Die Glucoselösung mit einer Konzentration von 1 – 2 mol/l wird bei einem pH-Wert zwischen 8 und 11 durch Sauerstoff oder Luft oxidiert.
Ursprünglich wurden Platingruppenmetalle auf Trägern wie Aktivkohle und Aluminiumoxid als Katalysatoren verwendet. Bei der Verwendung dieses Katalysatortyps sind jedoch einige Herausforderungen aufgetreten, darunter die Katalysatordeaktivierung, die Notwendigkeit reiner Glucose und die Bildung von Nebenprodukten.
Die Dotierung dieser Katalysatoren mit Elementen wie Blei, Selen oder Wismut verbessert Aktivität und Selektivität, und Aktivkohle ist der bevorzugte Träger für diese Katalysatoren.
Durch die Verwendung dieser Katalysatoren zur Oxidation einer 2 M Glucoselösung zu Gluconsäure mit Sauerstoff bei 50 °C und einem pH-Wert von 9,5 wurden hohe Ausbeuten (> 99,5 %) und Reinheit (> 99,5 %) bei minimalem Reinigungsaufwand erzielt.
Diese Katalysatoren sind außerdem wiederverwendbar, mit minimalem Aktivitätsverlust.
Die Wirtschaftlichkeit dieser Methode hängt stark von den Kosten, der Aktivität, Selektivität und Lebensdauer des Katalysators sowie von der Produktreinigung und dem Energiebedarf ab.
Entgegen früheren Vorschlägen ist die photochemische Oxidation von Glucose zu Gluconsäure nicht rentabel.
3.4. Herstellung von Gluconsäure durch Fermentation
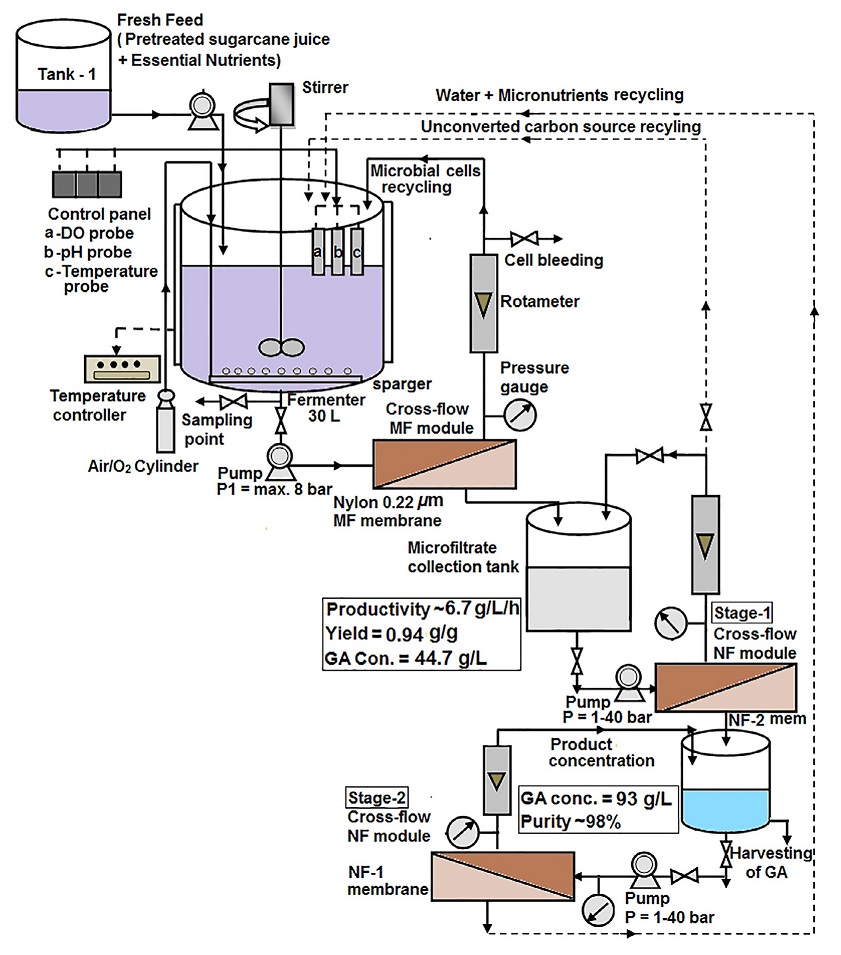
D-Gluconsäure wird kommerziell durch biologische Fermentation unter Verwendung von zwei Hauptorganismen hergestellt: Aspergillus niger und Gluconobacter suboxydans.
3.4.1. Aspergillus niger-Verfahren
Glucose wird in den Pilzzellen durch das Enzym Glucoseoxidase zu Gluconsäure oxidiert. Dieses Enzym verwendet Flavinadenindinukleotid als Cofaktor und produziert letztendlich Wasserstoffperoxid. Katalase, ein weiteres im Pilz vorhandenes Enzym, zerlegt das Wasserstoffperoxid in Wasser und Sauerstoff.
Die gebildete Gluconsäure kann im Gleichgewicht mit ihrer Lactonform existieren. Der optimale pH-Wert für dieses Verfahren liegt bei etwa 5,6.
Bei der Produktion im großen Maßstab wird eine sterilisierte Nährbrühe fermentiert, die Glucose, Magnesiumsulfat, Kaliumphosphat und eine Stickstoffquelle enthält. Die Brühe wird mit einer Kultur von Aspergillus niger beimpft.
Während der Fermentation steigt die Aktivität der Glucoseoxidase schnell an, was zu einem entsprechenden Anstieg der Gluconsäureproduktion führt. Der Prozess dauert normalerweise 40–100 Stunden, und für eine effiziente Ausbeute sind eine gute Sauerstoffversorgung und eine angemessene pH-Kontrolle wichtig.
Nach der Fermentation wird die Pilzbiomasse durch Filtration entfernt und die Gluconsäurelösung durch verschiedene Schritte wie Entfärbung und Filtration gereinigt. Je nach gewünschtem Endprodukt kann die Lösung kristallisiert werden, um Gluconsäure zu erhalten, oder sprühgetrocknet werden, um eine konzentrierte Lösung zu erhalten.
3.4.2. Gluconobacter suboxydans-Prozess
Dieser Prozess verwendet zwei Glucose-Dehydrogenase-Enzyme zur Umwandlung von Glucose in Gluconsäure. Im Gegensatz zur Aspergillus niger-Methode erfordert Gluconobacter suboxydans aufgrund seiner höheren Sauerstoffaffinität weniger Belüftung.
Darüber hinaus verträgt dieser Organismus saurere Bedingungen, wodurch freie Gluconsäure direkt aus der Fermentationsbrühe isoliert werden kann.
3.4.3. Andere Methoden und Weiterverarbeitung
Obwohl sie noch nicht kommerziell rentabel sind, werden einige Verfahren mit acidophilen methylotropen Bakterien wie Acetobacter methanolicus zur direkten Gluconsäureproduktion untersucht. Es wird auch an der Verwendung immobilisierter Enzyme oder Mikroorganismen für diesen Zweck geforscht.
Die Rückgewinnung freier Gluconsäure aus Fermentationsbrühen, die Natriumgluconat (das Natriumsalz der Gluconsäure) enthalten, kann durch Techniken wie Kationenaustausch oder Elektrodialyse erreicht werden.
Die Kristallisation aus einer übersättigten Lösung ist die primäre Methode zur Gewinnung reiner Gluconsäure in ihrer Lactonform. Die Dehydratation mit bestimmten Alkoholen, gefolgt von Kristallisation, ist eine weitere Methode zur Lactonproduktion.
4. Verwendung von Gluconsäure
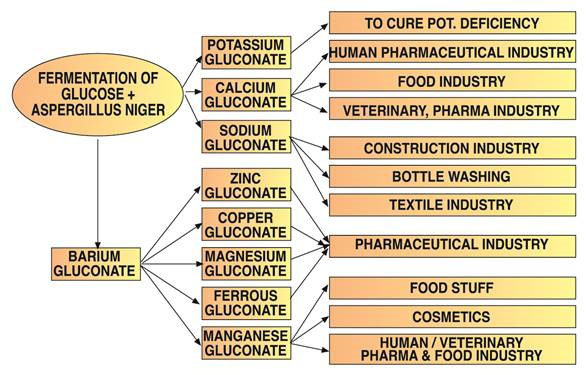
Gluconsäure wird für Reinigungsanwendungen verwendet, da sie Metalloxide, Hydroxide und Carbonate auflösen kann und mit diesen Kationen wasserlösliche Komplexe bildet.
Gluconsäure wird verwendet, um Kalk- und Rostablagerungen von verschiedenen Metallen zu entfernen, darunter verzinktes Eisen, Magnesiumlegierungen und Edelstahl. Sie wird zum Entfernen von Bier- und Milchstein von diesen Oberflächen eingesetzt.
In Verbindung mit Magnesiumsalzen wirkt Gluconsäure als Stabilisator für Peroxidbleichbäder in der Textilindustrie.
Aufgrund ihrer physiologischen Eigenschaften eignet sich D-Gluconsäure für Lebensmittel- und Getränkeanwendungen. Niedrige Konzentrationen (0,02–0,1 %) invertieren Saccharose effektiv ohne weitere Fructosereaktionen.
Spurenelemente werden aufgrund ihrer hohen Bioverfügbarkeit und Verträglichkeit häufig als Gluconatsalze verabreicht. Kaliumgluconat, das in wasserfreier oder Monohydratform erhältlich ist, hat spezielle pharmazeutische Anwendungen.
Gluconsäure-1,5-lacton ist in vielen Beispielen ein praktischer Ersatz für die freie Säure. Es bietet Vorteile in sauren Umgebungen, wie zum Beispiel beim Einlegen von Lebensmitteln, Pökeln von Wurst und Aufgehen von Backwaren.
Natriumgluconat ist das am häufigsten vorkommende Gluconatsalz. Es bildet Komplexe mit Metallkationen, wobei die Stabilität bei höherem pH-Wert zunimmt. Es reinigt effektiv verschiedene Oberflächen und entfernt Fett, Korrosion, Rost und Oxidschichten von Aluminium, Stahl, Kupfer und deren Legierungen.
Heiße (95–100 °C) alkalische Natriumgluconatlösungen entfernen effizient Farbe und Lack, ohne die darunter liegenden Oberflächen zu beschädigen.
Gluconatlösungen werden zur Vorbehandlung von Oberflächen für das Nickel-Kobalt-Löten auf Aluminium und zur Vorbereitung glatter, glänzender galvanisierter Nickel-, Zinn- und Zinkoberflächen verwendet. In einigen Anwendungen ersetzt es zunehmend das giftige Cyanidion.
Natriumgluconat, manchmal in Kombination mit Polyphosphaten, wird in der Papierindustrie als Schlichtemittel verwendet, das Papier säurebeständig macht. In der Textilindustrie hilft es beim Entschlichten von Polyester- oder Polyamidgeweben und beim Veredeln natürlicher Zellulosefasern.
Die Stabilität von Natriumgluconat bei hohen Temperaturen und pH-Werten sowie seine Fähigkeit, wasserhärtende Mittel zu binden, machen es zu einem nützlichen Bestandteil handelsüblicher Reiniger. Es wird zum Flaschenwaschen und Reinigen von Aluminiumoberflächen verwendet.
Betonhersteller verwenden Natriumgluconat als hochwirksames Aushärtungsverzögerungsmittel. Es verbessert die Betonhomogenität, Wasserbeständigkeit, Frostbeständigkeit und Verarbeitbarkeit und reduziert gleichzeitig Rissbildung.
Ein wesentlicher Vorteil von Gluconsäure, ihrem Lacton und ihren Salzen ist ihre biologische Abbaubarkeit in Abwasseraufbereitungssystemen. Dies gilt auch für ihre Metallkomplexe mit Aluminium, Kupfer, Eisen und Zink. Sogar Chromgluconatkomplexe werden biologisch abgebaut, wenn auch langsamer.
Freigesetzte Metallionen werden während der Abwasserreinigung entfernt, wodurch die potenzielle Mobilisierung von Schwermetallen verringert wird. Biologischer Abbau und Hydroxidfällung (bei pH 9–10) tragen zur Zerstörung von Schwermetallgluconatkomplexen im Abwasser bei.
Referenzen
- Gluconic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a12_449
- S. Banerjee et al., Fermentative production of gluconic acid: A membrane-integrated Green process, Journal of the Taiwan Institute of Chemical Engineers (2018), https://doi.org/10.1016/j.jtice.2018.01.030
