Cumarin: Eigenschaften, Reaktionen, Produktion, Verwendung und Toxikologie

Was ist Cumarin?
Cumarin, auch bekannt als 2H-1-Benzopyran-2-on oder 1,2-Benzopyron, ist ein natürliches aromatisches Lacton mit der chemischen Formel C9H6O2. Es ist ein farbloser kristalliner Feststoff mit einem bittersüßen Geruch wie Heu und wird als Fixiermittel in Parfüms verwendet.
Vogel isolierte Cumarin erstmals 1820 aus Tonkabohnen (Dipteryx odorata), und 1868 synthetisierte William Perkin es mithilfe der Perkin-Reaktion.
Cumarin ist im Pflanzenreich weit verbreitet; es kommt in Steinklee, Waldmeister, Kassia, Steinklee, Lavendel, Perubalsam und anderen Pflanzen in einer Konzentration von 87.000 ppm bis 5 ppb vor.
Cumarin wurde früher insbesondere in Verbindung mit Vanillin als Aromastoff für Lebensmittel verwendet, seine Verwendung in der Lebensmittelindustrie wurde in den USA jedoch bereits 1954 verboten.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cumarin
Cumarin erscheint bei Raumtemperatur als farblose, glänzende Blättchen oder rhombische Kristalle mit einem angenehmen, süßen Vanillegeruch und einem bitteren, aromatischen, brennenden Geschmack. Es ist sehr gut löslich in Chloroform und Pyridin, löslich in Ethanol und Ether und leicht löslich in Wasser.
Die physikalischen Eigenschaften von Cumarin sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [91-64-5] |
| Chemische Formel | C9H6O2 |
| Molekulargewicht | 146,14 g/mol |
| Schmelzpunkt | 68-70 °C |
| Siedepunkt | 301 °C bei 100 kPa 170,4 °C bei 2,7 kPa 138,5 °C bei 0,7 kPa |
| Dichte | 0,94 g/cm3 bei 25 °C 1,178 g/cm3 bei 100 °C |
| Dampfdruck | 0,13 kPa bei 106 °C |
| Flammpunkt | 150 °C |
| Löslichkeit in Wasser | 0,25 g/100 g Wasser bei 25 °C 2 g/100 g Wasser bei 100 °C |
2. Chemische Reaktionen von Cumarin
Cumarin unterliegt typischen Reaktionen des Lactons einer α,β-ungesättigten aromatischen Säure.
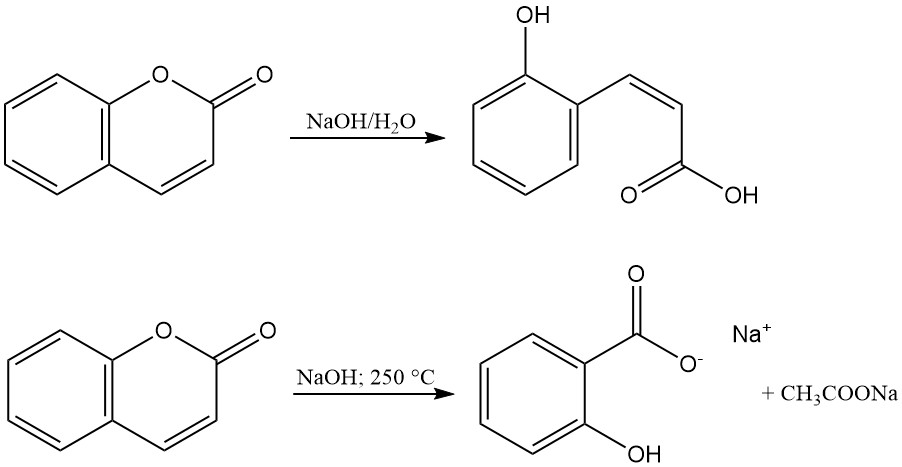
Der Lactonring von Cumarin wird mit Alkalien hydrolysiert, um Salze der Cumarinsäure oder o-Hydroxy-cis-Zimtsäure zu erzeugen. Diese Salze sind geruchlos und werden durch Ansäuern wieder zu Cumarin. Die Reaktion von Cumarin mit geschmolzenem Natriumhydroxid bildet Natriumsalicylat und Natriumacetat.
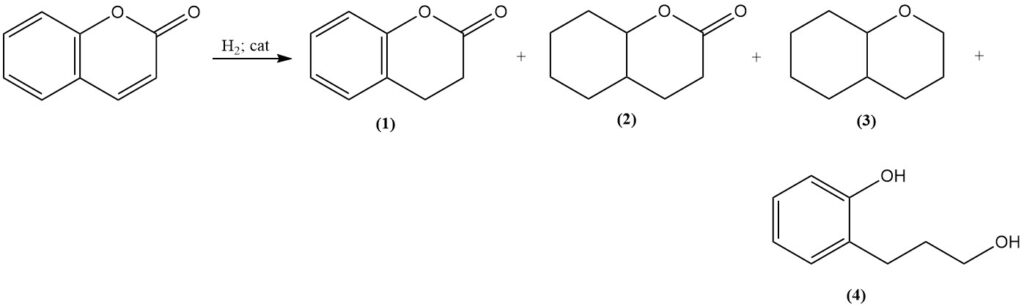
Bei der katalytischen Hydrierung von Cumarin entstehen je nach Reaktionsbedingungen unterschiedliche Produkte. Unter moderaten Bedingungen mit Raney-Nickel-Katalysator entsteht 3,4-Dihydrocumarin (1); bei erhöhter Temperatur und erhöhtem Druck entstehen jedoch Octahydrocumarin (2), Hexahydrochroman (3) und Polymerisationsprodukte.
Eine selektive Hydrierung zu 3,4-Dihydrocumarin (1) kann mit einem Platinsulfid-Katalysator erreicht werden, und die Hydrierung bei erhöhten Temperaturen mit einem Kupferchromit-Katalysator ergibt 3-(o-Hydroxyphenyl)-1-propanol (4) mit sehr guter Ausbeute.
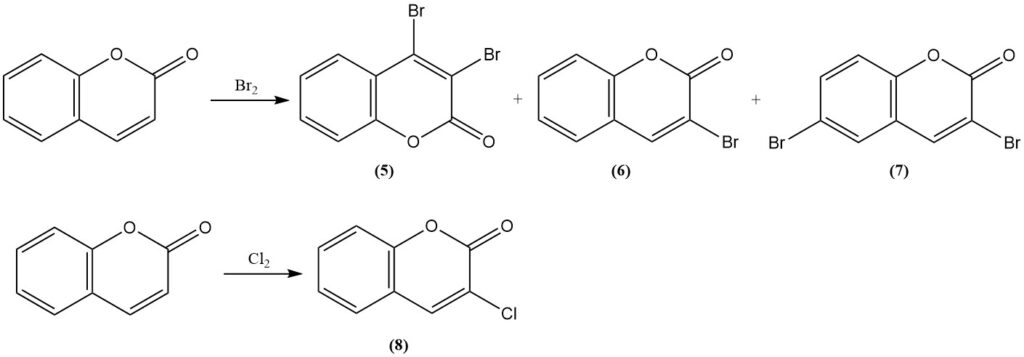
Die Reaktion von Cumarin mit Brom führt unter milden Bedingungen zu 3,4-Dibromcumarin (5). Unter schärferen Bedingungen erhält man 3-Bromcumarin (6) und 3,6-Dibromcumarin (7). Die Reaktion mit Chlor ergibt 3-Chlorcumarin (8).
Die Reduktion von Cumarin mit Lithiumaluminiumhydrid erzeugt o-Hydroxyzimtalkohol.
O-Allylphenol wird durch die Reaktion von Cumarin mit Diboran hergestellt.
Cumarin bildet mit Natriumbisulfit lösliche Natriumhydrogensulfonate, die bei Ansäuerung Cumarin regenerieren können. Diese Technik wird zur Reinigung von Rohcumarin verwendet.
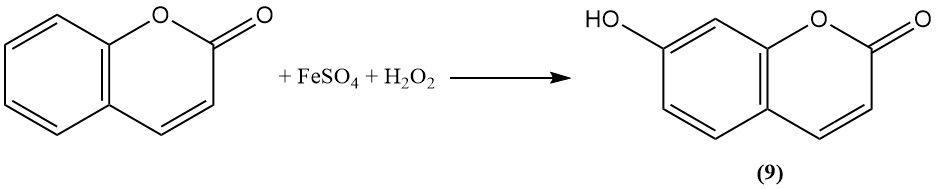
Durch Oxidation mit Fentons Reagenz wird Cumarin in Umbelliferon (7-Hydroxycumarin) umgewandelt (9).
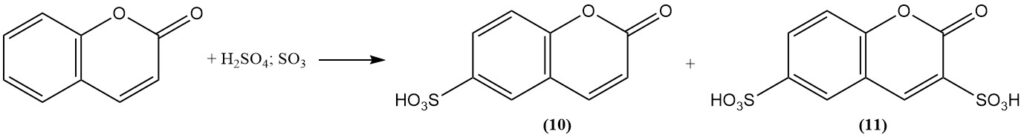
Bei der Sulfonierung von Cumarin mit rauchender Schwefelsäure entsteht bei mittleren Temperaturen Cumarin-6-sulfonsäure (10) und bei höheren Temperaturen Cumarin-3,6-disulfonsäure (11).
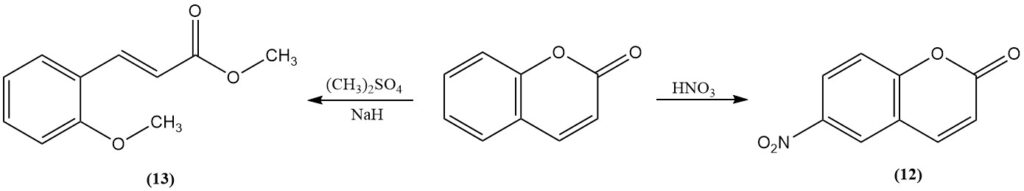
Durch Nitrierung mit rauchender Salpetersäure erhält man 6-Nitrocumarin (12). Durch Methylierung von Cumarin mit Methylsulfat oder Methyliod in Gegenwart von Natriumhydrid entsteht Methyl-2-methoxycinnamat (13). Bortrifluorid katalysiert die Photodimerisierung von Cumarin.
Cumarin kann andere aromatische elektrophile Substitutionen wie Halogenierung, Alkylierung und Acylierung durchlaufen.
3. Herstellung von Cumarin
Bis in die späten 1980er Jahre wurde Cumarin ausschließlich aus natürlichen Quellen durch Extraktion aus Tonkabohnen und Hirschzunge gewonnen. Heute wird es chemisch unter Verwendung von o-Kresol, Phenol und Salicylaldehyd als Ausgangsstoffe hergestellt. Für die Cumarinsynthese aus jedem dieser Rohstoffe gibt es eine Vielzahl synthetischer Wege.
3.1. Herstellung von Cumarin aus o-Kresol
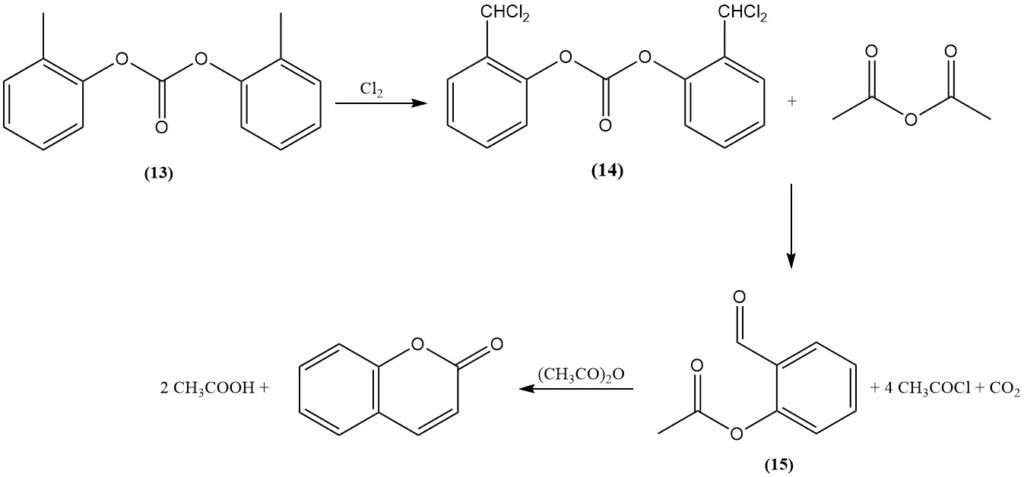
Das 1909 entdeckte Raschig-Verfahren ist ein primärer Syntheseweg für Cumarin aus o-Kresol. Zunächst wird die phenolische Hydroxylgruppe von o-Kresol durch Veresterung mit Phosphat oder vorzugsweise Carbonat geschützt (13). Anschließend wird die Methylgruppe durch Dichlorierung in ein Benzalchlorid-Zwischenprodukt (14) umgewandelt.
Der resultierende α,α-Dichlorkresylester wird dann entweder mit einem Alkaliacetat in einem geschmolzenen Hydroxid oder mit Essigsäureanhydrid unter Katalyse durch ein Metalloxid, wie etwa Kobaltoxid, umgesetzt, um o-Acetylsalicylaldehyd (15), Acetylchlorid und Kohlendioxid zu bilden.
Schließlich entstehen durch die Cyclisierung von o-Acetylsalicylaldehyd mit Essigsäureanhydrid Cumarin und Essigsäure.
3.2. Herstellung von Cumarin aus Phenol
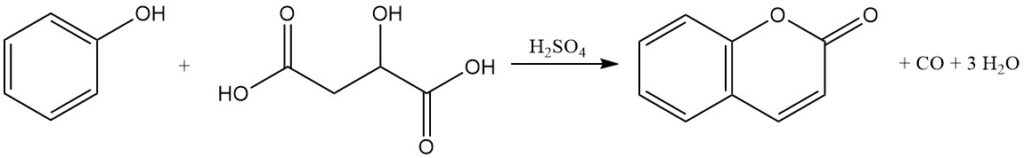
Die 1883 entdeckte Pechmann-Kondensation stellt eine grundlegende Methode zur Herstellung von Cumarin aus Phenol dar. Bei diesem Verfahren wird Cumarin durch die Reaktion von Phenol mit Äpfelsäure, Maleinsäure oder Fumarsäure in Gegenwart konzentrierter Schwefelsäure hergestellt.
Die Pechmann-Reaktion wird häufig bei der Synthese zahlreicher Cumarin-Derivate verwendet. So entsteht beispielsweise durch die Kondensation von Phenol mit Ethylacetessigester 4-Methylcumarin. Darüber hinaus kann Phenol mit Diketen zu Cumarin reagieren.
Phenol reagiert mit bestimmten Acrylsäurederivaten zu Cumarin.
Cumarin entsteht auch durch die Reaktion von Phenol mit 3-Ethoxyacrylsäurechlorid zu Phenylethoxyacrylat, gefolgt von einer Cyclisierungsreaktion mit Schwefelsäure. Darüber hinaus wird Cumarin durch die Reaktion von Phenol mit Methylacrylat in einem sauren Medium in Gegenwart von Luft synthetisiert.
3.3. Herstellung von Cumarin aus Salicylaldehyd
Perkin-Reaktion
Die Perkin-Reaktion, die erstmals 1868 von Perkin entdeckt wurde, stellt eine klassische Methode zur Cumarin-Synthese aus Salicylaldehyd dar. Bei diesem Verfahren wird Salicylaldehyd mit Essigsäureanhydrid in Gegenwart von Natriumacetat als Katalysator reagiert. Die Reaktion verläuft über die Bildung von cis-o-Acetoxyzimtsäure (16) als Zwischenprodukt.
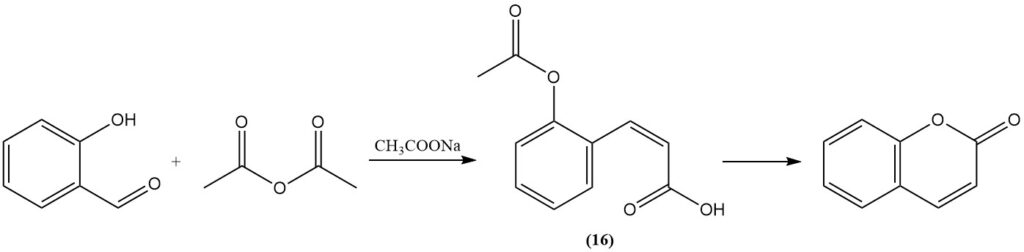
Die Perkin-Reaktion ist industriell wichtig, weshalb sie umfassend untersucht und modifiziert wurde, um ihre Effizienz zu verbessern. Diese Modifikationen umfassen die Zugabe von Jod, Metalloxiden oder Salzen, die Zugabe von Pyridin oder Piperidin als Katalysatoren, den Ersatz von Natriumacetat durch Kaliumcarbonat oder Cäsiumacetat und die Verwendung von Alkalimetallbiacetat.
Knoevenagel-Reaktion
Die Knoevenagel-Kondensation ist eine Reaktion zur Synthese von 3-substituierten Cumarinen aus Salicylaldehyd. Dabei handelt es sich um die Kondensation von Salicylaldehyd mit aktiven Methylenverbindungen wie Acetessigsäure, Malonsäure oder Cyanessigsäure in Gegenwart eines organischen Basenkatalysators wie Ammoniak, Pyridin und primären und sekundären Aminen.
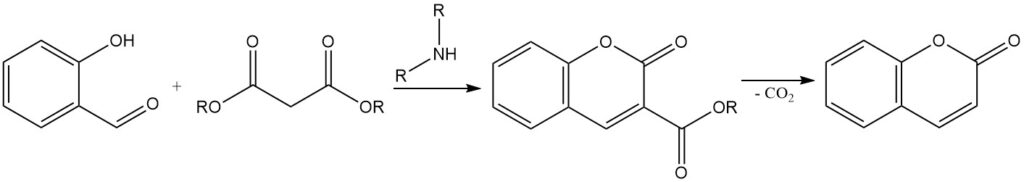
Das resultierende 3-substituierte Cumarin kann durch Entfernen der Substituentengruppe in Cumarin umgewandelt werden. Beispielsweise kann Cumarin-3-carbonsäure, die aus der Kondensation von Salicylaldehyd mit Malonsäure gewonnen wird, durch Erhitzen auf 290 °C decarboxyliert werden, um Cumarin zu bilden.
Eine milde Decarboxylierungsreaktion mit besserer Ausbeute kann durch Verwendung von Quecksilbersalzen erreicht werden.
3.4. Andere Methoden
Alternative synthetische Wege zu Cumarin umfassen die Cyclodehydrierung von Oxocyclohexanpropionat und die Dehydrierung durch elementaren Schwefel oder Dampfphasenkatalyse mit Metalloxiden von 3,4-Dihydrocumarin, das aus der Baeyer-Villiger-Oxidation von 1-Indanon gewonnen wird.
3.5. Reinigung von Cumarin
Synthetisches Cumarin muss eine hohe Reinheit aufweisen, um für Parfüm verwendet werden zu können. Herkömmliche Reinigungsverfahren umfassen fraktionierte Destillation unter reduziertem Druck und Kristallisation aus Lösungsmitteln wie Methanol oder Ethanol.
Zusätzliche Behandlungen vor dem Destillationsprozess umfassen die folgenden Schritte: Erhitzen des Rohcumarins mit konzentrierter Schwefelsäure, Neutralisieren und Waschen mit Wasser; Auflösen des gewaschenen Produkts in konzentrierter Schwefelsäure, gefolgt von Oxidation; und Rückflusskochen mit wässrigem Natriumhydroxid mit anschließender Trennung der organischen Phase und Waschen.
Eine alternative Reinigungsverfahren ist die Vakuum-azeotropdestillation mit Polyhydroxyalkoholen wie Triethylenglykol. Zonenschmelzverfahren wurden ebenfalls zur Cumarinreinigung beschrieben.
4. Verwendung von Cumarin
Aufgrund seines charakteristischen süßen Aromas und seiner Stabilität wird Cumarin als Duftstoff in Parfüms, Seifen, Reinigungsmitteln und Lotionen in Konzentrationen von 0,01 bis 2,4 % verwendet.
Cumarin wird häufig mit Kräuterdüften kombiniert und ist ein wesentlicher Bestandteil der Komposition von Fougère- und Chypre-Duftarten. Es wird als Fixiermittel verwendet, um die Haltbarkeit natürlicher ätherischer Öle wie Lavendel, Zitrus, Rosmarin und Eichenmoos zu verlängern.
Außerhalb der Parfümerie verleiht Cumarin Haushaltsprodukten und Industriegütern ein angenehmes Aroma und überdeckt gleichzeitig unangenehme Gerüche.
Es wird auch als Medium in Laserfarbstoffen und als Sensibilisator in älteren Photovoltaiktechnologien verwendet.
Cumarin und seine Derivate wurden auf mögliche therapeutische Anwendungen untersucht, darunter die Behandlung von Schizophrenie, Mikrozirkulationsstörungen, angiopathischen Geschwüren, hocheiweißhaltigen Ödemen und Krebs.
Es wird als Medikament zur Behandlung hocheiweißhaltiger Lymphödeme und zur Verbesserung der Venendurchblutung eingesetzt und wurde in klinischen Studien als antineoplastisches Mittel getestet.
Cumarin hat sich als aktiv bei der Pigmentierung und der Verlangsamung des Haarausfalls erwiesen. Ein Cumarin-Derivat wurde bei der Polarisation von lichtemittierenden Kristallen eingesetzt.
Heute ist die Verwendung von Cumarin als direkter Lebensmittelzusatz verboten; es wird jedoch als Tabakaroma verwendet und kommt auch in der Galvanikindustrie zum Einsatz.
Es ist wichtig zu erwähnen, dass Cumarin-Derivate wie Warfarin zwar starke Antikoagulanzien sind, Cumarin selbst jedoch kein Antikoagulans ist.
5. Toxikologie von Cumarin
Cumarin birgt erhebliche Gesundheitsrisiken. Verschlucken, Einatmen und Augenkontakt sind gefährlich, während Hautkontakt weniger schwerwiegend ist. Akute Überbelastung kann tödlich sein. Cumarin zeigt eine mäßige Toxizität für Leber und Nieren mit einer mittleren tödlichen Dosis von 275 mg/kg. Die Lebertoxizität ist bei Ratten ausgeprägter als bei Mäusen.
Toxikologische Daten (LD50) für Cumarin sind:
- 293 mg/kg (Ratte)
- 196 mg/kg (Maus)
- 202 mg/kg (Meerschweinchen)
Cassia-Rinde, eine Zimtsorte, enthält hohe Mengen an Cumarin. Der Verzehr übermäßiger Mengen von Cassia-Rinde kann aufgrund ihres hohen Cumarin-Gehalts schädlich sein.
Die US-amerikanische Food and Drug Administration hat die direkte Zugabe von Cumarin zu Lebensmitteln verboten. Dennoch sind natürliche Zusatzstoffe, die Cumarin enthalten, wie Waldmeister, unter bestimmten Vorschriften in alkoholischen Getränken erlaubt.
5.1. Expositionswege
Menschen kommen hauptsächlich durch Hautkontakt mit Parfüms und Produkten, die Cumarin-Duftstoffe enthalten, mit Cumarin in Kontakt. Die Haut absorbiert Cumarin leicht, was es zu einem wichtigen Verabreichungsweg für therapeutische Anwendungen wie die Behandlung von Lymphödemen macht.
Darüber hinaus kann der Mensch Cumarin durch orale Einnahme über natürliche Nahrungsmittel, Arzneimittel und Tabakprodukte aufnehmen. Die gastrointestinale Absorption von Cumarin erfolgt schnell.
5.2. Toxikokinetik
Umfangreiche Forschungen haben die Absorption, den Metabolismus und die Ausscheidung von Cumarin beschrieben. Der Expositionsweg beeinflusst die Blutwerte und die Toxizität erheblich.
Orale Bolusdosen führen zu deutlich höheren Plasmakonzentrationen als bei Nahrungsaufnahme, trotz gleicher Konzentrationen von Milligramm pro Kilogramm Körpergewicht.
Bei dermaler Exposition wird der anfängliche Lebermetabolismus umgangen (First-Pass-Effekt). Cumarin im Blut passiert zuerst die Lunge, wo ein erheblicher Teil ausgeatmet werden kann, bevor es in der Leber verstoffwechselt wird.
Menschen verstoffwechseln Cumarin hauptsächlich zu ungiftigem 7-Hydroxycumarin. Die Bildung von o-Hydroxyessigsäure in der Leber ist minimal und wird schnell entgiftet. Das Fehlen von reichlich vorhandenen Clara-Zellen in der menschlichen Lunge verhindert die Bildung von pulmonalem Epoxid und o-Hydroxyessigsäure, selbst bei hohen Cumarin-Dosen.
Studien mit menschlichen Lebermikrosomen korrelieren eine geringe 7-Hydroxylierungskapazität mit einer verringerten Epoxidbildung.
5.3. Akute und kurzfristige Toxizität
- Tierstudien
Die gemeldeten LD50-Werte für Cumarin reichen von 160 bis 780 mg/kg Körpergewicht, wobei die Abweichungen auf die Tierart, den Stamm und den Fastenzustand zurückzuführen sind. Nach der Exposition wurden leichte Augen- und Hautreizungen beobachtet.
Eine Aufnahme von Cumarin in einer Nahrungsaufnahme von mindestens 4 Wochen in Konzentrationen von ≥2500 ppm kann zu einer verringerten Nahrungsaufnahme, reduziertem Körpergewicht und mikroskopischen Leberveränderungen führen. Höhere Nahrungskonzentrationen (1-2 %) führen zu Nahrungsverweigerung und Tod.
Bei hohen Dosen, die die Nahrungsaufnahme erheblich beeinträchtigen, kann die Fortpflanzung beeinträchtigt werden, bei niedrigeren Dosen wurden jedoch keine Auswirkungen auf die Fortpflanzung oder Entwicklung festgestellt.
- Studien am Menschen
Menschen kommen durch den Verzehr von Zimt, grünem Tee, Honig aus Steinklee und anderen Nahrungsmitteln mit Cumarin in Kontakt. Es wurden Fälle von Blutungen im Zusammenhang mit Kräutertees mit Tonkabohnen, Steinklee und Waldmeister berichtet.
Pharmazeutische Cumarindosierungen reichen von 70 bis 7000 mg/Tag, wobei 200 mg einmal oder zweimal täglich die häufigste Dosierung ist.
Nach der Verwendung von pharmazeutischem Cumarin wurde selten über Lebertoxizität berichtet. Die damit verbundenen Veränderungen der Leberenzyme sind oft nach Beendigung der Behandlung und manchmal sogar bei fortgesetzter Behandlung reversibel.
Die gemeldeten Inzidenzraten variieren zwischen <0,1 und 6 %, abhängig von der Studienpopulation und der Dosierung. Obwohl einige Todesfälle mit der Verwendung von Cumarin in Verbindung gebracht wurden, erschweren Störfaktoren wie bereits bestehende Erkrankungen die kausale Interpretation.
Studien zum CYP2A6-Polymorphismus beim Menschen haben keinen Zusammenhang mit Cumarin-bedingter Leberfunktionsstörung festgestellt.
Cumarin wurde in verschiedenen Modellen Sensibilisierungstests unterzogen, darunter dermale Anwendung bei Meerschweinchen, Mausohrschwellungstest und lokaler Lymphknotentest (LLNA). Reines Cumarin lieferte in jüngsten LLNA-Studien durchweg negative Ergebnisse, sogar bei Konzentrationen von bis zu 50 %.
Eine chlorierte Verunreinigung (6-Chlorcumarin) und weniger reines Cumarin aus o-Kresol haben jedoch sensibilisierende Eigenschaften gezeigt, was mit gemeldeten Sensibilisierungsfällen im Zusammenhang mit Cumarin-Derivaten übereinstimmt.
Anders als bei Labortieren können menschliche Populationen bereits Cumarin oder kreuzreaktiven Substanzen ausgesetzt sein, was die Beurteilung der Sensibilisierung beim Menschen erschwert.
Die gerinnungshemmende Wirkung von Cumarin ist deutlich geringer als die von Warfarin. Fallberichte legen nahe, dass Cumarin die Wirkung von Vitamin-K-Antagonisten verstärken kann, obwohl der zugrundeliegende Mechanismus unklar bleibt. Cumarin wurde nicht mit Teratogenität oder nachteiligen Auswirkungen auf die Fortpflanzung beim Menschen in Verbindung gebracht.
5.4. Chronische Toxizität
- Tierstudien
Es wurden umfangreiche Langzeitstudien zur Toxizität und Karzinogenität von Cumarin durchgeführt. Die wichtigsten Nebenwirkungen, die bei Tieren beobachtet wurden, sind eine verringerte Nahrungsaufnahme, die zu reduziertem Körpergewicht und Lebertoxizität führt, insbesondere bei Ratten.
Lebertumoren, obwohl nicht metastasierend und nicht tödlich, wurden bei Ratten beobachtet, die hohen Dosen (≥150 mg/kg Körpergewicht) ausgesetzt waren, die die Gewichtszunahme signifikant reduzierten. Lungentumoren wurden bei Mäusen festgestellt, die hohen Bolusdosen (≥150 mg/kg Körpergewicht) ausgesetzt waren, jedoch nicht bei denen, die über die Nahrung aufgenommen wurden.
- Studien am Menschen
Berufsbedingter Kontakt mit Cumarinstaub kann zu Reizungen der Atemwege führen. Darüber hinaus kann Cumarin bei anfälligen Personen als schwacher Hautsensibilisator wirken, wobei der Grad der Sensibilisierung von der Reinheit der Substanz beeinflusst wird. Es wurden keine weiteren langfristigen Nebenwirkungen beim Menschen dokumentiert.
Die Internationale Agentur für Krebsforschung (IARC) hat Cumarin in Gruppe 3 eingestuft, was bedeutet, dass es nicht als menschliches Karzinogen eingestuft werden kann.
In-vitro-Toxizität
Cumarin ist nicht mutagen und bindet nicht an DNA. Es zeigt keine klastogenen Eigenschaften, was auf eine vernachlässigbare Auswirkung auf Chromosomen hindeutet.
Reproduktionstoxizität
Im Gegensatz zu Warfarin ist Cumarin nicht teratogen.
Genotoxizität
Mehrere Studien haben übereinstimmend gezeigt, dass Cumarin nicht genotoxisch ist. Es hat schützende Eigenschaften gegen Doxorubicin-induzierte Mutationen gezeigt.
Karzinogenität
Es gibt keine schlüssigen Beweise, um Cumarin als Karzinogen einzustufen. Tatsächlich deuten einige Untersuchungen auf potenzielle antioxidative und antineoplastische Wirkungen hin.
Klinische Behandlung von Überdosierungen
Aufgrund der relativ geringen Toxizität von Cumarin sind spezifische Behandlungsprotokolle für Überdosierungen begrenzt. Allgemeine Maßnahmen, wie z. B. eine Magendekontamination bei erheblicher oraler Einnahme, können in Betracht gezogen werden. Eine Überwachung des International Normalized Ratio und der Leberfunktionstests wird empfohlen.
Ökotoxizität
Cumarin weist eine geringe Umwelttoxizität auf. Aquatische Toxizitätsstudien haben LC50-Werte von 56 mg/l für Fische und EC50-Werte von 55 mg/l für Daphnia magna ergeben. Die Atmung der Algen wird bei Laborkonzentrationen von 50 mmol/l gehemmt.
Aufgrund seiner relativ geringen Persistenz wird angenommen, dass Cumarin in der Umwelt leicht abgebaut wird.
Referenzen
- Coumarin; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0315211302150919.a01.pub2
- Coumarins. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543007983
- https://www.sciencedirect.com/science/article/abs/pii/B0123694000002696
- https://onlinelibrary.wiley.com/doi/10.1002/mnfr.200900281
- https://www.sciencedirect.com/science/article/abs/pii/B9780124095472126204
- https://pubchem.ncbi.nlm.nih.gov/compound/Coumarin
