Chloracetaldehyd: Eigenschaften, Herstellung und Verwendung

Chloracetaldehyd [107-20-0], auch bekannt als 2-Chlorethanal, ist eine farblose flüssige organische Verbindung mit der Formel CH2ClCHO. Es wurde erstmals 1882 von K. Natterer in reiner Form hergestellt, indem Chloracetaldehyddiethylacetal mit wasserfreier Oxalsäure auf 100–150° erhitzt wurde C.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Chloracetaldehyd
1.1. Wasserfreies Chloracetaldehyd
Wasserfreier Chloracetaldehyd ist eine farblose, bewegliche Flüssigkeit mit stechendem Geruch, die folgende physikalische Eigenschaften aufweist:
- Molekulargewicht: 78,50 g/mol
- Siedepunkt: 85–85,5°C (99,7 kPa)
- Bildungsenthalpie: -256,4 kJ/mol
- Verbrennungsenthalpie: -981,4 kJ/mol (101,3 kPa, 20°C)
- Dipolmoment: 1,99 D (298 K, Benzol)
- Löslich in Wasser (Hydratbildung) und gängigen organischen Lösungsmitteln
- Octanol-Wasser-Verteilungskoeffizient: 0,16 (sehr niedrig)
1.2. Monochloracetaldehyd-Hemihydrat
- Formel: CH2ClCH(OH)2OCH(OH)CH2Cl (1,1′-Dihydroxy-2,2′-dichlordiethylether)
- Molekulargewicht: 175,01 g/mol
- Farblose Kristalle mit einem Schmelzpunkt zwischen 43 und 50 °C (Dehydratisierung)
- Zersetzt sich beim Siedepunkt (84 °C)
- Löslich in Wasser, Ethanol, Ether, Benzol, Dichlormethan und Chloroform.
- CAS-Nummern [34789-09-8] („Acetaldehyd-Chlor-Dimer-Hydrat“) und [7737-02-2] („1,1′-Oxybis( 2-Chlorethanol)“) beziehen sich auf dieselbe Verbindung.
- Bildet mit Wasser eine azeotrope Mischung, die durch einfache Destillation untrennbar ist.
- Flammpunkt: 60°C
- Zündpunkt: 405°C
- Explosionsgrenzen in Luft (20°C, 101,3 kPa): untere 305 g/m³
| Temperatur (°C) | Löslichkeit (Gew.%) |
|---|---|
| 1 | 13.35 |
| 10 | 22.2 |
| 20 | 44,3 |
| 30 | 62,7 |
| 40 | 81,5 |
| Konzentration (Gew.%) | Dichte (g/cm³) |
|---|---|
| 10 | 1.041 |
| 20 | 1,085 |
| 30 | 1,137 |
| 40 | 1,188 |
| 50 | 1,238 |
| 60 | 1.290 |
| 72,5 | 1,355 |
2. Chemische Eigenschaften von Chloracetaldehyd
Chloracetaldehyd ist aufgrund der Aldehyd- und Chlormethylgruppen sehr reaktiv. Seine α-Wasserstoffe und Chlor werden aktiviert, was nukleophile Substitutionen und für Aldehyde typische Reaktionen (Addition, Kondensation) erleichtert.
2.1. Reaktionen der Aldehydgruppe
Durch die Selbstkondensation von Chloracetaldehyd bei Raumtemperatur entstehen zyklische Trimeren, Tetrameren und Polyoxymethylen-Polymeren. Es gibt auch Cotrimere und Copolymere mit Acetaldehyd. Die Struktur des Halbhydrats 1,1′-Dihydroxy-2,2′-dichlordiethylether reagiert ähnlich wie ein Aldehyd.
Natriumbisulfit-Addukt und Dimethyl-/Diethylacetale sind wichtige Derivate von Chloracetaldehyd, die als Vorläufer für Arzneimittel und Pestizide verwendet werden.
Die Oxidation von Chloracetaldehyd mit Luft/Kobaltsalzen, Wasserstoffperoxid oder Salpetersäure ergibt Monochloressigsäure.

Bei der Aldolkondensation in alkalischem Medium entsteht 2,4-Dichloracetaldol und bei der Codolisierung mit Acetaldehyd entsteht 2-Chlorcrotonaldehyd, das ebenfalls ein Nebenprodukt der Acetaldehydproduktion ist.
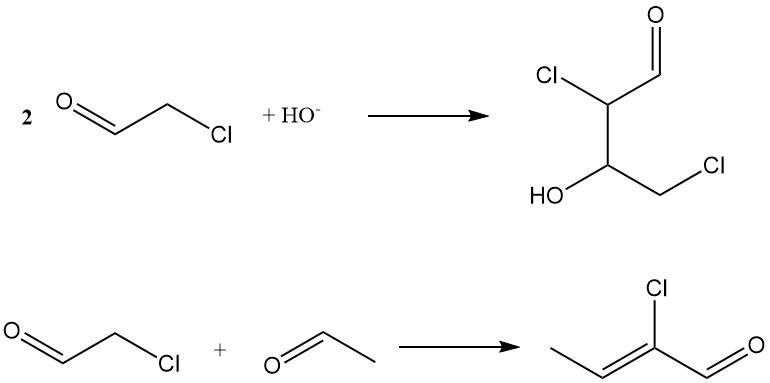
Andere Reaktionen umfassen die Bildung von Aldehyd-Ammoniak, Cyanhydrin und 2-Chlorethylchloracetat (Tischtschenko-Reaktion).
2.2. Reaktionen des Chloratoms
Durch die Hydrierung von Chloracetaldehyd in einer wässrigen Lösung mit einem Palladium-Kohlenstoff-Katalysator wird das Chlor entfernt. Verschiedene Nukleophile können das Chlor ersetzen.
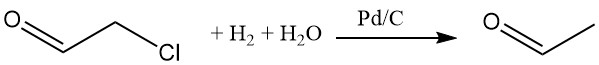
Chloracetaldehyd reagiert mit Natriummercaptan unter Bildung von Mercaptoacetaldehyd, das als Zwischenprodukt bei der Synthese von Thienodiazepinen, Azofarbstoffen, D-L-Cystein und bestimmten Lebensmittelaromen verwendet wird.

Aminoverbindungen können das Chloratom von Chloracetaldehyd in Acetalform ersetzen (Reaktionen mit der Aldehydgruppe vermeiden). Diese Zwischenprodukte werden bei der Synthese von Pestiziden und Arzneimitteln verwendet.

Chloracetaldehyd-Dimethylacetal reagiert mit Natriummethoxid unter Bildung von 1,1,2-Trimethoxyethan (einem pharmazeutischen Zwischenprodukt).

2.3. Kombinierte Reaktionen
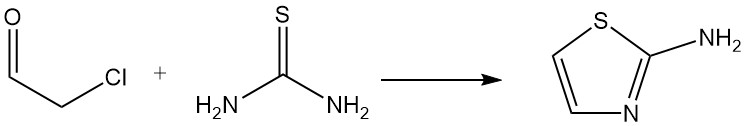
Chloracetaldehyd (Halbhydrat oder Acetal) ist ein wichtiger Ausgangsstoff für die Synthese von Heterocyclen; Ein Beispiel ist die Reaktion mit Thioharnstoff zu 2-Aminothiazol, das zur Herstellung von Arzneimitteln und Farbstoffen verwendet wird.
Die Cyclokondensation mit Methylacetoacetat ergibt 2-Methyl-3-carbomethoxyfuran (ein Samendesinfektionsmittel).
Durch die Reaktion von Chloracetaldehyd mit Carboethoxyhydrazin und die anschließende Cyclisierung mit Thionylchlorid entsteht 5-Chlorthiadiazol, ein Baumwoll-Entlaubungsmittel und Pflanzenwachstumsregulator.
Stilbene entstehen durch Reaktionen mit aromatischen Kohlenwasserstoffen, Phenolen oder Phenolethern. Vinyldialkylphosphate werden durch die Perkow-Reaktion mit Trialkylphosphiten hergestellt. 1,1,2-Triacetoxyethan (d,l-Serin-Vorläufer) wird durch Reaktion von Chloracetaldehyd mit Natriumacetat und Essigsäureanhydrid.
2.4. Chloracetaldehyd-Polymere
1. Trichlorparaldehyd (C6H9Cl3O3)
- Eigenschaften: Farblose Kristalle, Schmelzpunkt 88–89 °C, Siedepunkt 140–144 °C, löslich in üblichen organischen Lösungsmitteln.
- Formation:
- Reaktion von konzentrierter Schwefelsäure mit Chloracetaldehyd-Halbhydrat.
- Rückstand aus der azeotropen Destillation von Chloracetaldehyd-Hemihydrat.
- Zersetzung von 1,2-Dichlorethylnitrat in Gegenwart von Lewis-Säuren.
Beim Erhitzen mit Säuren wird es in Chloracetaldehyd umgewandelt.
2. Tetrachlormetaldehyd (C8H12Cl4O4)
- Eigenschaften: farblose Kristalle, Schmelzpunkt 65–67 °C, Kp. 127–130 °C.
- Bildung: Rückstand aus der azeotropen Dehydratisierung von Chloracetaldehyd-Hemihydrat.
3. Polychloracetaldehyde (C2H3ClO)n
- Eigenschaften: amorphe, elastische Produkte mit Polyacetalstruktur. Kristalline Formen sind bei niedrigeren Temperaturen mit speziellen Katalysatoren erhältlich.
- Bildung: Polymerisation von wasserfreiem Chloracetaldehyd bei -40 bis -78°C, insbesondere mit Lewis-Säuren.
3. Herstellung von Chloracetaldehyd

Chloracetaldehyd entsteht durch die Reaktion von Acetaldehyd oder Paraldehyd mit Chlor, wobei Dichloracetaldehyd und Trichloracetaldehyd als Verunreinigungen vorliegen. Diese Baumprodukte fallen auch als Nebenprodukte im Wacker-Verfahren zur Acetaldehydproduktion an.
Eine weitere Produktionsmethode ist die Chlorierung von Vinylchlorid in Wasser bei 20 °C, die eine nahezu 100-prozentige Ausbeute an Chloracetaldehyd ergibt, wenn die Konzentration im Reaktionsmedium unter 5 % bleibt. Höhere Konzentrationen begünstigen die Bildung von 1,1,2-Trichlorethan.
Durch die Reaktion von Chlor mit Vinylacetat in Wasser bei Raumtemperatur entsteht eine konzentrierte Chloracetaldehydlösung, die destilliert werden kann, um die reine Verbindung herzustellen. Nebenprodukte sind geringe Mengen an chlorierten Acetaldehyden, Acetaldehyd und Kondensationsprodukten.
Die Synthese von Chloracetaldehydacetalen mit hohen Ausbeuten und Reinheit wird durch die Durchführung der oben genannten Reaktionen in Alkoholen erreicht.
Die Herstellung von wasserfreiem Chloracetaldehyd durch Chlorierung von trockenem Acetaldehyd oder Paraldehyd ergibt eine geringe Ausbeute. Allerdings ist eine azeotrope Dehydratisierung des Hemihydrats mit Chloroform, Toluol oder Tetrachlorkohlenstoff und anschließende Destillation über eine Dehydratisierungsanlage möglich Agent bietet bessere Ergebnisse.
Wasserfreier Chloracetaldehyd wird mit hohen Ausbeuten durch Depolymerisation von Trichlorparaldehyd oder Polychloracetaldehyd bei 145 °C mit Oxal- oder Trichloressigsäure erhalten. Zum gleichen Ergebnis führt auch die Pyrolyse von Chlorethylencarbonat in Gegenwart quartärer Ammoniumsalze.
4. Verwendung von Chloracetaldehyd
Chloracetaldehyd wird als Baustein bei der Herstellung von Zwischenprodukten für Statin-Medikamente, die den Cholesterinspiegel senken, und für Anti-AIDS-Medikamente verwendet. Das Mercapto-Derivat 2,5-Dihydroxy-1,4-dithian wird bei der Synthese von Medikamenten gegen HIV/AIDS verwendet.
Chloracetaldehyd wird auch bei der Synthese verschiedener Farbstoffe verwendet. Seine Dialkylacetal-Derivate, wie Chloracetaldehyd-Dimethylacetal, sind wichtige Ausgangsstoffe für die Herstellung von Agrarchemikalien und seine Acetale werden bei der Herstellung von Duftstoffen verwendet.
Es können Polymere entstehen, die kommerziell keine Bedeutung haben.
5. Toxikologie von Chloracetaldehyd
Akute Toxizität:
- Hochgiftig beim Einatmen, was bei Tieren zu einem schnellen bis verzögerten Tod führt. Die Werte für die tödliche Dosis (LD50) sind:
- Ratte (oral): 89 mg/kg
- Kaninchen (dermal): 267 mg/kg
- Ratte (Inhalation, 1h): 650 mg/m³
- Haut- und augenreizend, schon bei geringen Konzentrationen (0,03 %ige Lösung).
- Kein Hautallergen bei Meerschweinchen.
Chronische Toxizität:
- In chronischen Inhalationsstudien unter 5,2 mg/m³ wurden keine Anzeichen von Toxizität beobachtet.
- Mutagen in verschiedenen Organismen und menschlichen Zellen.
- In Studien an Mäusen wurde keine Zunahme von Hauttumoren beobachtet.
- Lebertumoren wurden bei männlichen Mäusen beobachtet, die Wasser mit 0,1 g/L Chloracetaldehyd tranken.
Menschliche Exposition:
- Chloracetaldehyd reizt die Haut, die Schleimhäute und die Atemwege.
- Es verursacht bei Hautkontakt verbrennungsähnliche Blasen und Gewebeschäden.
- Tränenbildung und Nasenreizung bei 32,6 mg/m³ Luftexposition.
Empfehlungen:
- TLV-STEL (USA): 1 ppm (maximal zulässige Luftkonzentration).
- EU-Einstufung: „Sehr giftig“ und „Umweltgefährlich.“
- Erfordert vollständige persönliche Schutzausrüstung (Schutzbrille, Handschuhe und Maske).
Referenz
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
