Dichloracetaldehyd [79-02-7] oder 2,2-Dichlorethanal ist ein chlorierter Acetaldehyd mit der chemischen Formel Cl2CHCHO. Es handelt sich um eine farblose Flüssigkeit mit einem stechenden, reizenden Geruch, die erstmals 1868 von F. Paterno durch Destillation von Dichlordiethylacetal, CHCl2CH(OC2H5)2, mit Schwefelsäure hergestellt wurde.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Dichloracetaldehyd
Dichloracetaldehyd, auch bekannt als 2,2-Dichlorethanal, ist eine farblose Flüssigkeit mit einem charakteristischen stechenden Geruch. Es verfügt über mehrere wichtige physikalische Eigenschaften:
- Molekulargewicht: 112,94 g/mol
- Schmelzpunkt: -37,6 bis -37,4 °C
- Siedepunkt: 89,2 °C
- Dichte (25 °C): 1,4113 g/cm³
- Dipolmoment (30 °C): 2,36 D
- Löslichkeit: mit Wasser mischbar, bildet ein Hydrat und in üblichen organischen Lösungsmitteln leicht löslich.
Dichloracetaldehyd reagiert leicht mit Wasser unter Bildung eines Monohydrats (CAS: 16086-14-9), bekannt als 2,2-Dichlor-1,1-ethandiol. Dieser kristalline Feststoff weist besondere Eigenschaften auf:
- Molekulargewicht: 130,96 g/mol
- Schmelzpunkt: 35–50 °C
- Siedepunkt: 85–95 °C bei 101,3 kPa
- Dichte (20 °C): 1,53–1,54 g/cm³
- Dampfdruck: 6,5 kPa bei 20 °C, 25 kPa bei 50 °C
- Löslichkeit: löslich in polaren organischen Lösungsmitteln, unlöslich in unpolaren.
- Flammpunkt: Ungefähr 95 °C
- Zündtemperatur: Ungefähr 605 °C
2. Chemische Reaktionen von Dichloracetaldehyd
Dichloracetaldehyd unterliegt bei der Lagerung einer spontanen Polymerisation und bildet ein festes, farbloses Polymer. Dieses Polymer wird beim Erhitzen auf 120 °C wieder in seine Monomerform umgewandelt.
Dichloracetaldehyd zeigt die charakteristischen Reaktionen von Aldehyden, wie Oxidation, Reduktion und Kondensation.
Durch die Oxidationsreaktion mit Chromsäure entsteht Dichloressigsäure.
Die Reduktion von Dichloracetaldehyd mit Ethylaluminium ergibt 2,2-Dichlorethanol.

Durch die Selbstkondensation entsteht 2,2,4,4-Tetrachloracetaldol.
Die Kondensationsreaktion von Dichloracetaldehyd mit Ethylbenzol ergibt p,p‘-Diethyl-1,1-diphenyl-2,2-dichlorethan, ein Insektizid namens Perthan.

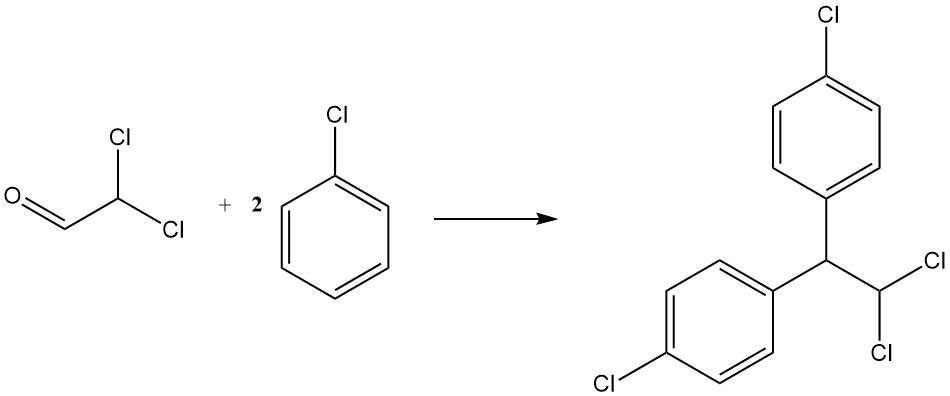
Durch Kondensation mit Chlorbenzol entsteht p,p‘-Dichlor-1,1-diphenyl-2,2-dichlorethan, ein weiteres Insektizid, das als TDE oder DDD bekannt ist. Es wird durch die folgende Gleichung dargestellt:
CHCl2CHO + 2 C6H5Cl → CHCl2CH(C6H4Cl)2 + H2O
3. Herstellung von Dichloracetaldehyd
Der wichtigste industrielle Herstellungsprozess für Dichloracetaldehyd ist die Chlorierung von Acetaldehyd bzw. Paraldehyd. Eine weitere Methode zur Herstellung von reinem Dichloracetaldehyd ist die Hypochlorierung von 1,2-Dichlorethylen.
3.1. Chlorierung von Acetaldehyd oder Paraldehyd
Bei dieser Methode entsteht neben Chloracetaldehyd und Trichloracetaldehyd auch Dichloracetaldehyd. Hohe Ausbeuten sind mit Katalysatoren wie Antimontrichlorid (83 %) oder Phosphorsäure (>90 %) erreichbar. Bei der Oxychlorierung während des Wacker-Prozesses zur Acetaldehydherstellung kann auch Dichloracetaldehyd als Nebenprodukt entstehen.
3.2. Hypochlorierung von 1,2-Dichlorethylen
Dieses Verfahren liefert reinen Dichloracetaldehyd, frei von Verunreinigungen wie Chloral und Monochloracetaldehyd. Dabei wird 1,2-Dichlorethylen mit einem Mol Chlor unter bestimmten Temperatur- und Lösungsmittelbedingungen behandelt.
3.3. Chlorierung von Ethanol
Durch die kontrollierte Chlorierung von Ethanol in Gegenwart von Nickel(II)-chlorid kann hauptsächlich Dichloracetaldehyd sowie etwas Chloral und Monochloracetaldehyd entstehen. Das resultierende Halbacetal kann direkt verwendet werden, ohne dass reiner Dichloracetaldehyd oder sein Hydrat isoliert werden muss.

4. Verwendung von Dichloracetaldehyd
Dichloracetaldehyd und seine Acetale werden in der Pharmaindustrie zur Herstellung von Trichlormethiazid verwendet, einem Diuretikum zur Behandlung von Erkrankungen wie Bluthochdruck und Ödeme und Mitotan (1,1-Dichlor-2-(o-chlorphenyl)-2-(p-chlorphenyl)ethan), ein Zytostatikum, das zur Behandlung bestimmter Nebennierenkrebserkrankungen eingesetzt wird.
Es wird auch bei der Herstellung von Insektiziden wie Perthan und TDE oder DDD verwendet.
5. Toxikologie von Dichloracetaldehyd
Dichloracetaldehyd birgt eine potenzielle Reizwirkung auf die Atemwege, obwohl keine formellen Daten zu Toxizitätstests vorliegen. Als Vorsichtsmaßnahme sollte vorsichtig damit umgegangen werden.
6. Dichloracetaldehyd-Polymere
6.1. Hexachlorparaldehyd
- Formel: C6H6Cl6O3
- Molmasse: 338,83 g/mol
- Aussehen: Farblose Kristalle
- Schmelzpunkt: 131-132 °C
- Siedepunkt: 210–220 °C (Zersetzung)
Hexachlorparaldehyd entsteht durch die Reaktion von Dichloracetaldehyd mit Lewis-Säuren wie Antimontrichlorid, Eisen(III)-chlorid oder Bortrifluorid oder durch direkte Chlorierung von Paraldehyd mit 6–7 mol Chlor bei 35 °C unter wasserfreien Bedingungen.
Es bildet in Gegenwart wässriger Säuren Dichloracetaldehydhydrat und zersetzt sich bei erhöhten Temperaturen zu Dichloracetaldehyd.
6.2. Polydichloracetaldehyde
- Formel: (C2H2Cl2O)n
- Löslichkeit: variabel je nach Polymerisationsgrad, im Allgemeinen löslich in gängigen organischen Lösungsmitteln.
Die kristallinen Formen von Polydichloracetaldehyden werden durch Behandlung von Dichloracetaldehyd bei -78 °C mit metallorganischen Verbindungen wie Triethylaluminium hergestellt, und die amorphen Formen werden mit Lewis-Säuren bei Temperaturen unter 0 °C hergestellt.
Diese Polymere sind in konzentrierter Schwefelsäure bei 100 °C unter Verfärbung und in Dimethylformamid löslich. Sie können mit anderen Aldehyden Copolymere bilden.
Referenz
- Chloracetaldehyde; Ullmanns Enzyklopädie der industriellen Chemie. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2