Butyrolacton: Eigenschaften, Herstellung und Verwendung
γ-Butyrolacton (CAS 96-48-0), auch bekannt als γ-Hydroxybuttersäurelacton, ist eine einfache organische Verbindung mit der Formel C4H6O2. Es ist eine hygroskopische und farblose Flüssigkeit mit schwachem Geruch, die auf den ersten Blick unauffällig erscheinen mag.
Die industrielle Produktion begann in den 1940er Jahren als Ergebnis der Arbeit von Reppe und Kollegen bei BASF. Das Reppe-Verfahren bleibt die dominierende Methode für die großtechnische Synthese von γ-Butyrolacton.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Butyrolacton
γ-Butyrolacton liegt als farblose, leicht hygroskopische Flüssigkeit mit schwachem Geruch vor. Es ist mit Wasser, Alkoholen, Estern, Ethern, Ketonen und aromatischen Kohlenwasserstoffen mischbar. Obwohl es mit linearen und zyklischen aliphatischen Kohlenwasserstoffen nur begrenzt mischbar ist, wird es als Lösungsmittel für zahlreiche Polymere und niedere Kohlenwasserstoffe verwendet.
Einige physikalische Eigenschaften von γ-Butyrolacton sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Molmasse | 86,09 g/mol |
| Schmelzpunkt | -43,5°C |
| Siedepunkt | 204-206°C (bei 101,3 kPa) |
| Dichte (0°C) | 1,15 g/cm³ |
| Dichte (20°C) | 1,13 g/cm³ |
| Dichte (40°C) | 1,11 g/cm³ |
| Kritische Temperatur | 436,5°C |
| Kritischer Druck | 3,35 MPa |
| Dampfdruck (20°C) | 0,04 kPa |
| Dampfdruck (50°C) | 0,3 kPa |
| Dampfdruck (100°C) | 3,6 kPa |
| Dampfdruck (150°C) | 22,5 kPa |
| Dampfdruck (205°C) | 101,3 kPa |
| Verdampfungswärme (206°C) | 535 kJ/kg |
| Lösungswärme in Wasser | 2500 J/mol |
| Spezifische Wärmekapazität (cp) – Flüssigkeit (25 °C) | 1680 J kg⁻¹ K⁻¹ |
| Spezifische Wärmekapazität (cp) – Flüssigkeit (100 °C) | 1850 J kg⁻¹ K⁻¹ |
| Spezifische Wärmekapazität (cp) – Flüssigkeit (200 °C) | 2200 J kg⁻¹ K⁻¹ |
| Spezifische Wärmekapazität (cp) – Gas (100 °C) | 1275 J kg⁻¹ K⁻¹ |
| Spezifische Wärmekapazität (cp) – Gas (200 °C) | 1575 J kg⁻¹ K⁻¹ |
| Spezifische Wärmekapazität (cp) – Gas (300 °C) | 1820 J kg⁻¹ K⁻¹ |
| Flammpunkt | 100-101°C |
| Zündtemperatur | 455°C |
| Verbrennungswärme | 234 kJ/g |
| Explosionsgrenzen – niedriger | 2,7 Vol.-% |
| Explosionsgrenzen – Obergrenze | 15,6 Vol.-% |
| Brechungsindex (20°C) | 1.4352 |
| Viskosität (20°C) | 1,90 mPa·s |
| Viskosität (50°C) | 1,25 mPa·s |
| Viskosität (80°C) | 0,86 mPa·s |
| Viskosität (110°C) | 0,63 mPa·s |
| Viskosität (140°C) | 0,49 mPa·s |
| Viskosität (170°C) | 0,40 mPa·s |
| Oberflächenspannung (20°C) | 44,6 x 10⁻⁵ N/cm |
| Dielektrizitätskonstante (20°C) | 39,1 |
| Wärmeleitfähigkeit (25–65 °C) | 0,276 J m⁻¹ s⁻¹ K⁻¹ |
| Leitfähigkeit | 0,7 μS/cm |
2. Chemische Eigenschaften von Butyrolacton
In einer wässrigen Lösung stellt die Isomerisierung zwischen der Lactonform und der freien Hydroxybuttersäureform ein temperaturabhängiges Gleichgewicht dar. Bei 0 °C überwiegt die Lactonform vollständig, während bei 100 °C etwa 80 % als Lacton vorliegen.
Stark alkalische Bedingungen (ein Moläquivalent Alkali) verschieben das Gleichgewicht vollständig in Richtung der Hydroxybuttersäureform. Diese Eigenschaft ermöglicht die titrimetrische Bestimmung von Butyrolacton. Bei einem neutralen pH-Wert (7) ist Butyrolacton sehr stabil.
Butyrolacton geht mit verschiedenen Reagenzien Ringspaltungsreaktionen ein, die Derivate der γ-Hydroxybuttersäure ergeben. Beispiele hierfür sind Reaktionen mit Basen, Halogenwasserstoffen und Alkoholen (unter sauren Bedingungen).
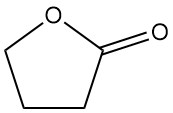
Es reagiert auch in der α-Position ohne Ringspaltung. Dazu gehören Reaktionen mit Ammoniak, Aminen, Carbonylverbindungen und Halogenierung. Beispielsweise entsteht bei der Kondensation mit Ethylacetat α-Acetobutyrolacton, ein wichtiges Zwischenprodukt bei der Vitamin-B1-Synthese.
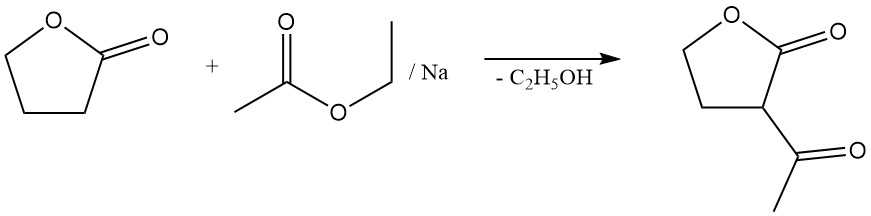
Die Spaltungsreaktion des Lactonrings ermöglicht die Herstellung wertvoller γ-substituierter Buttersäurederivate. Beispielsweise entsteht durch die Reaktion mit Natriumsulfid das Kautschukadditiv Thiodibuttersäure,
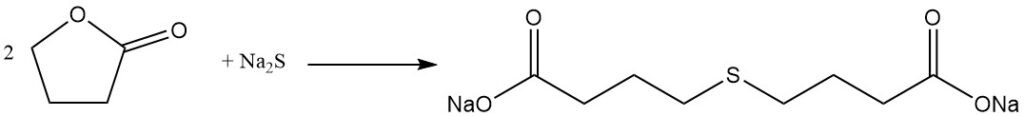
während die Reaktion mit Phenol Phenoxybuttersäure erzeugt.
Der Ersatz des Ringsauerstoffatoms durch Stickstoff ist eine industrielle Reaktion, die zur Synthese von Pyrrolidon-Derivaten verwendet wird. Beispielsweise reagiert Butyrolacton mit Methylamin zu N-Methylpyrrolidon (NMP), einem wichtigen industriellen Lösungsmittel.
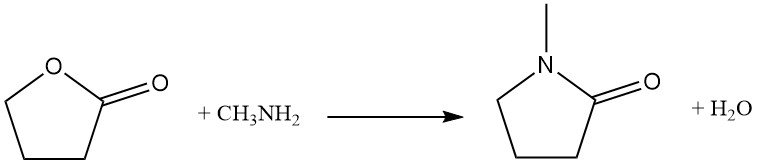
Die direkte Homopolymerisation von Butyrolacton erfordert einen hohen Druck (2000 MPa), aber alternative Wege, wie die Fermentation von Zuckern, können ein ähnliches Produkt ergeben.
3. Herstellung von Butyrolacton
3.1. Herstellung von Butyrolacton durch Dehydrierung von 1,4-Butandiol
Der Reppe-Prozess ist der vorherrschende industrielle Weg zur Butyrolactonsynthese, der durch die endotherme Gasphasendehydrierung von 1,4-Butandiol erreicht wird. Diese mehrstufige Reaktion verläuft über γ-Hydroxybutyraldehyd- und 2-Hydroxytetrahydrofuran-Zwischenprodukte.

Zu den wichtigsten Herstellern, die dieses Verfahren anwenden, gehören BASF, Ashland und Lyondell.
Vorgewärmter 1,4-Butandioldampf wird mit einem heißen zirkulierenden Wasserstoffstrom kombiniert und bei Atmosphärendruck und Temperaturen im Bereich von 180 bis 300 °C über ein Kupferkatalysatorbett geleitet (Abbildung 1). Diese Reaktion liefert eine hohe Ausbeute von etwa 95 % Butyrolacton.
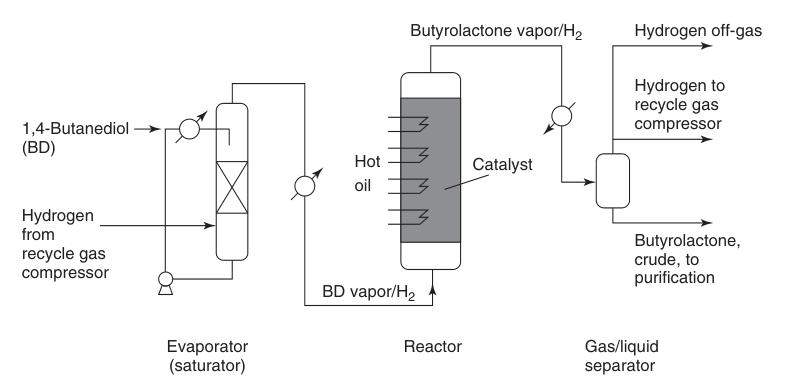
Das erzeugte Wasserstoffnebenprodukt erfordert für eine mögliche Wiederverwendung nur eine minimale Reinigung, die typischerweise eine katalytische Methanisierung zur Entfernung von Kohlenmonoxidverunreinigungen umfasst.
Rohes Butyrolacton, das aus dem recycelten Gasstrom abgetrennt wird, enthält geringfügige Verunreinigungen wie nicht umgesetztes 1,4-Butandiol, Buttersäure und hochsiedende Verbindungen. Diese werden durch Destillation entfernt, um reines Butyrolacton zu erhalten.
Butyrolacton selbst ist nicht korrodierend und mit Geräten aus Kohlenstoffstahl kompatibel. Komponenten, die heißem, buttersäurehaltigem Rohprodukt ausgesetzt sind, wie etwa Teile der Synthese- oder Destillationsgefäße und Rohrleitungen, erfordern jedoch den Einsatz von Edelstahl für eine längere Lebensdauer.
3.2. Herstellung von Butyrolacton durch Hydrierung von Maleinsäureanhydrid
Ein alternativer Weg zu Butyrolacton ist die katalytische Hydrierung von Maleinsäureanhydrid. Bei diesem Verfahren wird vorgewärmtes geschmolzenes Maleinsäureanhydrid unter Druck (6–12 MPa) und Temperatur (160–280 °C) in einen zirkulierenden Wasserstoffstrom eingeleitet. Ein Katalysator auf Nickelbasis fördert die Reaktion, die exotherm mit einem ΔH von -211 kJ/mol abläuft:
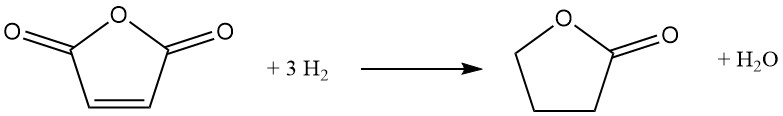
Der Reaktionsweg umfasst ein intermediäres Bernsteinsäureanhydrid und kann abhängig von den gewählten Bedingungen weiter auf die Herstellung von Tetrahydrofuran ausgerichtet sein. Eine vollständige Hydrierung von Bernsteinsäureanhydrid führt jedoch zwangsläufig zur Mitbildung von Tetrahydrofuran.
Der überschüssige Wasserstoff wird nach dem Waschen mit Wasser recycelt, um Verunreinigungen zu entfernen. Bei der Butyrolacton-Synthese entstehende Nebenprodukte, darunter Propanol, Butanol, Propionsäure und Buttersäure, werden aus dem zirkulierenden Gasstrom abgetrennt. Die anschließende Destillation reinigt den Butyrolactonstrom.
Aufgrund des Vorhandenseins saurer Nebenprodukte erfordern sowohl die Synthese- als auch die Destillationsausrüstung eine Konstruktion aus Edelstahl. Mitsubishi Chemical Corporation ist ein Hersteller, der diese Methode anwendet.
3.3. Herstellung von Butyrolacton durch Hydrierung von Maleinsäureestern
In den 1980er Jahren entstanden mehrere Verfahren, die Dimethylmaleat als Zwischenprodukt verwenden und alternative Wege zu 1,4-Butandiol und Tetrahydrofuran (THF) bieten. Diese Methoden bieten auch die Möglichkeit, Butyrolacton, ein Zwischenprodukt in der Reaktionssequenz, zu isolieren.
Ein bemerkenswertes Verfahren, das von Kvaerner Process Technology (jetzt Johnson Matthey Davy Technologies) entwickelt wurde, verwendet Dimethylmaleat als Ausgangsprodukt, das aus Maleinsäureanhydrid und Methanol unter Verwendung eines stark sauren Ionenaustauschkatalysators gewonnen wird.
Die anschließende Gasphasenhydrierung über einem kupferbasierten Katalysatorsystem bei Drücken von 2–8 MPa und Temperaturen von 150–250 °C ergibt eine Mischung der gewünschten Produkte: 1,4-Butandiol, THF, Butyrolacton, Spurenmengen Dimethyl Succinat (Zwischenprodukt) und n-Butanol als Hauptnebenprodukt.
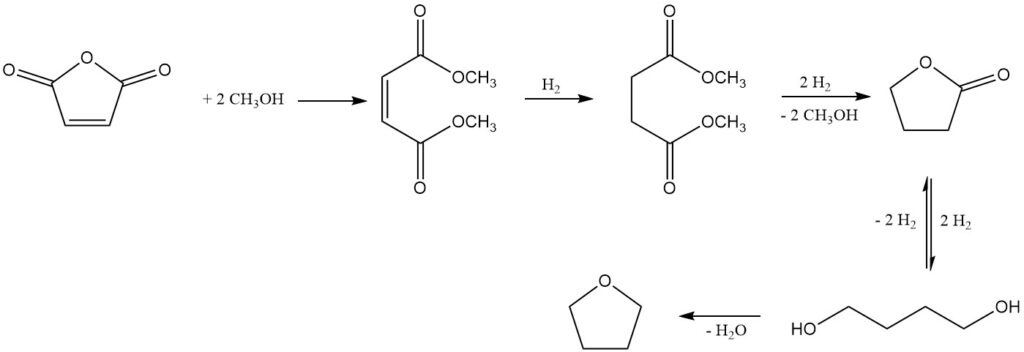
Butyrolacton und Dimethylsuccinat bilden ein azeotropes Gemisch, das ihre Rückgewinnung und Rückführung in die Hydrierungsstufe ermöglicht. Diese Recyclingstrategie fördert die vollständige Umwandlung in 1,4-Butandiol und THF. Alternativ kann das Azeotrop durch Destillation verfeinert werden, um reines Butyrolacton zu isolieren.
Die Butyrolacton-Ausbeute wird direkt durch den Betriebsdruck und die Temperatur während der Hydrierung beeinflusst, die das Gleichgewicht zwischen 1,4-Butandiol und Butyrolacton bestimmen. Unter den angegebenen Bedingungen können die Erträge zwischen 5 % und 50 % liegen.
Dieses innovative Verfahren hat großes kommerzielles Interesse geweckt, da KPT und JM Davy sich Lizenzen für den Bau mehrerer Butandiol-Butyrolacton-THF-Anlagen in Saudi-Arabien, Malaysia, Korea und China gesichert haben.
3.4. Herstellung von Butyrolacton durch biobasiertes Verfahren
Metabolix (jetzt Yield10 Bioscience, Inc.) entwickelte einen Fermentationsprozess zur Herstellung von Poly(4-hydroxybutyrat) (Polybutyrolacton) aus Zuckern. Dieses Polymer kann bei Temperaturen über 200 °C zu Butyrolacton depolymerisiert werden, wobei Calciumhydroxid optimale Ergebnisse erzielt.
Die verbleibende Biomasse wird in festen Brennstoff umgewandelt. Bis 2019 gibt es keine kommerzielle Anlage, die diese Methode nutzt.
BioAmber schlug einen biobasierten Weg vor, bei dem Zucker zu Bernsteinsäure-Diammoniumsalz fermentiert wird. Durch die anschließende Ammoniakentfernung entsteht Bernsteinsäure, die in Gegenwart eines Edelmetallkatalysators neben 1,4-Butandiol und Tetrahydrofuran zu Butyrolacton hydriert werden kann. Dieses Verfahren hat noch keine kommerzielle Anwendung gefunden.
Obwohl dies keine kommerzielle Bedeutung hat, hat die Forschung verschiedene alternative Wege für die Butyrolacton-Synthese aus Tetrahydrofuran, Dihydrofuran, Acetylen, Butindiol, Olefinen, Butadien oder durch Carbonylierung untersucht.
4. Verwendung von Butyrolacton
Die Vielseitigkeit von Butyrolacton geht weit über seine Rolle als einfaches chemisches Zwischenprodukt hinaus. Seine Anwendungen erstrecken sich über verschiedene Bereiche, von pharmazeutischen Formulierungen über die Polymerwissenschaft bis hin zu neuen Technologien in der Elektronik.
Butyrolacton dient als entscheidender Baustein für verschiedene Chemikalien, darunter N-Methylpyrrolidon (NMP) und Pyrrolidon, die beide ihre eigenen bedeutenden Verwendungsmöglichkeiten haben. Es wird auch bei der Synthese von Phenoxyherbiziden wie MCPB (γ-2-Methyl-4-chlorphenoxybuttersäure) und Wachstumsregulatoren verwendet.
Es ist ein Zwischenprodukt bei der Produktion von α-Acetobutyrolacton, einem wichtigen Schritt in der Vitamin-B1-Synthese. Butyrolacton wird auch zur Herstellung von Thiodibuttersäure verwendet, einem wertvollen Zusatzstoff bei der Gummiherstellung.
Es ist ein Lösungsmittel, das verschiedene Polymere auflösen kann und so deren Verarbeitung und Manipulation erleichtert. Darüber hinaus ist es ein wertvoller Katalysator für spezifische Polymerisationsreaktionen.
Butyrolacton trägt zur Formulierung von Haarwellmitteln, Sonnenlotionen, anderen Körperpflegeprodukten und in Arzneimitteln bei.
Weitere Anwendungen von Butyrolacton sind: als Lösungsmittel in Tintenstrahldrucktinten, als Extraktionsmittel in der Erdölindustrie, als Stabilisator für Chlorkohlenwasserstoffe und phosphorbasierte Pestizide sowie als Nematozid.
Aufgrund seiner einzigartigen Eigenschaften ist es ein vielversprechendes Co-Lösungsmittel für Kondensatorelektrolyte in der Elektronikindustrie und kann möglicherweise in Fotolacken eingesetzt werden.
5. Toxikologie und Arbeitsmedizin
Absorption und Stoffwechsel:
- Butyrolacton wird leicht über den Darm und die Haut absorbiert. Seine orale Halbwertszeit beträgt bei Ratten etwa 20 Minuten.
- Stoffwechsel und Ausscheidung erfolgen schnell und ergeben hauptsächlich γ-Hydroxybuttersäure als Hauptmetaboliten.
- Bei Menschen berichten Studien über (S)-3,4-Dihydroxybutyrat, Glykolsäure und andere Metaboliten im Urin nach der Einnahme.
Akute Toxizität:
- Butyrolacton weist eine geringe akute Toxizität auf, mit LD50-Werten zwischen 800 und 1800 mg/kg bei Nagetieren und 500-1700 mg/kg bei Meerschweinchen.
- Dermale LD50 bei Meerschweinchen beträgt 5600 mg/kg.
- Der inhalative LC50 (Ratte, 4 Stunden) übersteigt die höchste getestete nicht-tödliche Konzentration (>5,1 mg/L).
- Inhalation bei Raumtemperatursättigung zeigt bei Ratten keine schädlichen Auswirkungen [BASF, (1960) unveröffentlichte Ergebnisse].
Neurologische Auswirkungen:
- Die Depression des zentralen Nervensystems (ZNS) von Butyrolacton erfolgt durch seinen Metaboliten, γ-Hydroxybuttersäure, mit zusätzlicher betäubender Wirkung auf das periphere Nervensystem.
- Dosen von 2500 mg führten bei erwachsenen Menschen zu vorübergehendem Schlaf.
- Dosen von 66 mg/kg bei Kindern zur Anästhesie führten zu tiefem Schlaf mit gelegentlicher Atemdepression.
- Höhere versehentliche orale Dosen verursachten bei Erwachsenen und Säuglingen eine durch ZNS-Depression verursachte Bewusstlosigkeit, gelegentlich Koma, Bradykardie und Atemdepression. Mit unterstützender Behandlung erholten sich die Patienten innerhalb von 24 Stunden vollständig.
Lokale und hautbezogene Auswirkungen:
- Butyrolacton reizt die Haut nicht, reizt jedoch die Augen bei Kaninchen mäßig [BASF, (1960) unveröffentlichte Ergebnisse].
- Keine Hautsensibilisierung bei Meerschweinchen beobachtet.
- Patchtests bei 200 Freiwilligen ergaben keine Hautreaktionen.
- Butyrolactonhaltige Lotionen sind für die topische Anwendung gut verträglich.
- Es hat als erfolgreiches topisches Analgetikum bei Schmerzen des Bewegungsapparates, Kopfschmerzen und Migräne gedient.
Chronische und Karzinogenitätsstudien:
- Eine längere orale Verabreichung von 3 g/kg täglich über vier Wochen führte bei Ratten zu einer ZNS-Depression, jedoch ohne weitere signifikante Auswirkungen.
- Studien mit wiederholter Gabe zeigten eine etwas höhere Toxizität im Vergleich zur Sondenernährung mit möglichen Boluseffekten.
- Zahlreiche Studien zur Mutagenität und Genotoxizität weisen auf kein genotoxisches Potenzial hin.
- Langzeitstudien zur Karzinogenität an Ratten und Mäusen bei hohen Dosen ergaben keine Hinweise auf ein tumorerzeugendes Potenzial.
- Frühe dermale und orale Studien zeigten ebenfalls keine krebserzeugende Wirkung.
- Insgesamt deuten die Beweise darauf hin, dass mit Butyrolacton kein signifikantes krebserzeugendes Risiko verbunden ist.
Auswirkungen auf Entwicklung und Fortpflanzung:
- Pränatale Exposition bei Ratten und Kaninchen über orale und inhalative Verabreichung zeigte keine substanzbedingten Auswirkungen auf die Entwicklung (BASF AG, (1993) unveröffentlichte Ergebnisse).
Berufliche Exposition:
- In Europa und den USA gibt es keine spezifischen Arbeitsplatzgrenzwerte für Butyrolacton.
Umweltauswirkungen:
- Daten zur akuten Toxizität und schnelle biologische Abbaubarkeit lassen auf ein minimales Umweltrisiko schließen.
Referenz
- Butyrolactone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_495.pub2
