Acetylen
Acetylen, auch Ethin genannt, ist ein farbloses, brennbares Gas mit der chemischen Formel C2H2. Es ist der einfachste Kohlenwasserstoff mit einer Dreifachbindung. Aufgrund seiner unglaublich heißen Flamme wird es häufig als Brennstoff beim Autogenschweißen und -schneiden sowie als chemischer Baustein für verschiedene organische Chemikalien und Kunststoffe verwendet.
Acetylen war der Hauptbaustein der industriellen organischen Chemie, bevor Öl als Hauptrohstoff weit verbreitet wurde. Bis in die 1940er Jahre dominierte ausschließlich das Calciumcarbid-Verfahren die Acetylenproduktion, als thermische Crackverfahren unter Verwendung von Methan und andere Kohlenwasserstoffe entstanden.
Anfängliche Implementierungen verwendeten elektrische Lichtbögen, doch in den 1950er Jahren kam es zur Entwicklung partieller Oxidations- und Regenerationsprozesse.
Trotz vielversprechender Initiativen wie dem Submers Flame-Verfahren von BASF, dem HTP von Hoechst und dem Plasmaverfahren von Hüls blieb der Trend hin zu Ethylen als Grundchemikalie ungebrochen.
Alle Acetylenverfahren, einschließlich Karbidverfahren, sind energieintensiv und erfordern eine erhebliche Wärmeerzeugung und -übertragung. Sie unterscheiden sich vor allem darin, wie diese Energie erzeugt und eingesetzt wird.
- Einen vollständigen Artikel über die industrielle Produktion von Acetylen finden Sie unter folgender Link.
- Ausführliche Informationen über die Verwendung von Acetylen finden Sie unter folgender Link.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Acetylen
Acetylen hat eine Kohlenstoff-Kohlenstoff-Dreifachbindung (C≡C), die sich durch eine kurze Länge (0,1205 nm) und eine hohe Bildungsenergie auszeichnet. Diese Konfiguration macht Acetylen aufgrund seiner ungesättigten Natur äußerst instabil und reaktiv.
Der saure Wasserstoff der C-H-Bindungen (pKa=25) trägt zur Reaktivität von Acetylen bei. Es ist saurer als Ethylen (pKa=44) und kann mit starken Basen Acetylide bilden.
Unter normalen Bedingungen ist Acetylen ein farbloses, ungiftiges Gas mit narkotischen Eigenschaften. Es ist etwas leichter als Luft und besitzt bestimmte physikalische Eigenschaften, die in Tabelle 1 aufgeführt sind.
| Eigenschaft | Wert |
|---|---|
| Molekularmasse | 26.0379 |
| Kritische Temperatur | 308,32 K (35,17 °C) |
| Kritischer Druck | 6,139 MPa |
| Kritisches Volumen | 0,113 m3/kmol |
| Triple Point | 192,4 K (−80,75 °C) |
| Dreipunktdruck | 128,3 kPa |
| Normaler Sublimationspunkt und normaler Siedepunkt | 189,15 K (−84,0 °C) |
| Kristallübergangspunkt | 133,0 K (−140,15 °C) |
| Übergangsenthalpie | 2,54 kJ/mol |
| Dichte |
760,2 kg/m3 (131 K) 764,3 kg/m3 (141 K) |
| Dichte (flüssiges C2H2) | 465,2 kg/m3 (273,15 K) |
| Dichte (gasförmiges C2H2 bei 1 bar) | 1,095 kg/m3 (288,15 K) |
| Molekularvolumen (0 °C, 1,013 bar) | 22,223 m3/kmol |
| Verdampfungsenthalpie (berechnet) | 10,65 kJ/mol (273,15 K) |
| Sublimationsenthalpie | 21,168 kJ/mol (5,55 K) |
| Bildungsenthalpie | 227,5 ± 1,0 kJ/mol (298,15 K) |
| Gibbs freie Bildungsenergie | 209,2 ± 1,0 kJ/mol (298,15 K) |
| Entropie der Bildung | 200,8 J mol−1 K−1 (298,15 K) |
| Verbrennungsenthalpie | −1255,6 kJ/mol (298,15 K) |
| Höherer Heizwert | 50 400 kJ/kg |
| Unterer Heizwert | 48.700 kJ/kg |
| Dampfdruck | 2,6633 MPa (273,15 K) |
| Wärmeleitfähigkeit (0 °C, 1,013 bar) | 0,0184 W m−1 K−1 |
| Wärmekapazität (idealer Gaszustand) | 43,990 J mol−1 K−1 (298,15 K) |
2. Chemische Reaktionen von Acetylen
Aufgrund seiner hohen Ungesättigtheit und positiven freien Bildungsenergie ist Acetylen gegenüber verschiedenen Elementen und Verbindungen hochreaktiv. Diese Eigenschaft macht es zu einem vielseitigen Rohstoff für zahlreiche Stoffe. Zu den wichtigsten Reaktionstypen gehören Additionsreaktionen, Wasserstoffsubstitutionen, Polymerisation und Cyclisierung.
Acetylen ist im Vergleich zu Ethylen anfälliger für nukleophile Angriffe. Darüber hinaus verleiht ihm seine polarisierte C-H-Bindung (pKa ≈ 25) saure Eigenschaften, was die Löslichkeit in basischen Lösungsmitteln und die Bildung von Wasserstoffbrückenbindungen erleichtert. Dieses Verhalten weicht vom Raoultschen Gesetz für acetylenhaltige Lösungen ab.
Die Entwicklung von Acetylen-Druckreaktionen durch W. Reppe markierte einen Durchbruch in der Acetylenchemie. Zu den bemerkenswerten Reaktionsgruppen gehören Vinylierung, Ethinylierung, Carbonylierung sowie zyklische und lineare Polymerisation.
2.1. Industriell wichtige Reaktionen
1. Vinylierung:
Bei der Vinylierung werden Verbindungen mit beweglichen Wasserstoffatomen (Wasser, Alkohole, Thiole, Amine usw.) an Acetylen addiert, wodurch Vinylderivate entstehen, die hauptsächlich für die Polymerisation verwendet werden.
Es gibt zwei Arten: Heterovinalierung (Wasserstoff aus O, S oder N) und C-Vinylierung (direkt gebundener Kohlenstoffwasserstoff). Beispiele hierfür sind Acetylendimerisierung, Trimerisierung, Acrylnitrilsynthese und Addition an reaktive ungesättigte Kohlenwasserstoffe wie Cyclopentadien.
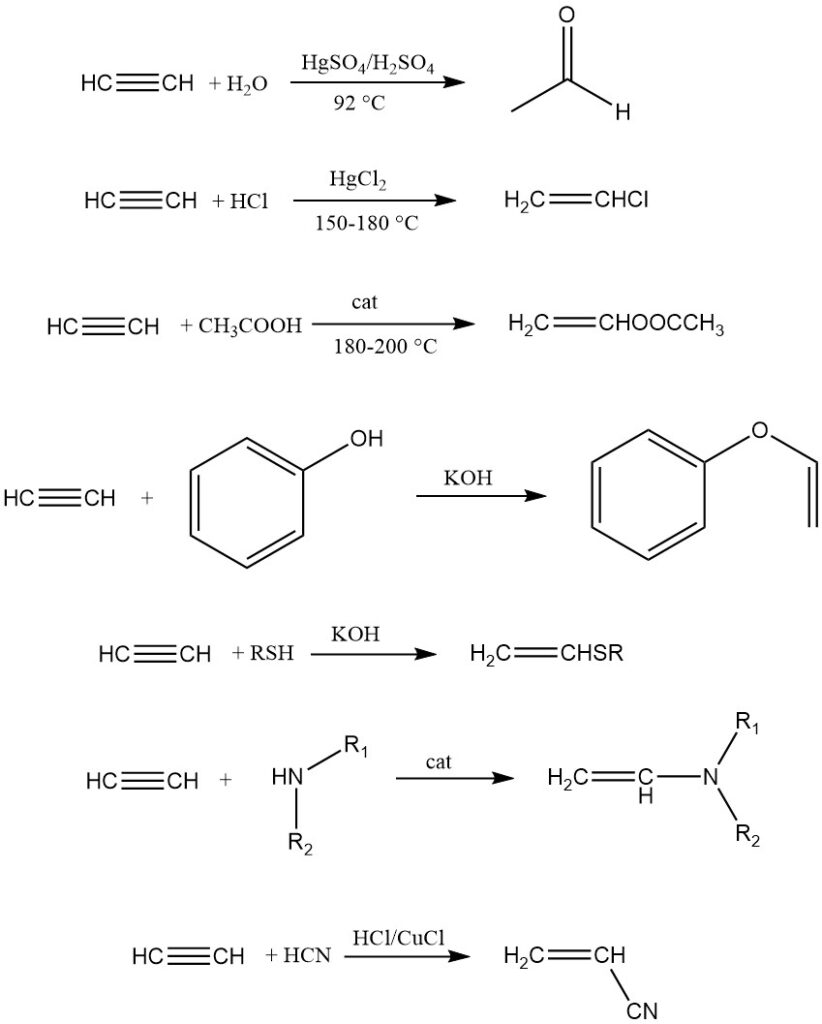
2. Ethinylierung:
Durch die Ethinylierung werden Carbonylverbindungen an Acetylen hinzugefügt, während die Dreifachbindung erhalten bleibt. Reppe entdeckte, dass Schwermetallacetylide, insbesondere Cu₂C₂·2H₂O·2C₂H₂, die Reaktion mit Aldehyden effektiv katalysieren.
Die Ethinylierung von Ketonen wird mit alkalischen Katalysatoren katalysiert. Das allgemeine Reaktionsschema ist:

Propargylalkohol und Butindiol sind Schlüsselprodukte dieser Reaktion.

3. Carbonylierung:
Bei der Carbonylierung handelt es sich um die Reaktion von Acetylen und Kohlenmonoxid mit Verbindungen mit beweglichen Wasserstoffatomen, katalysiert durch Metallcarbonyle (z. B. Ni(CO)₄). Es können auch Metallhalogenide verwendet werden, die zur Bildung von Carbonylen fähig sind.
Acrylsäure ist ein bekanntes Produkt, das unter Verwendung des Ni(CO)₄-Katalysators aus Acetylen, Wasser und Kohlenmonoxid gewonnen wird. Weitere Produkte der Acetylencarbonylierung sind Thioester der Acrylsäure, Acrylamide, Carbonsäureanhydride und Hydrochinon.

4. Cyclisierung und Polymerisation:
Acetylen kann unter geeigneten Katalysatoren eine Cyclisierung und lineare Polymerisation eingehen. Berthelot beobachtete als erster eine Cyclisierung, die zu einer Mischung aromatischer Verbindungen wie Benzol und Naphthalin führte. Reppe synthetisierte später 1,3,5,7-Cyclooctatetraen mit hoher Ausbeute (70 %).
Bei Kupfer(I)-Salzen erfolgt eine lineare Polymerisation, die zu Vinylacetylen, Divinylacetylen usw. führt. Ein bemerkenswertes Beispiel ist Cupren, das durch Erhitzen von Acetylen mit Kupferschwamm entsteht. Ziegler-Natta-Katalysatoren erleichtern die Bildung von Polyacetylen, das beim Dotieren einzigartige Eigenschaften wie Leitfähigkeit aufweist.

2.2. Andere Reaktionen und Derivate
1. Metallacetylide:
Acetylen bildet Metallacetylide, indem es seine Wasserstoffatome durch Metallatome (M) ersetzt. Alkali- und Erdalkaliacetylide werden durch Metallamide oder direkte Reaktion mit geschmolzenen oder fein verteilten Metallen hergestellt.

Explosive Kupferacetylide (Cu₂C₂·H₂O) entstehen durch Reaktion von Kupfer(I)-Salzen mit Acetylen in flüssigem Ammoniak oder Kupfer(II)-Salzen mit Acetylen in basischer Lösung mit Reduktionsmitteln wie hydroxylamin.
Darüber hinaus können sich Kupferoxide und andere Kupfersalze leicht in Acetylide umwandeln. Aufgrund dieser Reaktivität sollten Kupferleitungen in Acetylensystemen strikt vermieden werden. Weitere explosive Metallacetylide gibt es für Silber, Gold und Quecksilber.
2. Halogenierung:
Chlor addiert sich mit FeCl₃ als Katalysator zu Acetylen und ergibt 1,1,2,2-Tetrachlorethan, ein wichtiges Zwischenprodukt bei der Lösungsmittelherstellung. Brom und Jod können ebenfalls an Additionsreaktionen teilnehmen, wobei Jod bei 1,2-Dijodethylen stoppt.
3. Hydrierung:
Acetylen wird an Pt-, Pd- oder Ni-Katalysatoren teilweise oder vollständig hydriert, was zu Ethylen oder Ethan führt.
4. Organische Siliziumverbindungen:
Mithilfe von Platinkatalysatoren in der flüssigen Phase können Silane zu Acetylen addiert werden, wodurch siliciumhaltige Derivate entstehen.
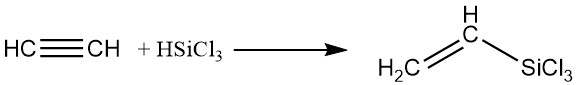
5. Oxidation:
Acetylen ist bei Raumtemperatur oxidationsbeständig, bildet jedoch mit Luft oder Sauerstoff explosionsfähige Gemische. Oxidationsmittel wie Ozon oder Chromsäure wandeln es in Ameisensäure, Kohlendioxid und andere Produkte um. Die Reaktion mit verdünntem Ozon ergibt Glyoxal.
6. Spendet Feuchtigkeit:
Unter Druck und Temperaturen unter etwa 15 °C bildet Acetylen wachsartige Hydrate mit der Zusammensetzung C₂H₂·6H₂O. Diese clathratähnlichen Strukturen binden Wassermoleküle in ihr Kristallgitter ein und beeinflussen so die Lagerung und Handhabung von Acetylen. Hydratbildung kann zu Geräteverstopfungen führen und Zersetzungsrisiken durch Stoßwellen mit sich bringen.
7. Chloracetylene:
7.1. Monochloracetylen (HC≡CCl):
Monochloracetylen ist ein Gas mit einem ekelerregenden Geruch, der die Schleimhäute reizt. Es wird durch Reaktion von 1,2-Dichlorethylen mit alkoholischem NaOH in Gegenwart von Hg(CN)₂ gewonnen. Es ist leicht entflammbar, explodiert bereits in Gegenwart von Spuren von Sauerstoff oder Luft und ist extrem giftig.
7.2. Dichloracetylen (ClC≡CCl):
Dichloracetylen ist ein farbloses Öl mit unangenehmem Geruch, das an der Luft oder beim Erhitzen explodiert. Es wird aus Acetylen in einer stark alkalischen Kaliumhypochloritlösung oder durch Reaktion von Trichlorethylendampf mit Ätzalkali hergestellt. Es ist hochexplosiv und zersetzt sich leicht, was erhebliche Sicherheitsbedenken mit sich bringt.
3. Toxikologie von Acetylen
Reines Acetylen wirkt als einfaches Erstickungsmittel, indem es den Sauerstoff in der Atmosphäre verdrängt. Kommerzielles Acetylen enthält jedoch keine nennenswerten Mengen an giftigen Verunreinigungen wie Arsin, Schwefelwasserstoff und Phosphin mehr, die in der Vergangenheit zu gesundheitsschädlichen Auswirkungen durch die Exposition gegenüber Acetylen, das aus Carbid-Kalzium hergestellt wird, beigetragen haben.
Die niedrigste dokumentierte tödliche Konzentration (LC) für Ratten beträgt 9 Vol.-% in der Luft. Hunde weisen eine höhere Toleranz auf und benötigen 80 % Acetylen, um eine Narkose mit erhöhtem Blutdruck und verringerter Pulsfrequenz auszulösen (was auf eine vasomotorische und Vagusnervstimulation hinweist).
Beim Menschen führt das Einatmen von 10 % Acetylen zu einer leichten Vergiftung, während 20 % zu einer erheblichen Vergiftung und 30 % zu Koordinationsstörungen führen. Bei 35 % Exposition kommt es innerhalb von 5 Minuten zur Bewusstlosigkeit.
Tödliches Einatmen betrifft 35 % für 5–10 Minuten oder 10 % für 30–60 Minuten. Zu den Symptomen einer Vergiftung zählen Erregung, Koma, Zyanose, schwacher/unregelmäßiger Puls und Gedächtnisverlust.
Keine Hinweise deuten auf gesundheitsschädliche Auswirkungen einer wiederholten Exposition gegenüber tolerierbaren Acetylenwerten hin. Interessanterweise zeigten Humanstudien eine verringerte Anfälligkeit bei wiederholter Exposition.
Während 33 % Acetylen zunächst innerhalb von 6 Minuten zu Bewusstlosigkeit führten, erforderten nachfolgende Expositionen innerhalb derselben Woche längere Dauern (9 Minuten beim zweiten und über 33 Minuten beim dritten). um den gleichen Effekt zu erzielen.
Im Gegensatz zu einigen anderen Gasen reizt Acetylen die Schleimhäute nicht. Insbesondere wurde für Acetylen kein Grenzwert (TLV) oder maximal zulässige Konzentration (MAK) festgelegt.
Die aktuelle Occupational Safety and Health Administration (OSHA) und das National Institute for Occupational Safety and Health ( NIOSH) Der zulässige Expositionsgrenzwert (PEL) beträgt 2500 ppm (parts per million) in der Luft.
Referenz
- Acetylen; Ullmanns Enzyklopädie der industriellen Chemie. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_097.pub4
