3-Hydroxybenzoesäure: Herstellung, Reaktionen und Verwendung

3-Hydroxybenzoesäure ist eines von drei Isomeren der Hydroxybenzoesäure, die anderen beiden sind 2-Hydroxybenzoesäure und 4-Hydroxybenzoesäure. Sie ist auch als m-Hydroxybenzoesäure oder m-Salicylsäure bekannt. Es ist ein weißer, geruchloser Feststoff, der in Wasser und Ethanol löslich ist.
Inhaltsverzeichnis
Vorkommen von 3-Hydroxybenzoesäure in Pflanzen
3-Hydroxybenzoesäure ist ein Naturprodukt, das in verschiedenen Pflanzen vorkommt, wie zum Beispiel:
- Vanille: Die Vanilleschote enthält etwa 2 % 3-Hydroxybenzoesäure, die zu ihrem charakteristischen Geschmack und Aroma beiträgt.
- Himbeere: Die Himbeerfrucht enthält etwa 0,2 % 3-Hydroxybenzoesäure, was ihr einen säuerlichen Geschmack und eine rote Farbe verleiht.
- Tee: Die Teeblätter enthalten etwa 0,1 % 3-Hydroxybenzoesäure, die als Antioxidans und Konservierungsmittel wirkt.
1. Physikalische Eigenschaften von 3-Hydroxybenzoesäure
3-Hydroxybenzoesäure ist ein nicht brennbarer Feststoff. Es ist ein hygroskopischer und nichtflüchtiger Feststoff, der relativ stabil ist, sich jedoch zersetzen kann, wenn es über seinen Schmelzpunkt erhitzt wird. 3-Hydroxybenzoesäure ist in unpolaren Lösungsmitteln wie Hexan und Chloroform unlöslich.
Einige der physikalischen Eigenschaften von 3-Hydroxybenzoesäure sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Summenformel | C7H6O3 |
| Molekulargewicht | 138,12 g/mol |
| Aussehen | Weiße Nadeln (bei Kristallisation aus Wasser) oder rhombische Prismen (bei Kristallisation aus Alkohol) |
| Schmelzpunkt | 203 °C |
| Siedepunkt | 297 °C |
| Dichte | 1,473 g/cm³ bei 25°C |
| Dissoziationskonstanten | K1 = 8,71 × 10⁻⁵ und K2 = 1,18 × 10⁻¹⁰ bei 19 °C |
| Löslichkeit | 6,11 g in 100 g Wasser bei 69 °C
39,6 g in 100 g 98 %igem Ethanol bei 65 °C 20,7 g in 100 g n-Butanol bei 36,5°C |
2. Chemische Reaktionen von 3-Hydroxybenzoesäure
3-Hydroxybenzoesäure ist bei hohen Temperaturen stabil und bleibt selbst bei 300 °C unverändert. Dies ist eine einzigartige Eigenschaft, die ihre Gegenstücke, die 2- und 4-Hydroxybenzoesäuren, nicht haben.
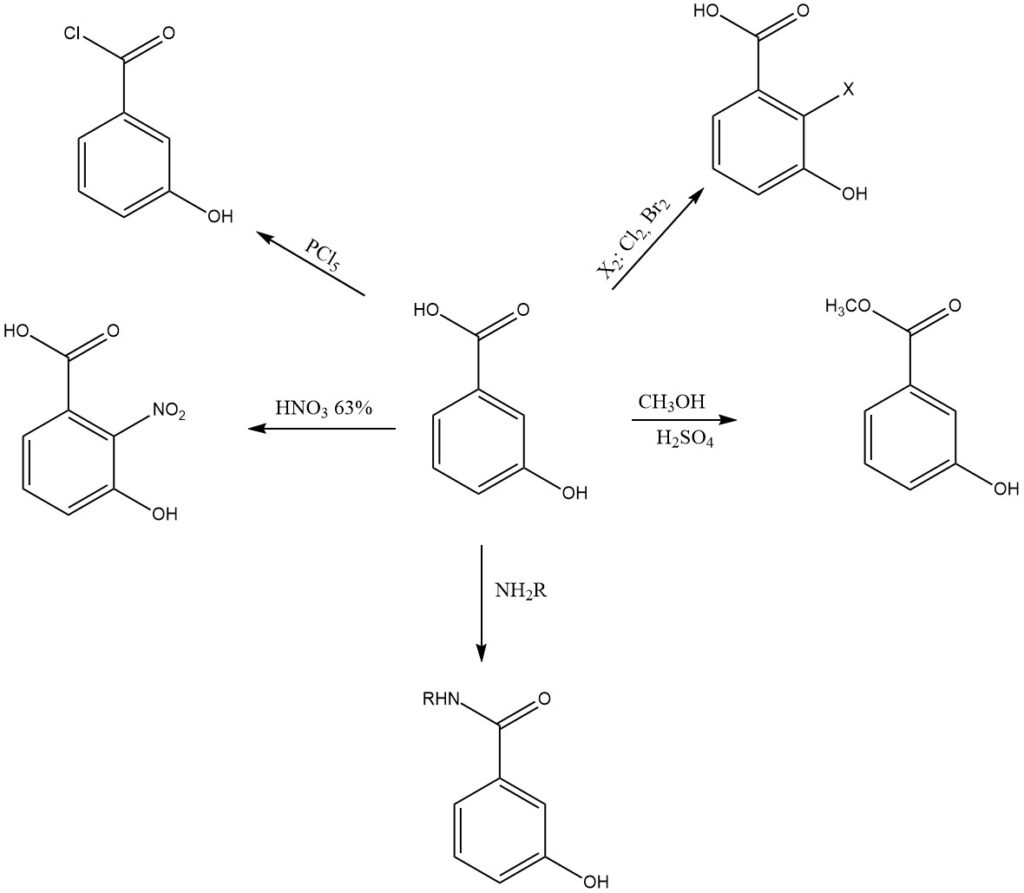
Wenn 3-Hydroxybenzoesäure elektrophilen Substitutionsreaktionen wie Nitrierung, Halogenierung oder Sulfonierung unterliegt, finden die Reaktionen hauptsächlich an den ortho- oder para-Positionen relativ zur Hydroxylgruppe statt.
Beispielsweise entsteht bei der Nitrierung von 3-Hydroxybenzoesäure mit 62 %iger wässriger Salpetersäure als Hauptprodukt 2-Nitro-3-hydroxybenzoesäure sowie kleinere Mengen an 4-Nitro- und 6-Nitro-3-hydroxybenzoesäure.
Durch die Veresterung von 3-Hydroxybenzoesäure entstehen verschiedene Ester, darunter Methyl-3-hydroxybenzoat, Ethyl-3-hydroxybenzoat und Propyl-3-hydroxybenzoat. Diese Ester werden als Konservierungsmittel, Duftstoffe und Geschmacksstoffe verwendet.
3-Hydroxybenzoesäure kann zu einer Vielzahl von Amiden amidiert werden, darunter 3-Hydroxybenzamid und 3-Hydroxy-N-methylbenzamid. Diese Amide werden in einer Vielzahl von Anwendungen eingesetzt, unter anderem als Pharmazeutika, Farbstoffe und Pigmente. Es kann zu 3-Hydroxybenzylalkohol reduziert werden.
Bei der Reaktion mit Phosphorpentachlorid entsteht 3-Hydroxybenzoylchlorid. Dieses Acylchlorid wird bei der Synthese verschiedener Ester, Amide und anderer Derivate verwendet. Es reagiert auch mit Natriumhydroxid unter Bildung von Natrium-3-hydroxybenzoat.
3. Herstellung von 3-Hydroxybenzoesäure
3-Hydroxybenzoesäure kann auf verschiedene Arten hergestellt werden:
3.1. Alkalifusion von Natrium-3-sulfobenzoat
Eines der gebräuchlichsten Verfahren zur Herstellung von 3-Hydroxybenzoesäure ist die Alkalifusion von Natrium-3-sulfobenzoat, das mit Alkali bei 210–220 °C geschmolzen wird. Die resultierende rohe 3-Hydroxybenzoesäure wird nach Ansäuern ausgefällt und durch Umkristallisation aus Wasser mit Aktivkohle gereinigt. Dabei entsteht 3-Hydroxybenzoesäure mit einer Reinheit von etwa 90 %.

3.2. Reduktion von 3-Nitrobenzoesäureestern
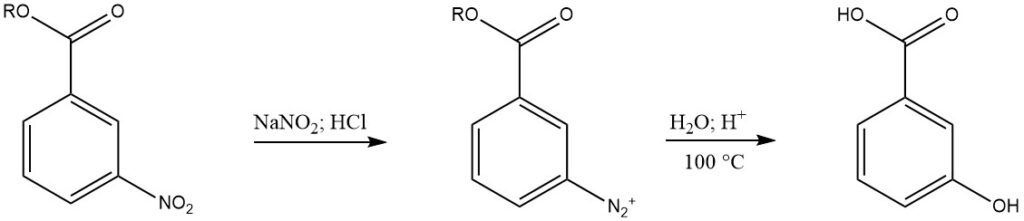
3-Nitrobenzoesäureester werden katalytisch zu Aminobenzoesäureestern hydriert und anschließend diazotiert. Das Diazoniumprodukt wird dann mehrere Stunden lang bei 100 °C mit 3-Nitrobenzoesäure mit Wasser und Schwefelsäure behandelt, gefolgt von Neutralisierung und Filtration. Bei dieser Methode entsteht 3-Hydroxybenzoesäure mit einer Reinheit von etwa 95 %.
3.3. Oxidation von 3-Methylphenol oder 3-Hydroxybenzaldehyd
3-Hydroxybenzaldehyd wird oxidiert, indem Luft durch eine heiße wässrige Natriumhydroxidsuspension geblasen wird, um 3-Hydroxybenzoesäure zu erzeugen.
Eine andere Methode ist die Oxidation von 3-Methylphenol mit Kaliumpermanganat in alkalischer Lösung, gefolgt von Ansäuern und Umkristallisieren, was 3-Hydroxybenzoesäure mit einer Reinheit von etwa 85 % ergibt.

3.4. Biosynthese
3-Hydroxybenzoesäure kann auch biosynthetisch durch Fermentation von Mikroorganismen wie Escherichia coli und Bacillus subtilis hergestellt werden. Diese Mikroorganismen wurden gentechnisch verändert, um 3-HBA aus Glucose, Glycerin oder 3-Chlorbenzoesäure zu produzieren.
Die durch Fermentation entstehende 3-Hydroxybenzoesäure kann dann gereinigt und gewonnen werden.
4. Verwendung von 3-Hydroxybenzoesäure
3-Hydroxybenzoesäure findet aufgrund ihrer vielseitigen Eigenschaften vielfältige Einsatzmöglichkeiten in verschiedenen Branchen:
- Pharmazeutika und Pestizide: 3-Hydroxybenzoesäure ist ein wichtiger Baustein bei der Synthese vieler Pharmazeutika und Pestizide.
- Augenheilkunde: 3-Hydroxybenzoesäureester werden zur Pupillenerweiterung bei ophthalmologischen Eingriffen und Untersuchungen eingesetzt.
- Verdauung: Natrium-3-hydroxybenzoat ist ein cholepoetisches Mittel, das heißt, es hilft bei der Produktion und dem Fluss von Galle, die für die Verdauung unerlässlich ist.
- Lebensmittelkonservierung: Ester und Metallsalze der 3-Hydroxybenzoesäure haben keimtötende und konservierende Eigenschaften, wodurch sie zur Verlängerung der Haltbarkeit von Lebensmitteln nützlich sind.
- Kunststoffe: Von 3-Hydroxybenzoesäure abgeleitete Etherester können als Weichmacher für Vinyl- und Zelluloseharze verwendet werden, wodurch diese flexibler und verarbeitbarer werden.
- Kosmetik: Ester der 3-Hydroxybenzoesäure werden in Kosmetika als Konservierungsmittel und UV-Absorber verwendet.
- Körperpflegeprodukte: 3-Hydroxybenzoesäure und ihre Derivate werden in Körperpflegeprodukten wie Zahnpasta, Mundwasser und Deodorant verwendet.
- 3-Hydroxybenzoesäure wird in der Textilindustrie als Farbstoffzwischenprodukt verwendet.
- Analytische Chemie: 3-Hydroxybenzoesäure wird in der analytischen Chemie als Reagenz zum Nachweis von Metallen und anderen Ionen verwendet.
3-Hydroxybenzoesäure wird auch auf ihren möglichen Einsatz bei der Behandlung verschiedener Krankheiten untersucht, darunter Krebs, Alzheimer und Parkinson.
5. Toxikologie von 3-Hydroxybenzoesäure
3-Hydroxybenzoesäure ist eine relativ sichere Chemikalie.
- LD50 (Ratte, i.p.) = 3700 mg/kg
- LD50 (Maus, oral) = 2 g/kg
- TDLo (Ratte, s.c., 11 Tage trächtig) = 400 mg/kg
- Einstufung: Arzneimittel, teratogen
- Gesundheitsschädlich beim Verschlucken
- Verursacht Hautreizungen
- Verursacht schwere Augenreizung
- Kann Reizungen der Atemwege verursachen
- Toxizität gegenüber Algen: Wachstumshemmung EC50 (Scenedesmus quadricauda) > 10 mg/L – 13 Tage
Verweise
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Process for making mu-hydroxybenzoates. – https://patents.google.com/patent/US3094558A/en
- https://www.sigmaaldrich.com/US/en/sds/SIAL/36333
- Establishing microbial co‐cultures for 3‐hydroxybenzoic acid biosynthesis on glycerol. – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6999546
The first step is a combination of liquid-liquid extraction and extractive distillation, particularly suited for low-isoprene C5 fractions. Preconcentration of isoprene occurs in the extractor, followed by crude isoprene removal from the extractive distillation column.
Subsequent extractive distillation removes piperylenes and cyclopentadiene. Final purification for polymerization grade isoprene is achieved in additional distillation columns. This process allows the processing of C5 fractions containing cyclopentadiene, which is removed with piperylenes.
The process can be adapted to isolate cyclopentadiene or cyclopentene with additional equipment, and pure piperylenes can be recovered with a supplementary column.
4. Uses of Isoprene
4.1. Use of Isoprene in Polymer Synthesis
Poly(cis-1,4-isoprene) (isoprene rubber, IR), particularly the titanium-catalyzed type, is the primary application of isoprene. This synthetic rubber closely resembles natural rubber in structure and properties. Isoprene rubber is mainly used in vehicle tire production.
Poly(trans-1,4-isoprene) has properties similar to gutta-percha or balata, limiting its commercial applications primarily to cable insulation and golf balls.
The second largest market for isoprene is the production of styrene-isoprene-styrene (SIS) block copolymers, a type of thermoplastic elastomer. Around 0.79–0.88 tons of isoprene are consumed per ton of SIS polymer. These copolymers are used as thermoplastic rubbers and pressure-sensitive or thermosetting adhesives.
Smaller quantities of isoprene are used in the production of butyl rubber (isobutene-isoprene rubber, IIR), a copolymer with isobutene. The isoprene content in butyl rubber ranges from 0.5 to 3.0 mol%. IIR is known for its low gas permeability, making it suitable for hoses and liners in tubeless tires.
Finally, hydrocarbon resins (petroleum resins) can be produced by copolymerizing isoprene from cyclopentadiene-free C5 crack fractions with other unsaturated C5 compounds.
4.2. Use of Isoprene in Terpene Synthesis
While isoprene undergoes various chemical reactions, only terpene synthesis is of industrial importance and is actively researched.
In 1972, Rhodia began developing a process for C10 terpene and derivative synthesis from isoprene, acetone, and acetylene. Isoprene reacts with hydrochloric acid to form prenyl chloride, which is then converted to dehydrolinalool in two steps.
Rhodia used dehydrolinalool for various syntheses but discontinued production. However, Kuraray in Japan continues to produce these compounds, squalane, and others from isoprene.
Rhodia previously used a Grignard synthesis to produce the C10 terpene alcohol lavandulol from two isoprene molecules.
Isoprene reacts via oligomerization or telomerization to form terpenes. Examples include the scientifically and industrially relevant linear oligomerization of isoprene to myrcene and the telomerization with N,N-diethylnerylamine (both C10 terpenes).
Naturally occurring terpenes consist of „head-to-tail“ arranged isoprene units with specific double bond positions. Producing terpenes from isoprene requires replicating this structure, making C10 terpene synthesis from isoprene generally less favorable than alternative routes. Catalyst composition can influence the structure of dimethyloctadienes synthesized from isoprene.
Takabe et al. reported myrcene synthesis by oligomerization of isoprene using a sodium/dialkylamine catalyst. Nissan Chemical Industries developed and announced the industrial production of myrcene using this method.
Isoprene telomerization occurs with various compounds, including ammonia or amines. The regioselectivity can be manipulated by varying the amount and concentration of Brønsted and Lewis acids in the catalyst.
Isoprene reacts with diethylamine to form N,N-diethylnerylamine via a butyl lithium-catalyzed telomerization reaction. Further reactions from N,N-diethylnerylamine yield linalool, geraniol, nerol, hydroxycitronellal, citronellal, and menthol (Figure 2).
The Takasago Perfumery Company in Japan uses an industrial synthesis for enantiomerically pure L-menthol from optically active citronellal. This process involves the asymmetric allylamine-enamine isomerization of N,N-diethylgeranylamine or N,N-diethylnerylamine with a Rh-BINAP catalyst.
5. Toxicology of Isoprene
Acute Toxicity
High-level isoprene exposure causes anesthetic effects in animals, leading to paralysis and death. Single 2-hour inhalation exposures in mice (56,000 mg/m³) showed no adverse effects. Levels of 98,000–126,000 mg/m³ induced deep narcosis, and exposure to 140,000 mg/m³ for 2 hours caused mortality (LC50 = 180,000 mg/m³ for rats).
The threshold concentration for irritation in cats is reported as 800 mg/m³. Oral and intraperitoneal LD50 values in male rats were determined to be 2100 mg/kg and 1400 mg/kg, respectively, for liquid isoprene. Single dermal exposure (1 mL/kg) in rats caused no mortality or adverse symptoms.
Repeated Exposure Toxicity
Rats and mice were exposed to 0, 438, 875, 1750, 3500, and 7000 ppm isoprene for two weeks via inhalation. Rats showed no exposure-related changes.
Mice exposed to 7000 ppm showed lower body weight gain, while all groups displayed anemia, testicular atrophy, olfactory epithelial degeneration, and epithelial hyperplastic changes in the stomach. Similar to 1,3-butadiene, mice appear to be more susceptible than rats.
Repeated dermal exposure (500 mg x 2 applications/day for 5 days) on rabbit ears caused only mild, reversible irritation. Long-term inhalation exposure data is unavailable.
Mutagenicity
Isoprene and its monoepoxides are not mutagenic in the Ames test. However, isoprene dioxide (2-methyl-1,2,3,4-diepoxybutane) exhibited mutagenicity in this test system.
Due to potential similarities with 1,3-butadiene in generating mutagenic metabolites, further evaluation of isoprene’s carcinogenicity is warranted.
Inhalational exposure of mice to 438–7000 ppm isoprene for 6 h/day over 12 days resulted in increased sister chromatid exchange frequencies, indicating cytogenetic effects.
Data on reproductive or teratogenic effects is unavailable.
Metabolism
Rodent mitochondrial fractions convert isoprene to its monoepoxides (3,4-epoxy-3-methyl-1-butene and 3,4-epoxy-2-methyl-1-butene), leading to corresponding diols. Minor oxidation of the more stable metabolite (3,4-epoxy-2-methyl-1-butene) to a diepoxide has been reported.
Isoprene undergoes a significant metabolism in the respiratory tract. Up to 300 ppm atmospheric isoprene exposure displays a direct proportionality between exposure concentration and metabolism. Saturation effects occur above 300–500 ppm. Mice metabolize isoprene at a faster rate than rats.
Endogenous isoprene synthesis has been observed. Synthesis rates in unexposed mice and rats are estimated to be 0.4 mmol h⁻¹ kg⁻¹ and 1.9 mmol h⁻¹ kg⁻¹, respectively.
Human Effects
At very high exposure levels, isoprene acts as a narcotic in humans. It may also irritate the skin, eyes, mucous membranes, and respiratory tract.
Hygienic Standards
No threshold limit value (TLV) or maximum allowable concentration (MAK) has been established for isoprene. The former Soviet Union set a threshold of 40 mg/m³.
References
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812
