Chlorure d’acétyle : propriétés, réactions, production et utilisations
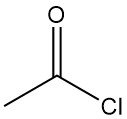
Qu’est-ce que le chlorure d’acétyle ?
Le chlorure d’acétyle, également appelé chlorure d’éthanoyle, est un composé organique de formule moléculaire CH3COCl. C’est un liquide incolore, corrosif et fortement irritant, à l’odeur suffocante.
Des concentrations de chlorure d’acétyle aussi faibles que 0,5 ppm provoquent un larmoiement et des brûlures aux yeux, aux voies nasales et à la gorge. Le chlorure d’acétyle est toxique car il réagit facilement avec les groupes hydroxyle, sulfhydryle et amino, produisant des modifications qui inhibent l’activité d’enzymes essentielles aux tissus vivants.
Table des matières
1. Propriétés physiques du chlorure d’acétyle
Le chlorure d’acétyle est un liquide incolore et corrosif. Ses principales propriétés physiques sont résumées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro de registre CAS | 75-36-5 |
| Formule moléculaire | C2H3OCl |
| Masse molaire (g/mol) | 78,50 |
| Point de congélation (°C) | -112,0 |
| Point d’ébullition (°C, 101,3 kPa) | 50,2 |
| Densité volumique (g/mL) à 4 °C | 1,1358 |
| Densité volumique (g/mL) à 20 °C | 1,1051 |
| Densité volumique (g/mL) à 25 °C | 1,0982 |
| Enthalpie standard de formation (ΔHf, kJ/mol) | -243,93 |
| Enthalpie de vaporisation au point d'ébullition (ΔHv, kJ/g) | 0,36459 |
| Indice de réfraction (nD20) | 1,38976 |
2. Réactions chimiques du chlorure d’acétyle
Le chlorure d’acétyle subit un large éventail de réactions chimiques et est utilisé en synthèse organique pour :
- Acétylation électrophile des arènes, alcènes, alcynes, alcanes saturés, organométalliques et énolates (sur C ou O)
- Clivage des éthers
- Estérification des alcools stériquement libres ou acido-sensibles
- Génération de solutions de chlorure d’hydrogène anhydre dans le méthanol
- Comme agent déshydratant
- Comme solvant pour Réactions organométalliques
- Pour la désoxygénation des sulfoxydes
- Comme piégeur de chlore et de brome
- Comme source de cétène
- Pour l’acétylation nucléophile
Dans des solvants inertes tels que le disulfure de carbone ou l’éther de pétrole, le chlorure d’acétyle réagit avec les hydrocarbures aromatiques et les oléfines pour produire des cétones. Ces réactions sont catalysées par des acides de Lewis, l’activité catalytique augmentant dans l’ordre suivant :
ZnCl2 < BiCl3 < TeCl4 < TiCl4 < SnCl4 < TeCl2 < FeCl3 < SbCl5 < AlCl3
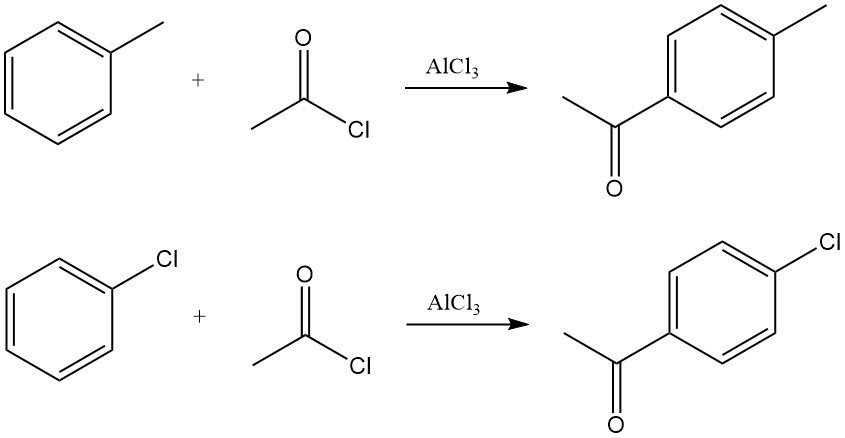
Les arènes réagissent avec le chlorure d’acétyle en présence d’acides de Lewis, généralement le chlorure d’aluminium, pour former des arylméthylcétones. La réaction se déroule par la génération de l’ion acylium, qui subit une substitution aromatique électrophile.
Par exemple, l’acétylation du toluène produit principalement de la p-méthylacétophénone, tandis que l’acétylation du chlorobenzène produit de la p-chloroacétophénone avec une sélectivité élevée.
Les alcènes réagissent avec le chlorure d’acétyle dans des conditions de Friedel-Crafts pour former des mélanges de chloroalkylméthylcétones et de produits apparentés. Les alcènes déficitaires en électrons, comme l’éthylène et le chlorure d’allyle, donnent de bons rendements, tandis que les alcènes supérieurs subissent souvent des réarrangements.
Par exemple, la réaction du chlorure d’acétyle avec le cyclohexène en utilisant AlCl3 comme catalyseur produit la 2-chlorocyclohexylméthylcétone et la 4-chlorocyclohexylméthylcétone.

Les alcynes subissent une acétylation électrophile dans des conditions similaires. L’acétylène traité par du chlorure d’acétyle et du chlorure d’aluminium produit de la β-chlorovinylméthylcétone, tandis que les alcynes supérieurs donnent des produits cétoniques avec des rendements moyens à élevés.
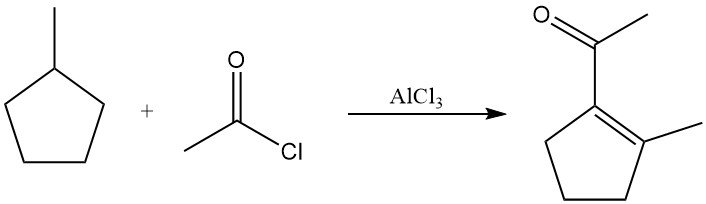
En présence de chlorure d’acétyle et de chlorure d’aluminium à température élevée, les alcanes saturés subissent une déshydrogénation en alcènes suivie d’une acétylation. Les produits sont généralement des vinylméthylcétones ou des alkylméthylcétones saturées. Le méthylcyclopentane, par exemple, produit du 1-acétyl-2-méthylcyclopentène avec un rendement significatif.
Le chlorure d’acétyle réagit avec une large gamme de composés organométalliques, notamment les réactifs de Grignard, les organolithiens, les organozinciens et les organocuprates, pour former des méthylcétones. Des catalyseurs à base de métaux de transition, tels que les sels de palladium ou de cuivre, sont souvent utilisés pour améliorer la sélectivité et les rendements.
Les énolates métalliques réagissent avec le chlorure d’acétyle pour former des β-dicétones. La réaction peut également donner des produits O-acétylés concurrents, selon le contre-ion métallique. L’utilisation d’énolates de zinc ou de cuivre améliore la sélectivité pour la C-acétylation. Parmi les transformations associées, on peut citer l’acétylation des acétals et des énamines de silylcétènes, donnant accès à des esters et des cétones fonctionnalisés.
Les cétones et les β-céto-esters peuvent être convertis en acétates d’énols à l’aide de chlorure d’acétyle. La réaction peut se dérouler via des énolates préformés ou des éthers d’énols silylés. Par exemple, les cétones stéroïdiennes peuvent être converties en acétates d’énols conjugués par traitement au chlorure d’acétyle en présence de bases aminés.
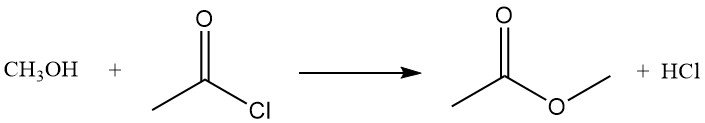
Le chlorure d’acétyle réagit avec les alcools pour former des esters ou des chlorures d’alkyle. Les alcools primaires forment généralement des esters, tandis que les alcools secondaires et tertiaires donnent souvent des chlorures par substitution. La réaction du méthanol avec le chlorure d’acétyle produit de l’acétate de méthyle et du chlorure d’hydrogène, et est utilisée pour préparer des solutions de chlorure d’hydrogène anhydre dans le méthanol.
Les éthers cycliques et acycliques peuvent être clivés par le chlorure d’acétyle en présence de sels d’halogénure ou d’acides de Lewis. Par exemple, le tétrahydrofurane réagit avec le chlorure d’acétyle et l’iodure de sodium pour former de l’acétate de 4-iodobutyle, et en présence d’un acide de Lewis tel que ZnCl2 pour former de l’acétate de chlorobutyle avec un rendement d’environ 76 %.
Cette propriété rend le chlorure d’acétyle utile pour la déprotection des groupes protecteurs éthers.

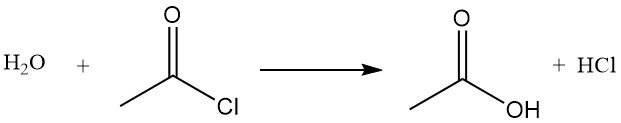
Le chlorure d’acétyle agit comme déshydratant en réagissant avec l’eau pour former de l’acide acétique et du chlorure d’hydrogène. Il favorise la cyclisation des acides dicarboxyliques en anhydrides, des cétoacides en lactones et des composés nitrés en oxydes de nitrile.
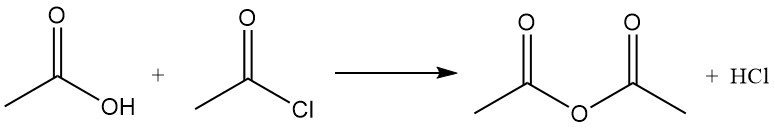
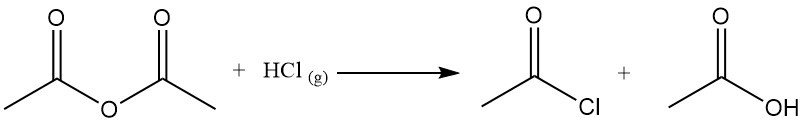
Il est également utilisé dans la conversion des hydroperoxydes en cétones insaturées. Par exemple, il réagit avec l’acide acétique pour produire de l’anhydride acétique.
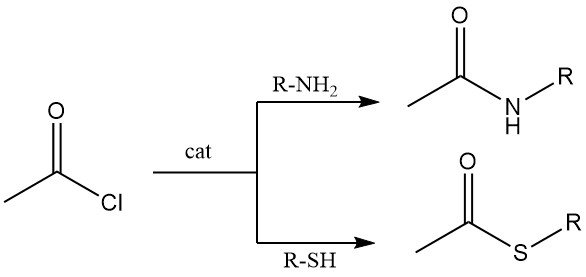
Les amines primaires et secondaires réagissent avec le chlorure d’acétyle pour former des acétamides. Dans des conditions de Schotten-Baumann (base aqueuse), la N-acétylation est efficace, bien que l’hydrolyse du chlorure d’acétyle puisse entrer en compétition.
Les amines tertiaires produisent des sels d’acétylammonium, qui peuvent se décomposer en cétènes ou subir une fragmentation de von Braun. Des réactions apparentées incluent la N-acétylation des imines en énamides et la conversion des uréthanes en imides.
Les thiols réagissent avec le chlorure d’acétyle pour former des thioesters. Les thiols aliphatiques et aromatiques subissent cette transformation, généralement en présence de chlorure de cobalt comme catalyseur.
Le chlorure d’acétyle forme des adduits réversibles avec les aldéhydes et les cétones en présence d’acides de Lewis, produisant des acétates d’α-chloroalkyle. Par exemple, l’acétone réagit avec le chlorure d’acétyle et le chlorure de zinc à basse température pour former l’adduit correspondant avec un bon rendement.
Les sulfoxydes sont réduits en sulfures par le chlorure d’acétyle en présence de chlorure d’étain(II). La réaction se déroule dans des conditions douces et est compatible avec les groupes fonctionnels sensibles, notamment les dérivés des céphalosporines.
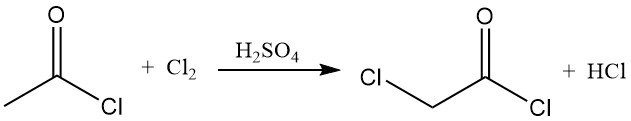
Le chlorure d’acétyle réagit avec le chlore et le brome pour former des chlorures d’halogénoacétyle. En présence d’acide sulfurique, le chlore est efficacement converti en chlorure de chloroacétyle, un intermédiaire de synthèse important.
Les réactions du chlorure d’acétyle avec des amines tertiaires telles que la triéthylamine génèrent du cétène in situ. Le cétène peut être piégé par des énolates, des énamines ou des imines pour former des esters acétoacétiques, des cyclobutanones ou des adduits de dicétène.
En présence d’iodure de samarium(II), le chlorure d’acétyle se comporte comme un équivalent nucléophile de l’anion acétyle, donnant des produits acyloïnes à partir de cétones.
La réaction du chlorure d’acétyle avec le peroxyde d’hydrogène produit de l’acide peroxyacétique et du peroxyde d’acétyle, ce dernier étant un composé hautement explosif.
En présence d’acides gras, il forme des anhydrides acétiques-alkylcarboxyliques mixtes ou des chlorures d’acyle, tous deux utilisables dans les réactions d’estérification. Par exemple, l’acide laurique réagit avec le chlorure d’acétyle pour former les dérivés correspondants.
Le chlorure d’acétyle subit une réduction avec des réactifs organométalliques tels que l’hydrure de lithium et d’aluminium (LiAlH4). En présence d’alcool tert-butylique, LiAlH4 est converti en hydrure de lithium et de tri-tert-butoxyaluminium, qui réduit sélectivement le chlorure d’acétyle en acétaldéhyde. L’hydrure de triphénylétain réduit également le chlorure d’acétyle.
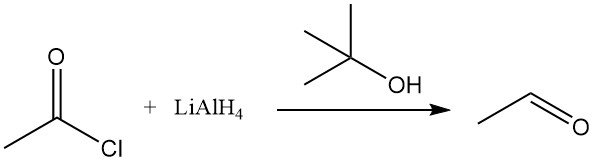
L’hydrogénation catalytique du chlorure d’acétyle par la méthode de Rosenmund est inefficace, mais la réduction de l’anhydride acétique en diacétate d’éthylidène est possible en présence de chlorure d’acétyle sur des complexes de palladium. Le trichlorure de rhodium, l’iodure de méthyle et la triphénylphosphine forment un complexe actif dans la réduction du chlorure d’acétyle.
3. Production de chlorure d’acétyle
Le chlorure d’acétyle est produit commercialement en Europe et en Extrême-Orient. Aux États-Unis, la production est limitée et principalement destinée à une utilisation sur site, notamment pour l’acétylation pharmaceutique.
Le chlorure d’acétyle a été décrit pour la première fois dans les années 1850. Il était obtenu par distillation d’acétate de sodium anhydre avec de l’oxychlorure de phosphore.
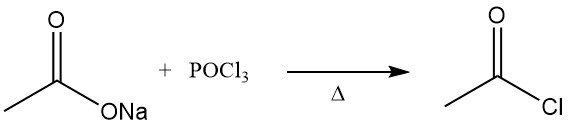
L’ancienne méthode de fabrication du chlorure d’acétyle consistait à faire réagir du chlorure de thionyle (SOCl2) avec de l’acétate de chaux gris. Ce procédé a été largement remplacé par la réaction de l’acétate de sodium ou de l’acide acétique avec du trichlorure de phosphore (PCl3). Une méthode similaire a continué d’être appliquée en Union soviétique. Ces deux méthodes sont relativement coûteuses.
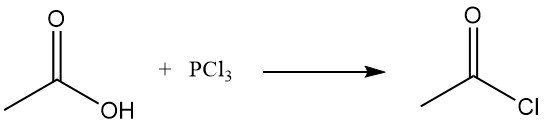
La carbonylation du chlorure de méthyle par du monoxyde de carbone pour produire du chlorure d’acétyle a été décrite dans plusieurs brevets. Ces procédés utilisent des catalyseurs à base de complexes de rhodium, de palladium ou d’iridium associés à des composés iodés et soit à des iodures de phosphonium, soit à des oxydes de phosphine.
Par exemple, une réaction rapportée a donné une conversion de 56 % en chlorure d’acétyle à une température de 453 K et une pression de 8 360 kPa. Ces réactions sont réalisables grâce à la disponibilité d’alliages résistants à la corrosion. L’application industrielle de cette méthode n’a pas été confirmée.
D’autres préparations incluent la réaction de l’acide acétique avec des éthylènes chlorés en présence de chlorure ferrique, la combinaison du chlorure de benzyle avec de l’acide acétique (rendement de 85 %), la conversion du dichlorure d’éthylidène (rendement de 91 %) et la décomposition de l’acétate d’éthyle par le phosgène pour former du chlorure d’acétyle et du chlorure d’éthyle. Le coût élevé des matières premières et des équipements rend la voie du phosgène non viable.
La chloration de l’acide acétique en acide monochloroacétique produit également du chlorure d’acétyle comme sous-produit. Sa récupération étant coûteuse, le chlorure d’acétyle est généralement recyclé en acide monochloroacétique. Une méthode brevetée décrit le lavage de mélanges de chlorure d’acétyle et de chlorure d’hydrogène avec de l’acide sulfurique pour former du sulfate d’acétyle.
Un brevet américain fait état d’un rendement amélioré en chlorure d’acétyle par réaction de l’anhydride acétique avec le chlorure d’hydrogène. Dans ce procédé, le chlorure d’acétyle et une partie de l’acide acétique, un sous-produit, sont éliminés en continu du mélange, tandis que les composants restants sont recyclés dans le réacteur pour une réaction ultérieure.
4. Utilisations du chlorure d’acétyle
Une faible quantité de chlorure d’acétyle est consommée lors de la phase de démarrage de la chloration de l’acide acétique en acide monochloroacétique. Une fois initiée, le chlorure d’acétyle formé comme sous-produit maintient l’effet catalytique.
Le chlorure d’acétyle est un agent d’acétylation efficace. Il est utilisé dans la synthèse de l’aspirine, du paracétamol, de l’acétanilide et de l’acétophénone. Il est également utilisé dans la préparation de compositions à base de cristaux liquides nécessaires aux dispositifs d’affichage optique et de mémoire.
Le chlorure d’acétyle peut remplacer l’anhydride acétique ou l’acide acétique comme réactif d’acétylation hautement réactif lorsque les réactions sont difficiles ou lentes. Cela le rend particulièrement utile pour la préparation de polymères spécialisés capables de se chélater avec des ions métalliques, comme le cuivre, ce qui améliore leurs propriétés électriques et magnétiques.
L’anthraline est acétylée avec du chlorure d’acétyle dans du toluène, en utilisant la pyridine comme catalyseur, pour produire de la 1,8-dihydroxy-10-acétylanthrone, un intermédiaire utilisé dans les médicaments contre les affections cutanées, notamment les verrues, le psoriasis et l’acné. Les esters de sucre peuvent être synthétisés en conditions anhydres avec du chlorure d’acétyle de manière similaire.
Le chlorure d’acétyle a été utilisé en chimie analytique pour la détermination des groupes hydroxyles, mais cette méthode a été largement remplacée par les techniques spectroscopiques. Il est toujours utilisé pour la préparation de dérivés du phénol sans catalyseur acide fort et pour l’acétylation des amines primaires et secondaires.
Le chlorure d’acétyle peut remplacer l’anhydride acétique dans de nombreuses réactions d’acétylation. Contrairement à l’anhydride, il ne nécessite pas de catalyseur acide minéral. Malgré son coût plus élevé, le chlorure d’acétyle est largement utilisé lorsque la commodité l’emporte sur le coût.
La réduction des coûts de production ferait du chlorure d’acétyle une alternative intéressante à l’anhydride acétique dans les procédés à grande échelle.
5. Toxicologie et sécurité
Le chlorure d’acétyle produit des fumées suffocantes à l’odeur forte et irritante. Il est hautement toxique. Son inflammabilité et sa forte réactivité avec l’eau et les bases nécessitent des précautions strictes lors de sa manipulation.
Une ventilation adéquate est nécessaire pour évacuer les vapeurs des zones de travail. Le personnel doit porter des vêtements de protection imperméables pour éviter toute exposition. Les conteneurs en vrac doivent être stockés dans un endroit frais et sec, à l’abri des substances inflammables et non corrosives.
Références
1. Wagner, F.S., Jr. (2002). Acetyl Chloride. In Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a04.pub2
2. Pearlman, B.A. (2001). Acetyl Chloride. In Encyclopedia of Reagents for Organic Synthesis, (Ed.). https://doi.org/10.1002/047084289X.ra025
3. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
