Ftaalonitril: eigenschappen, reacties, productie en toepassingen
Wat is ftaalonitril?
Ftaalonitril, ook bekend als 1,2-dicyanobenzeen of 1,2-benzeendicarbonitril, is een organische verbinding met de formule C8H4N2. Het is een kristallijn poeder met een zwakke grijsgele kleur en een zwakke aromatische geur, vergelijkbaar met benzonitril.
Ftalonitril werd voor het eerst ontdekt in 1896, tijdens de diazotering van 2-aminobenzonitril.
Inhoudsopgave
1. Fysieke eigenschappen van ftaalonitril
Ftaalonitril is een kristallijne vaste stof die niet oplosbaar is in water (ongeveer 1 g/l), maar wel oplosbaar is in organische oplosmiddelen zoals ethanol, aceton, nitrobenzeen, benzonitril en ether.
Ftaalonitril kan niet worden gedistilleerd en ondergaat polymerisatie wanneer het wordt verhit boven het smeltpunt. Het is niet explosief en de ontsteking ervan is moeilijk, maar het stof kan exploderen.
Tabel 1 presenteert de belangrijke fysieke eigenschappen van ftalonitril.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [91-15-6] |
| Formule | C6H4N2 |
| Moleculair gewicht | 128,14 g/mol |
| Smeltpunt | 141 °C |
| Kookpunt | 304,5 °C (ontleding) |
| Dichtheid | 1,238 g/cm3 |
| Schijnbare dichtheid | ≈ 0,5 g/cm3 |
| Vlampunt | 162 °C |
| Verbrandingswarmte | 4013 kJ/mol |
| Verdampingswarmte | 67 kJ/mol |
| Specifieke warmtecapaciteit (30 °C) | 1,30 J g-1 K-1 |
| Dampspanning (20 °C) | 0,05 mbar |
| Zelfontbrandingstemperatuur | > 580 °C |
2. Reacties van ftaalonitril
Ftaalonitril ondergaat verschillende belangrijke reacties die kenmerkend zijn voor nitrilgroepen en aromatische verbindingen, waarvan sommige in de industrie worden gebruikt.
Ftaalonitril reageert met verschillende metaalprecursoren, zoals koperchloride, bij een temperatuur van ongeveer 180 °C in een oplosmiddel om intens gekleurde en duurzame ftalocyaninepigmenten te vormen.
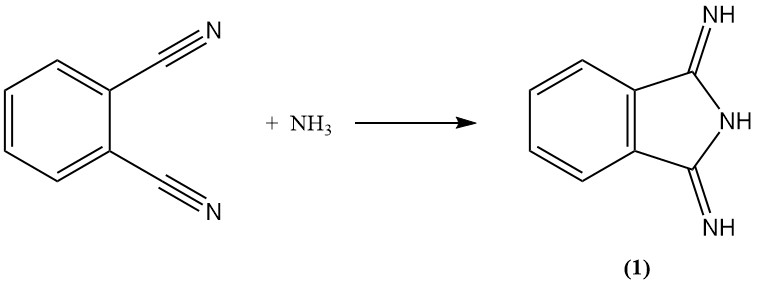
Ftaalonitril reageert met ammoniak om diiminoisoindoline te vormen (1). Dit tussenproduct kan vervolgens verder worden gecondenseerd met actieve methyleenverbindingen om commercieel belangrijke gele pigmenten te produceren.
Ftaalonitril kan deelnemen aan uithardingsreacties wanneer het wordt gecombineerd met specifieke promotoren, zoals verbindingen die sulfhydrylgroepen bevatten. Deze reactie heeft potentiële toepassingen voor het creëren van nieuwe materialen.
Onder specifieke omstandigheden kunnen vaste-toestandreacties plaatsvinden tussen ftaalonitril en andere verbindingen. Bijvoorbeeld, doping van ftalonitril met diiminoisoindoline kan thermische reactiviteit induceren, wat leidt tot de vorming van ftalocyanine.
Bij hoge temperaturen boven het smeltpunt kan ftaalonitril polymerisatie ondergaan, waarbij de afzonderlijke moleculen zich verbinden om grotere ketens te vormen, waardoor een op ftalonitril gebaseerd polymeermateriaal ontstaat.
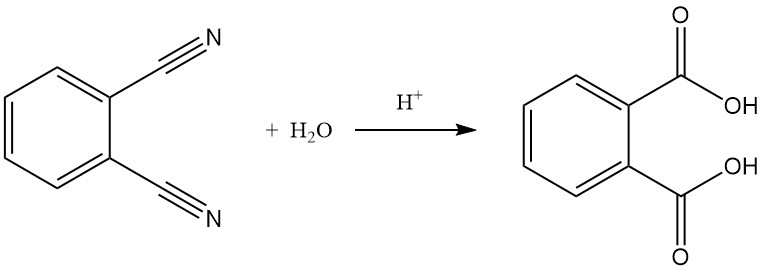
Hydrolyse van ftaalonitril tot ftaalzuur is mogelijk, vooral onder zware omstandigheden zoals sterke zuren en verhoogde temperaturen.
Ftaalonitril kan beperkte aromatische substitutiereacties ondergaan zoals halogenering, nitratie, sulfonering, acylering en alkylering vergeleken met een eenvoudige aromatische ring zoals benzeen vanwege het deactiverende effect van de nitrilgroepen.
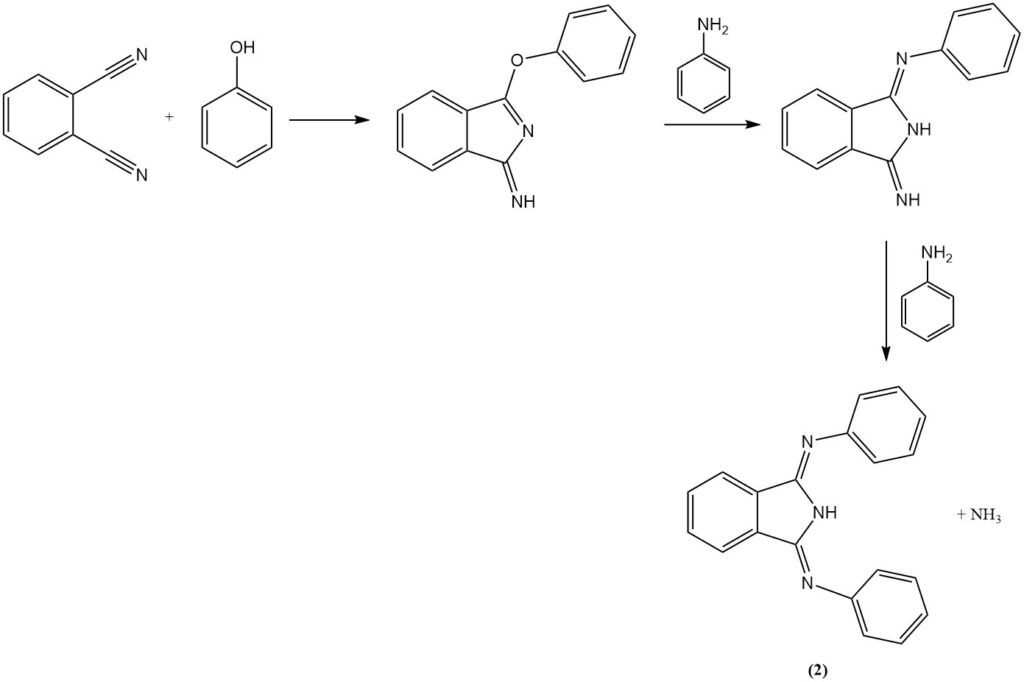
De reactie van ftaalonitril met aniline in aanwezigheid van fenol produceert een heterocyclische verbinding (2), en met diamines produceert stikstofbevattende macroheterocyclische verbindingen (hexazocyelanen) (3).
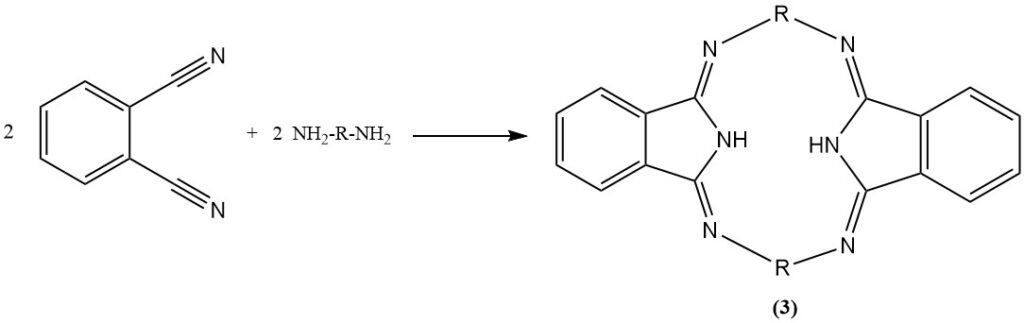
Het is ook mogelijk om de nitrilgroepen van ftalonitril te hydrogeneren om een diaminederivaat te produceren.
3. Industriële productie van ftaalonitril
Ftalonitril wordt commercieel geproduceerd uit o-xyleen, ftaalzuur, ftaalzuuranhydride, ftaalamide of ftaalimide.
3.1. Productie van ftaalonitril uit o-xyleen
Commercieel wordt ftalonitril voornamelijk geproduceerd uit o-xyleen door een proces dat ammoxidatie wordt genoemd. Deze eenfase, continue gasfasereactie gebruikt een wervelbedreactor voor efficiënte omzetting.
In het ammoxidatieproces worden metaaloxidemengsels die vanadium, antimoon, chroom en molybdeen bevatten, ondersteund door aluminiumoxide of silica, veelgebruikte katalysatoren. IJzer, wolfraam en alkalimetaaloxiden kunnen worden toegevoegd om de activiteit te verbeteren.
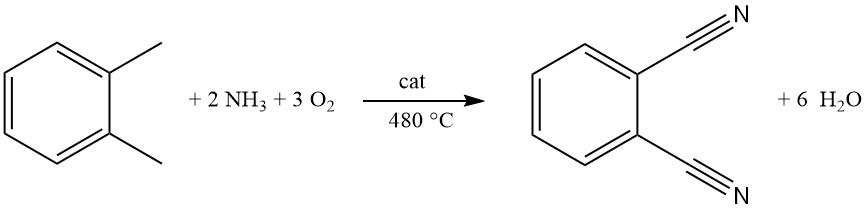
Een gasvormig mengsel van o-xyleen, ammoniak en zuurstof wordt via een verdeelplaat in de reactor gevoerd. De optimale temperatuur voor dit drukloze proces is ongeveer 480 °C.
Lagere temperaturen verhogen bijproducten zoals ftalamide en ftalimide (tot 10%), terwijl hogere temperaturen (>500 °C) leiden tot ammoniakverbranding. Geïntegreerde koelsystemen handhaven een constante temperatuur ondanks de zeer exotherme reactie.
Hete reactiegassen worden geblust met een waterige ftaalonitril-suspensie in een productsettler. Het gekoelde mengsel wordt bezonken en gedecanteerd om het ftalonitril-product te scheiden en te drogen. Dit product met een hoge zuiverheid met een zuur-/ftalimidegehalte van < 0,1% en een watergehalte van < 0,1% kan direct worden gebruikt voor de productie van ftalocyaninepigment, met opbrengsten van 80-85%.
Ammoniak wordt gewonnen uit de post-settler gasstroom, die NH3, CO2, CO, N2 en sporen HCN bevat, met behulp van een speciale ammoniakterugwinningsinstallatie. Het resterende uitlaatgas wordt verbrand en de gewonnen ammoniak wordt teruggevoerd naar het proces.
Niet-gereageerde o-xyleen en het tussenproduct o-toluonitril kunnen worden geïsoleerd of teruggevoerd naar de reactor voor volledige omzetting in ftalonitril.
Pilot plant studies hebben een continu oxidatief ammonolyseproces onderzocht voor de synthese van ftalonitril uit o-xyleen. Dit proces gebruikt een vanadiumoxide-molybdeenoxidekatalysator op aluminiumoxide of silicadrager bij 350–450 °C.
Hierbij fungeert de metaaloxidekatalysator als oxidant, waarbij een deel continu wordt verwijderd, opnieuw wordt geoxideerd en gerecycled. Ftalonitril-blussing en bijproductbeheer zijn vergelijkbaar met het ammoxidatieproces.
Bijproducten zoals o-toluonitril, ftalamide en ftalimide kunnen ofwel teruggevoerd worden naar de hoofdreactor of omgezet worden in ftalonitril in een aparte reactor bij een temperatuur van 400 °C in aanwezigheid van ammoniak en een boorfosfaat-alumina katalysator.
Ammoniak wordt gewonnen uit het restgasmengsel, dat NH3, CO2, CO, N2 en sporen HCN bevat, en teruggevoerd naar de reactor. Schadelijke gassen zoals CO en HCN worden verbrand in een regenerator, terwijl N2 en CO2 uit de processtroom worden verwijderd.
3.2. Productie van ftaalonitril uit ftalaatzuurderivaten
Ftaalonitril kan ook worden gesynthetiseerd uit verschillende ftalaatzuurderivaten, waaronder ftalaatzuur, ftalaatzuuranhydride, ftalamide en ftalimide. Dit proces omvat een gasfasereactie met ammoniak- en watereliminatie bij temperaturen variërend van 300 tot 500 °C in aanwezigheid van een katalysator.
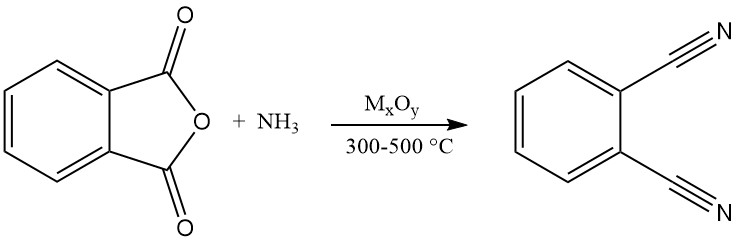
Patentliteratuur suggereert het gebruik van metaaloxidekatalysatoren ondersteund op silica, alumina, fosfaten, silicaten, boraten of basisch alumina. Voorbeelden zijn oxiden van thorium, koper, beryllium, zirkonium of wolfraam.
Gesmolten ftaalzuuranhydride wordt eerst verhit tot ongeveer 160 °C en verdampt in een speciaal apparaat. Voorverwarmd circulerend gas met een hoge concentratie ammoniak (NH3 ≈ 90%) wordt vervolgens in de verdamper gebracht.
Dit mengsel reageert bij bijna atmosferische druk bij een temperatuur tussen 350 en 400 °C in een vastbedreactor die stroomafwaarts van de verdamper is geplaatst. In deze reactor wordt doorgaans een aluminakatalysator gebruikt.
Het hete reactiegas dat de reactor verlaat, wordt geblust met water. Ftaalonitril wordt vervolgens gescheiden van de resulterende waterige suspensie door decanteer- en droogprocessen. De ammoniakconcentratie in het circulerende gas wordt op ongeveer 90% gehouden door de continue toevoeging van ammoniak.
Ftaalonitril kan worden gevormd door dehydratie van ftalamide met behulp van zuurhalogeniden zoals fosgeen of thionylchloride. Deze methode vereist echter extra stappen om de hydrolyse van het ftalamide door het gegenereerde zuur te voorkomen.
Technieken die worden gebruikt om dit probleem te overwinnen, zijn onder meer het toevoegen van verdunningsmiddelen (benzeen, chloorbenzeen) of het gebruiken van tertiaire aminen (N,N-diethyl-o-toluïdine, pyridine) of geacyleerde secundaire aminen (N-methylformamide) om het zuur te neutraliseren.
Dit alternatieve proces omvat over het algemeen complexe procedures en extra chemische verwerking, waardoor het minder gunstig is voor grootschalige productie in vergelijking met de gevestigde routes.
4. Toepassingen van ftaalonitril
Ftalonitril wordt gebruikt als grondstof bij de productie van ftaalocyaninepigmenten, fluorescerende witmakers en fotografische sensibilisatoren.
De productie van ftalocyaninepigmenten, bekend om hun intense kleuren en uitzonderlijke duurzaamheid, is de belangrijkste industriële toepassing van ftalonitril. Door ftalonitril te laten reageren met verschillende metaalprecursoren ontstaat een breed scala aan kleuren. Deze pigmenten worden gebruikt in verf, plastic, textiel en inkt.
5. Toxicologie van ftaalonitril
Acute toxiciteit
- Orale LD50 (rat): 30-125 mg/kg.
- Er werd geen huid- of oogirritatie waargenomen bij konijnen.
- Er is geen bewijs van sensibilisatie bij werknemers die betrokken zijn bij de productie en het gebruik van ftalonitril.
Herhaalde-dosistoxiciteit
- Neurotoxische effecten (convulsies, verhoogde excitatie) werden waargenomen bij ratten en muizen na herhaalde orale blootstelling.
- Toegenomen activiteit en afname van lichaamsgewicht werden gerapporteerd in een 13 weken durende neurotoxiciteitsstudie bij ratten bij 10 en 25 mg ftalonitril/kg/dag. Er werd geen histopathologisch verband gevonden voor gedragsveranderingen. NOAEL in deze studie was 3 mg/kg/dag.
- Beroepsmatige blootstelling heeft geresulteerd in vertraagde (uren tot dagen) epileptische aanvallen die minuten duurden bij werknemers.
- Klinische onderzoeken van 81 werknemers met een gemiddelde blootstelling aan ftalonitril gedurende 8,5 jaar (waaronder 11 met acute intoxicaties) lieten geen afwijkingen zien in klinische chemie, hematologie, neurologie of EEG.
- Blootstelling van de huid kan ook relevant zijn.
- Anti-cyanidemaatregelen worden niet als effectief beschouwd vanwege een gebrek aan cyanidemetabolisme.
Genotoxiciteit
- Ftaalonitril was niet mutageen in de Ames-test of de CHO/HGPRT-genmutatietest.
- Negatieve resultaten in de micronucleustest bij muizen.
- Er werden geen verhoogde chromosomale afwijkingen waargenomen bij werknemers, inclusief degenen met acute intoxicaties.
Carcinogeniciteit
Studies rapporteren leukemie-inductie bij ratten en muizen na orale, subcutane en percutane toediening (muizen). Echter, vage studiebeschrijvingen beperken een sluitende beoordeling.
Referenties
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://www.sciencedirect.com/science/article/abs/pii/S0032386118302945
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalonitrile
- Reaction of O-phthalonitrile with aniline. – https://link.springer.com/article/10.1007/BF00954275
