Chloorazijnzuur: reacties, productie en toepassingen
Wat is chloorazijnzuur?
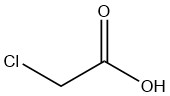
Chlorazijnzuur is een organische verbinding met de formule CH2ClCOOH. Het is een kleurloze, hygroscopische kristallijne vaste stof die in verschillende kristalvormen voorkomt.
Monochloorazijnzuur is een synthetische verbinding die voor het eerst werd ontdekt als een chloreringsproduct van azijnzuur door N. LEBLANC in 1841. R. HOFFMANN synthetiseerde het later in 1857 door de chlorering van azijnzuur te initiëren met behulp van zonlicht.
Chlorazijnzuur en het natriumzout ervan worden beschouwd als de belangrijkste chloreringsproducten van azijnzuur in termen van industrieel en economisch belang.
Inhoudsopgave
1. Eigenschappen van chloorazijnzuur
Chlorazijnzuur is uitstekend oplosbaar in water en goed oplosbaar in methanol, aceton, di-ethylether en ethanol, maar is slechts matig oplosbaar in koolwaterstoffen en gechloreerde koolwaterstoffen.
2. Chemische reacties van chloorazijnzuur
De chemische eigenschappen van chloorazijnzuur kunnen worden toegeschreven aan de hoge reactiviteit van de carbonzuurgroep en het gemak van substitutie van het α-chlooratoom.
Chloorazijnzuur en zijn derivaten, zoals zouten, esters, anhydriden, acylchloriden, amiden en hydraziden, worden veel gebruikt als synthetische organische tussenproducten.
Industriële toepassingen van chloorazijnzuur omvatten reacties met anorganische en organische basen, die zouten opleveren. Sommige zouten kunnen ook adducten vormen met chloorazijnzuur, en natriumchlooracetaat is een belangrijk commercieel product.
Chloorazijnzuuresters, zoals methyl-, ethyl- en tert-butylchlooracetaat, worden gesynthetiseerd door te reageren met alcoholen of olefinen.
Chlooracetylchloride wordt geproduceerd uit chloorazijnzuur door te reageren met verschillende reagentia zoals POCl3, PCl3, PCl5, thionylchloride of fosgeen.
Het zuur kan ook reageren met chlooracetylchloride om bis(chloorazijnzuur)anhydride te produceren, dat kan worden verkregen door dehydratie van chloorazijnzuur met P2O5 of door te reageren met azijnzuuranhydride.
Chlooracetylchloride vormt gemengde anhydriden met andere carbonzuren, zoals azijnzuurchloorazijnzuuranhydride.
Nucleofiele substitutie van het chlooratoom is een belangrijke reactie wanneer chloorazijnzuur wordt gebruikt als tussenproduct in organische syntheses.
Bijvoorbeeld, het hydrolyseren van neutrale of basische waterige oplossingen van chloorazijnzuur levert glycolzuur (hydroxyazijnzuur) en diglycolzuur (2,2′-oxydiazijnzuur) op, een industriële methode om deze verbindingen te produceren.
Het verhitten van de zouten van chloorazijnzuur levert glycolide, 1,4-dioxine-2,5-dion. Reactie met natrium- of kaliumwaterstofsulfide vormt thioglycolzuur en thiodiglycolzuur.
Chloorazijnzuur reageert ook met ammoniak, waarbij aminoazijnzuur (glycine) als hoofdproduct of nitrilotriazijnzuur ontstaat, afhankelijk van de reactieomstandigheden.
Wanneer methylchlooracetaat bij lage temperatuur reageert met ammoniak, wordt chlooracetamide verkregen. Door te reageren met tertiaire aminen in alkalische oplossingen, worden verschillende commercieel belangrijke betaïnen gevormd, zoals N-laurylbetaïne.
Bovendien ondergaan aromatische verbindingen zoals naftaleen elektrofiele substitutie met chloorazijnzuur over geschikte katalysatoren om arylazijnzuren te vormen.
Het commercieel belangrijke cyanoazijnzuur, dat wordt gebruikt als tussenproduct bij de productie van synthetische cafeïne, wordt gesynthetiseerd door kaliumcyanide te laten reageren met chloorazijnzuur in een neutrale oplossing.
Jodazijnzuur wordt gevormd door te reageren met kaliumjodide, terwijl fenoxyazijnzuren worden gesynthetiseerd door fenolverethering in aanwezigheid van natriumhydroxide.
Bovendien worden carboxymethylderivaten met een relatief hoge mate van verethering gesynthetiseerd door polysacchariden, zoals cellulose, zetmeel, guar, enz., te laten reageren in een sterk alkalisch natriumhydroxidemedium.
3. Productie van chloorazijnzuur
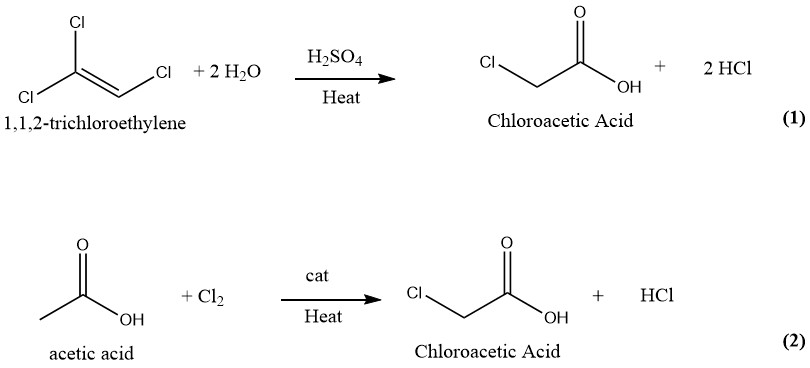
Er zijn talloze technieken voorgesteld en gepatenteerd voor de productie van chloorazijnzuur. In het verleden bestond de industriële productie van chloorazijnzuur uit de hydrolyse van 1,1,2-trichloorethyleen met zwavelzuur als katalysator (1) en de chlorering van azijnzuur met chloor als katalysator (2). Echter, alleen het laatstgenoemde en oudere proces wordt momenteel gebruikt voor de productie van chloorazijnzuur op industriële schaal.
3.1. Productie van chloorazijnzuur door hydrolyse van trichloorethyleen
Chlorazijnzuur kan worden geproduceerd met behulp van een continu proces waarin gelijke hoeveelheden trichloorethyleen en 75% zwavelzuur reageren bij 130-140 °C. Na volledige omzetting van trichloorethyleen bevat het reactiemengsel ongeveer 50% chloorazijnzuur en 1-2% water.
Vervolgens wordt het mengsel onderworpen aan vacuümdestillatie om zuiver chloorazijnzuur te verkrijgen. Tijdens dit proces worden de dampen gewassen met water, dat vervolgens wordt hergebruikt als verdunningsmiddel voor zwavelzuur.
Het waterstofchloridegas dat tijdens het proces wordt gegenereerd, wordt gewassen met vers trichloorethyleen en vervolgens gezuiverd door bevriezing en absorptie in water.
Deze methode levert 1000 kg eindproduct en 700-750 kg HCl-gas op als bijproduct van 1500-1850 kg trichloorethyleen en 600 kg H2SO4 (95%).
De trichloorethyleenmethode voor het produceren van chloorazijnzuur produceert zeer zuiver chloorazijnzuur dat vrij is van di- of trichloorazijnzuur. Deze methode wordt echter niet meer gebruikt vanwege de hoge kosten van trichloorethyleen en de aanzienlijke hoeveelheid HCl die als bijproduct wordt gegenereerd.
De zuiveringsprocedure omvat de scheiding van chloorazijnzuur van trichloorethyleen, zwavelzuur en water.
3.2. Productie van chloorazijnzuur door chlorering van azijnzuur
3.2.1. Synthese
Zeer selectieve omzetting van azijnzuur in chloorazijnzuur is haalbaar door chlorering van azijnzuur waarbij geschikte katalysatoren worden gebruikt. Bij deze reactie wordt azijnzuuranhydride als katalysator gebruikt, wat het volgende reactiemechanisme mogelijk maakt:
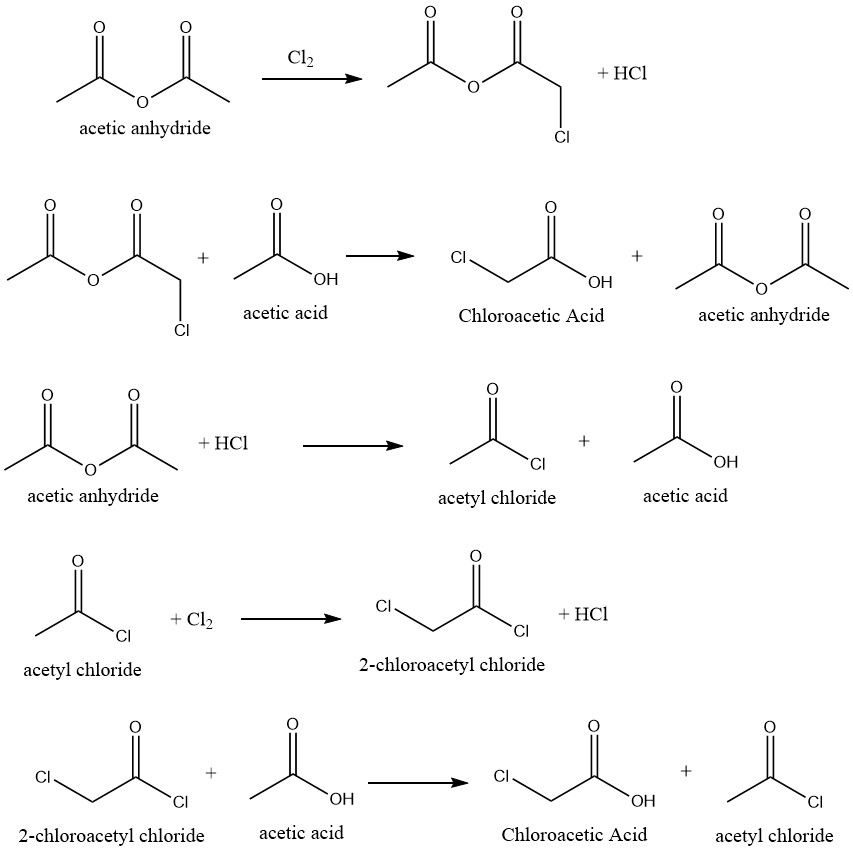
Er zijn verschillende remmers voorgesteld om de vorming van dichloorazijnzuur te verhinderen, dat wordt gegenereerd door de chlorering van chloorazijnzuur in het ruwe mengsel. Hierdoor wordt de vereiste voor het zuiveringsproces om producten van technische kwaliteit te produceren, geëlimineerd of verminderd.
3.2.2. Zuivering
Om het vereiste zuiverheidsniveau voor veel producten te bereiken, is scheiding van di- en trichloorazijnzuur noodzakelijk. De dicht bij elkaar liggende kookpunten van deze gechloreerde azijnzuren maken fractionele destillatie echter onpraktisch.
Alternatieve technieken, zoals azeotropische destillatie en extractieve destillatie, zijn voorgesteld voor de scheiding van dichloorazijnzuur, maar hun effectiviteit blijft onzeker.
Een belangrijk industrieel zuiveringsproces omvat oplosmiddelvrije kristallisatie, die is gebaseerd op de α-modificatie van het hogere smeltpunt van chloorazijnzuur. De di- en trichloorazijnzuur worden na kristallisatie uit de moederloog verwijderd.
Kristallisatie kan optreden in stationaire vingerkristallisatoren of geroerde roerkristallisatoren. Een centrifuge wordt gebruikt om de moederloog van de kristalslurry te scheiden na kristallisatie in de laatste.
Het product wordt vervolgens gewassen met water of azijnzuur. Het zuivere chloorazijnzuur wordt gewoonlijk gesmolten en omgezet in vlokken. In stationaire machines wordt kristallisatie uitgevoerd met behulp van koude vingers.
Wanneer al het chloorazijnzuur is gekristalliseerd, wordt de moederloog afgetapt en wordt het zuivere kristallijne product gesmolten en in vlokken gevormd.
Een dunlaagkristallisatieproces met grondstoffen is voorgesteld als een alternatieve zuiveringsmethode.
Daarnaast zijn op oplosmiddelen gebaseerde kristallisatieprocessen met behulp van koolstoftetrachloride, dichloormethaan of koolwaterstoffen met drie chlooratomen gerapporteerd, wat resulteert in gemakkelijk te filteren kristallen.
Ongeacht de gebruikte methode wordt een moederloog gegenereerd die bestaat uit azijnzuur, chloorazijnzuur en di- en trichloorazijnzuur. Onder ideale omstandigheden kan dit mengsel verder worden gechloreerd om het bruikbare trichloorazijnzuur te verkrijgen.
Een belangrijkere zuiveringsmethode omvat katalytische hydrodechlorering van ongewenste bijproducten, zoals dichloor- en trichloorazijnzuur. Di- en trichloorazijnzuren kunnen worden gedechloreerd door katalytische hydrogenering bij hoge temperatuur, meestal met palladium op een drager (bijv. koolstof of silicagel).
Wanneer katalytische hydrodechlorering in de dampfase wordt gebruikt, wordt dichloorazijnzuur voornamelijk omgezet in azijnzuur. Het gebruik van fijn verdeelde, inerte dragers met Pd in de vloeibare fase bij 130–150 °C resulteert echter in selectieve dechlorering om chloorazijnzuur te vormen.
Modificaties van deze procedure, zoals het sproeien van ruw zuur met waterstofgas onder vacuüm of het druppelen van zuur over de katalysator in een vast bed, zijn ook voorgesteld. De toevoeging van HCl aan het ruwe zuur vóór contact met de katalysator in het vaste bed verbetert de selectiviteit en verzeept zuurchloriden en anhydriden vóór dechlorering.
De Pd-katalysator op een silicageldrager (deeltjesgrootte 40–200 mm) is zeer actief en selectief, en co-katalytisch effectieve additieven, zoals natriumacetaat, kunnen de resultaten verder verbeteren.
Oppervlakteverrijking van het edelmetaal verbetert de katalysatorefficiëntie en gebruikte katalysator kan worden gereactiveerd via chloorbehandeling.
Het gebruik van Pd-katalysatoren op geoptimaliseerde actieve koolstofdragers vermindert overreductiebijproducten (bijv. aldehyden) tijdens de hydrogeneringsstap, die kan worden uitgevoerd met behulp van een lusreactor.
Een methode om de concentratie dichloorazijnzuur in chloorazijnzuur te verlagen van 2000 tot 210 ppm kan worden bereikt door niet-edelmetaalkatalysatoren te gebruiken bij 100 tot 140 °C zonder waterstof.
Figuur 1 toont een industrieel chloreringsproces, waarbij een mengsel van azijnzuur, azijnzuuranhydride en gerecycled acetylchloride in reactor (a) wordt gechloreerd bij 90–140 °C. Het gevormde HCl-gas bevat slechts sporen van chloor.
Het resulterende mengsel van chloorazijnzuur, azijnzuur en azijnzuuranhydride wordt gecondenseerd met behulp van watergekoelde condensors (b) en teruggevoerd naar de reactor. Acetylchloride dat in het HCl-gas is meegevoerd, wordt in een daaropvolgend proces bij lage temperatuur (c) teruggewonnen en gerecycled.
Het HCl-gas wordt gezuiverd en omgezet in geconcentreerd waterig zoutzuur.
De ruwe azijnzuren kunnen vacuümgedestilleerd worden (d) voorafgaand aan de dechloreringstap, die wordt uitgevoerd bij 120–150 °C met behulp van een palladiumkatalysator en een grote overmaat waterstof. Azijnzuur wordt overhead uit de vacuümfractioneringskolom (i) gehaald, terwijl het bodemproduct zuiver chloorazijnzuur is.
Indien gewenst kan het chloorazijnzuur verder worden gezuiverd door middel van destillatie om hoogkokende onzuiverheden te verwijderen, zoals de condensatieproducten van aldehyden die tijdens de hydrogeneringsstap worden gevormd.
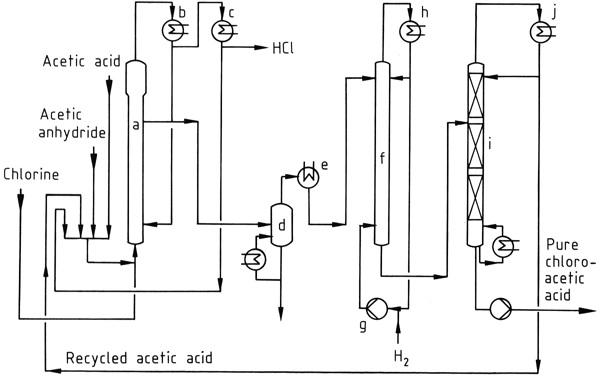
a) Chlooreactor; b) Condensor voor azijnzuur, azijnzuuranhydride, chloorazijnzuur; c) Condensor voor acetylchloride; d) Verdamper; e) Condensor voor chloorazijnzuur; f) Hydrogeneringsreactor; g) Waterstofcompressor; h) Condensor; i) Destillatiekolom; j) Condensor voor azijnzuur
4. Toepassingen van chloorazijnzuur
Chlorazijnzuur is een veelzijdige chemische verbinding die in een breed scala aan industriële toepassingen wordt gebruikt. Een van de belangrijkste toepassingen is de productie van carboxymethylcellulose (CMC) wat jaarlijks enkele honderdduizenden tonnen bedraagt.
Naast CMC kan chloorazijnzuur ook reageren met zetmeel om carboxymethylzetmeel te produceren, dat net zo wijdverbreid wordt gebruikt als CMC. Hoewel andere polysacchariden ook kunnen worden gemodificeerd met chloorazijnzuur, worden ze niet zo vaak gebruikt.
Een andere belangrijke toepassing van chloorazijnzuur is de productie van herbiciden op basis van arylhydroxyazijnzuren, met name chloorfenoxyalkaanzuren. Deze herbiciden behoren tot de meest gebruikte in de agrarische sector.
Daarnaast worden chloorazijnzuur en methylchlooracetaat gebruikt bij de productie van het insecticide dimethoaat, evenals de herbiciden benazoline en methyl b-naftyloxyacetaat.
Een derde belangrijk gebruik van chloorazijnzuur is de productie van thioglycolzuur, ook bekend als mercaptoazijnzuur. Dit wordt bereikt door chloorazijnzuur te laten reageren met natrium- of kaliumwaterstofsulfide of andere zwavelverbindingen.
Thioglycolzuur wordt in verschillende vormen gebruikt, waaronder het zout, de ester of het derivaat ervan. Het grootste deel van het geproduceerde thioglycolzuur wordt gebruikt bij de productie van stabilisatoren voor poly(vinylchloride).
Het wordt ook gebruikt in haarcosmetica en in andere industriële toepassingen, zoals de productie van langketenige betaïnen, zoals N-laurylbetaïne, die oppervlakteactieve stoffen zijn die worden gebruikt in reinigingsmiddelen en persoonlijke verzorgingsproducten.
Naast deze toepassingen heeft chloorazijnzuur een veelvoud aan andere toepassingen in organische synthetische reacties. Zo kunnen cyanoazijnzuur of de esters ervan worden gebruikt om cafeïne en barbituraten te produceren, die belangrijke slaapmiddelen zijn.
Chloorazijnzuur kan condenseren met aromatische koolwaterstoffen om arylazijnzuren te vormen.
Wanneer het reageert met naftaleen, wordt 1-naftylazijnzuur geproduceerd als het hoofdproduct, en 2-naftylazijnzuur wordt gegenereerd als het bijproduct. Beide stoffen staan erom bekend dat ze de plantengroei bevorderen.
Ten slotte speelt chloorazijnzuur een essentiële rol in de synthese van cumarine en vitamine B6.
Referentie
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
