Fenolo: produzione, reazioni e usi
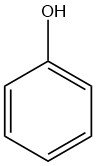
Cos’è il fenolo?
Il fenolo, noto anche come idrossibenzene, è un composto organico con formula chimica C6H5OH. È un solido cristallino bianco a temperatura ambiente, ma il fenolo di grado tecnico può essere un liquido a causa delle impurità. Ha un odore distinto, spesso descritto come nauseantemente dolce e catramoso.
Il fenolo fu inizialmente scoperto nel 1834 da RUNGE, che lo isolò con successo dal catrame di carbone e lo designò come acido fenico.
Successivamente, LAURENT lo ottenne in forma cristallina nel 1841, ne determinò la composizione e inizialmente lo chiamò acido fenolico, che fu poi abbreviato in fenolo.
Nel 1858, KEKULE propose la struttura molecolare del fenolo. Prima della fine del 1800, tutto il fenolo veniva recuperato dal carbone e impiegato principalmente come disinfettante.
Nel 1897, HOFFMANN realizzò la prima sintesi di acido acetilsalicilico dal fenolo in una forma pura e stabile. Nel 1900, la domanda di fenolo aumentò con la commercializzazione delle resine fenoliche dopo la prima guerra mondiale, dei bisfenoli dopo la seconda guerra mondiale e dei policarbonati negli anni ’60.
Sommario
1. Produzione di fenolo
Il fenolo viene prodotto industrialmente tramite il processo Hock, che prevede l’ossidazione del cumene. È il percorso di sintesi più ampiamente utilizzato, che rappresenta un tasso di produzione di oltre 6,7 milioni di t/a di fenolo e circa 4,1 milioni di t/a del coprodotto acetone. È un processo economicamente competitivo, sostenuto dalla domanda di acetone.
Poiché si prevede che la domanda di fenolo crescerà in modo più robusto in futuro, c’è un continuo interesse commerciale nello scoprire nuove tecniche prive di coprodotti per la sintesi del fenolo, come l’ossidazione diretta del benzene a fenolo.
L’ossidazione del toluene con acido benzoico come prodotto intermedio è attualmente impiegata per la produzione di fenolo.
Nonostante ciò, circa 300.000 t di fenolo vengono ancora recuperate dal catrame di carbone.
Solutia ha sviluppato l’ossidazione diretta del benzene in fenolo utilizzando protossido di azoto dal 1995 circa, sebbene questo approccio non sia ancora stato commercializzato.
I percorsi di sintesi convenzionali, come il processo di solfonazione del benzene e l’idrolisi del clorobenzene con soda caustica, non sono più economicamente importanti.
1.1. Produzione di fenolo mediante ossidazione del cumene (processo Hock)
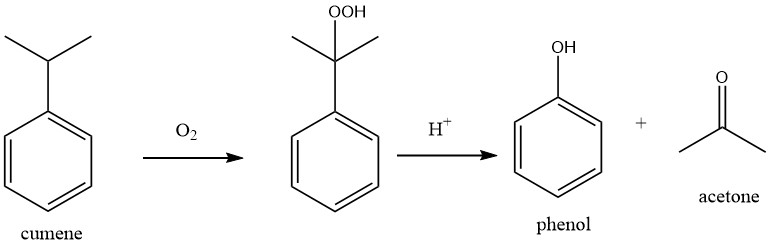
Il processo comprende due reazioni chimiche fondamentali: il cumene viene inizialmente sottoposto a ossidazione con ossigeno per produrre idroperossido di cumene, che viene successivamente scisso per formare fenolo e acetone utilizzando un acido minerale forte come catalizzatore.
Entrambe le reazioni sono caratterizzate da elevata esotermicità, con calori di reazione di -117 kJ/mol per l’ossidazione del cumene e -252 kJ/mol per la scissione del perossido.
H. HOCK e S. LANG descrissero per primi queste reazioni nel 1944. Il processo di ossidazione industriale del cumene fu successivamente sviluppato e commercializzato da The Distillers Co. in Gran Bretagna e dalla Hercules Powder Company negli Stati Uniti dopo la seconda guerra mondiale. Nel 1952, il primo impianto con una capacità di 8000 t/a fu fondato a Shawinigan, in Canada.
1.2. Produzione di fenolo mediante ossidazione del toluene
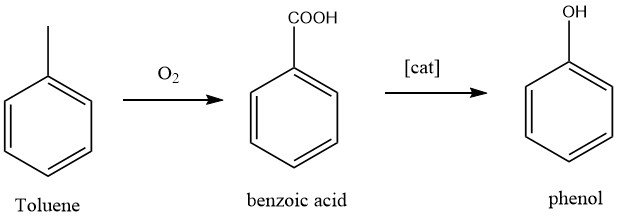
La California Research Corporation e la Dow Chemical hanno sviluppato un processo in due fasi per la produzione di fenolo. Nella prima fase, il toluene viene ossidato ad acido benzoico, una reazione ben nota. Nella seconda fase, l’acido benzoico viene ulteriormente ossidato a fenolo.
La conversione del toluene in fenolo è un’ossidazione completa del gruppo metilico, che produce come sottoprodotti anidride carbonica e acqua.
L’ossidazione del toluene viene eseguita in fase liquida a una temperatura compresa tra 100 e 150 °C e una pressione relativa di circa 2 bar, utilizzando ossigeno atmosferico. Il catalizzatore solubile utilizzato è il naftenato di cobalto a concentrazioni comprese tra 0,1 e 0,3%.
Il meccanismo di reazione dell’ossidazione del toluene ad acido benzoico è complesso, con alcol benzilico e benzaldeide come intermedi. Si formano sottoprodotti come benzilbenzoato e bifenile, nonché acido formico, acido acetico, anidride carbonica e monossido di carbonio.
Per l’ossidazione dell’acido benzoico nel secondo passaggio, l’acido benzoico fuso viene utilizzato come reagente e solvente a una temperatura di circa 230-240 °C a pressione atmosferica. L’ossigeno atmosferico, il vapore e il benzoato di rame (II) solubile vengono utilizzati come catalizzatori, con sali di magnesio aggiunti come promotori.
Il risultato netto delle reazioni simultanee nel sistema è la formazione di fenolo.
Il benzoato di rame (II) si decompone termicamente in benzoato di rame (I) e acido benzoilsalicilico, che viene successivamente idrolizzato in acido benzoico e acido salicilico in presenza di acqua o vapore. L’acido salicilico si decarbossila rapidamente per dare fenolo e anidride carbonica.
Il processo Dow è stato commercializzato con il primo impianto avviato nei primi anni ’60 a Landar, nella Columbia Britannica, seguito da un secondo impianto a Kalama, Washington, e un terzo a Rosenburg, nei Paesi Bassi, gestito da DSM. Nel 1991, Nippon Phenol ha avviato un nuovo impianto in Giappone.
La Lummus Company ha introdotto un nuovo processo per l’ossidazione dell’acido benzoico nel 1978, condotto in fase di vapore su un catalizzatore contenente rame in un reattore eterogeneo.
Secondo Lummus, la reazione non produce catrami o residui non volatili, probabilmente a causa della rapida rimozione del fenolo dalla zona di reazione.
1.3. Fenolo dal carbone
Il recupero del fenolo “naturale” dal carbone è stato un processo commerciale per la produzione di fenolo per molto tempo ed è ancora in uso. Tuttavia, questo processo è diventato insignificante come fonte di fenolo al giorno d’oggi.
Il fenolo, così come molti altri composti aromatici, vengono recuperati dai vapori della carbonizzazione del carbone, dove il carbone viene sottoposto a temperature superiori a 900 °C in assenza di aria in un forno a coke, lasciando il coke come residuo solido e idrocarburi e gas condensabili come vapori.
I vapori vengono condensati per formare catrame di carbone, che può essere lavato con acido solforico acquoso o acido fosforico per recuperare l’ammoniaca, o lavato con un olio di lavaggio per rimuovere il benzene. Il gas rimanente viene utilizzato come combustibile in loco ed è costituito da idrogeno e metano.
La distillazione continua viene utilizzata per elaborare ulteriormente il catrame di carbone. Nella prima colonna, l’olio leggero contenente benzene, toluene e xileni viene separato insieme all’acqua. Nella seconda colonna, l’olio fenico, che include fenolo e composti fenolici, viene separato come testa, e l’olio naftalene viene preso come taglio laterale.
Il prodotto di fondo della seconda colonna viene ulteriormente frazionato per produrre olio di lavaggio per il recupero del benzene dal gas di scarico, olio di metilnaftalene, olio di antracene e pece. Elevati rapporti di riflusso e un elevato grado di integrazione termica vengono utilizzati con colonne a piastre o colonne con riempimenti casuali.
L’olio fenolico, che costituisce circa il 2-3% del catrame di carbone e contiene circa il 30-35% di composti fenolici come fenolo e cresoli, viene sottoposto all’8-9% di soda caustica in un’unità di estrazione. Fenolo e cresoli, noti come acidi del catrame, vengono estratti come sali nella fase acquosa. La liscivia fenolica grezza viene distillata a vapore per separare gli idrocarburi residui e le basi piridiniche.
La liscivia fenolica viene quindi trattata con anidride carbonica per liberare i catrami acidi dai loro sali nella colonna. La fase acquosa contenente carbonato di sodio viene ulteriormente trattata per rimuovere il fenolo disciolto.
La fase organica viene frazionata in fenolo puro (punto di ebollizione 181,8 °C), o-cresolo (punto di ebollizione 191,0 °C), una miscela di m- e p-cresoli (punto di ebollizione 202,0 – 203,0 °C) e una frazione di xilenolo (punto di ebollizione a 210 °C) mediante distillazione discontinua.
2. Reazioni chimiche del fenolo
Le proprietà chimiche del fenolo sono caratterizzate dall’influenza reciproca del gruppo idrossilico e dell’anello aromatico l’uno sull’altro.
2.1. Reazioni che coinvolgono il legame O-H
A differenza degli alcoli alifatici, il fenolo è un acido debole e forma sali solubili con basi forti, il che è utile per il suo recupero da solventi organici come il catrame di carbone. Il suo valore pKa in una soluzione acquosa è 10,0. L’anione fenolato è stabilizzato dal sistema ad anello aromatico.
Il fenolo può essere liberato dai suoi sali anche a temperatura ambiente, mediante trattamento con anidride carbonica. Vicino al suo punto di ebollizione, il fenolo può spostare gli acidi carbossilici dai loro sali per formare fenolati.
Il gruppo idrossilico può essere facilmente esterificato (ad esempio, in acetato di fenile) o eterificato (ad esempio, etere difenilico).
2.2. Reazioni dell’anello aromatico
La coppia di elettroni nel fenolo è delocalizzata sull’anello aromatico, causandone l’acidità. Gli elettroni in eccesso nelle posizioni orto e para rendono il fenolo altamente suscettibile alla sostituzione elettrofila. Ad esempio, il bromo in soluzione acquosa reagisce con il fenolo per produrre 2,4,6-tribromofenolo ad alta resa.
La reazione di Kolbe è un’altra reazione importante, che coinvolge l’accoppiamento di anidride carbonica con fenossido di sodio a 125 °C per dare salicilato di sodio. A 125 °C, l’anidride carbonica sostituisce nella posizione orto, mentre a temperature superiori a 250 °C, è favorito l’isomero para.
Altre reazioni successive alla sostituzione elettrofila includono clorurazione, solfonazione e nitrazione.
2.3. Ossidazione in fase liquida
L’ossidazione di sostanze organiche da parte dell’ossigeno molecolare genera vari prodotti intermedi, come l’idroperossido di cumene. Questi processi seguono un meccanismo radicale complesso.
Il fenolo può inibire tali reazioni reagendo con i radicali liberi per formare radicali fenossilici, che sono relativamente stabili e non propagano il meccanismo a catena. Pertanto, qualsiasi ingresso di fenolo nei processi di ossidazione deve essere evitato.
3. Utilizzi del fenolo
La capacità produttiva globale di fenolo supera i 9 milioni di tonnellate. Il bisfenolo A, un derivato principale del fenolo, rappresenta circa il 37% della produzione mondiale.
Il bisfenolo A è comunemente utilizzato nella produzione di policarbonati di alta qualità per applicazioni automobilistiche, compact disc e vetrate, nonché nella produzione di resine epossidiche.
La seconda applicazione più grande del fenolo è la produzione di resine fenoliche con formaldeide. Queste resine sono utilizzate principalmente per applicazioni sottoscocca nell’industria automobilistica.
Inoltre, il fenolo è impiegato per la sintesi del caprolattame mediante la via cicloesanolo–cicloesanone.
Vengono prodotti diversi altri derivati del fenolo, tra cui alchilfenoli, difenoli, anilina e acido salicilico.
Poiché il settore automobilistico è un importante consumatore di derivati fenolici, come i policarbonati e le resine fenoliche, la domanda di fenolo è ancora in gran parte legata a questo mercato, che tende a essere ciclico.
Riferimento
- Phenol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_299.pub3
