Acido Cloroacetico: Reazioni, Produzione e Usi
Cos’è l’acido cloroacetico?
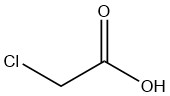
L’acido cloroacetico è un composto organico con formula CH2ClCOOH. È un solido cristallino incolore e igroscopico che esiste in varie forme cristalline.
L’acido monocloroacetico è un composto sintetico che è stato scoperto per la prima volta come prodotto di clorurazione dell’acido acetico da N. LEBLANC nel 1841. R. HOFFMANN lo ha successivamente sintetizzato nel 1857 avviando la clorurazione dell’acido acetico utilizzando la luce solare.
L’acido cloroacetico e il suo sale di sodio sono considerati i prodotti di clorurazione dell’acido acetico più significativi in termini di importanza industriale ed economica.
Sommario
1. Proprietà dell’acido cloroacetico
L’acido cloroacetico ha un’eccellente solubilità in acqua e una buona solubilità in metanolo, acetone, etere dietilico ed etanolo, ma è solo scarsamente solubile in idrocarburi e idrocarburi clorurati.
2. Reazioni chimiche dell’acido cloroacetico
Le proprietà chimiche dell’acido cloroacetico possono essere attribuite all’elevata reattività del suo gruppo acido carbossilico e alla facilità di sostituzione del suo atomo di α-cloro.
L’acido cloroacetico e i suoi derivati, come sali, esteri, anidridi, cloruri acilici, ammidi e idrazidi, sono ampiamente utilizzati come intermedi organici sintetici.
Le applicazioni industriali dell’acido cloroacetico includono reazioni con basi inorganiche e organiche, che producono sali. Alcuni sali possono anche formare addotti con l’acido cloroacetico e il cloroacetato di sodio è un importante prodotto commerciale.
Gli esteri dell’acido cloroacetico, come il cloroacetato di metile, etile e terz-butile, vengono sintetizzati reagendo con alcoli o olefine.
Il cloruro di cloroacetile viene prodotto dall’acido cloroacetico reagendo con vari reagenti come POCl3, PCl3, PCl5, cloruro di tionile (SOCl2) o fosgene (COCl2).
L’acido può anche reagire con il cloruro di cloroacetile per produrre anidride bis(cloroacetica), che può essere ottenuta mediante disidratazione dell’acido cloroacetico con P2O5 o mediante reazione con anidride acetica.
Il cloruro di cloroacetile forma anidridi miste con altri acidi carbossilici, come l’anidride acetica cloroacetica.
La sostituzione nucleofila dell’atomo di cloro è una reazione importante quando l’acido cloroacetico viene utilizzato come intermedio nelle sintesi organiche.
Ad esempio, l’idrolisi di soluzioni acquose neutre o basiche di acido cloroacetico produce acido glicolico (acido idrossiacetico) e acido diglicolico (acido 2,2′-ossidiacetico), un metodo industriale per produrre questi composti.
Riscaldando i sali di acido cloroacetico si ottiene il glicolide, 1,4-diossina-2,5-dione. La reazione con idrogenosolfuro di sodio o potassio forma acido tioglicolico e acido tiodiglicolico.
L’acido cloroacetico reagisce anche con l’ammoniaca, producendo acido amminoacetico (glicina) come prodotto principale o acido nitrilotriacetico, a seconda delle condizioni di reazione.
Quando il metilcloroacetato reagisce con l’ammoniaca a bassa temperatura, si ottiene cloroacetamide. Reagendo con ammine terziarie in soluzioni alcaline, si formano varie betaine commercialmente importanti, come la N-lauril betaina.
Inoltre, composti aromatici come il naftalene subiscono una sostituzione elettrofila con acido cloroacetico su catalizzatori adatti per formare acidi arilacetici.
L’acido cianoacetico commercialmente importante, che è usato come intermedio nella produzione di caffeina sintetica, è sintetizzato facendo reagire il cianuro di potassio con l’acido cloroacetico in una soluzione neutra.
L’acido iodoacetico è formato facendo reagire con ioduro di potassio, mentre gli acidi fenossiacetici sono sintetizzati tramite eterificazione del fenolo in presenza di idrossido di sodio.
Inoltre, i derivati carbossimetilici con un grado relativamente elevato di eterificazione sono sintetizzati facendo reagire polisaccaridi, come cellulosa, amido, guar, ecc., in un mezzo fortemente alcalino di idrossido di sodio.
3. Produzione di acido cloroacetico
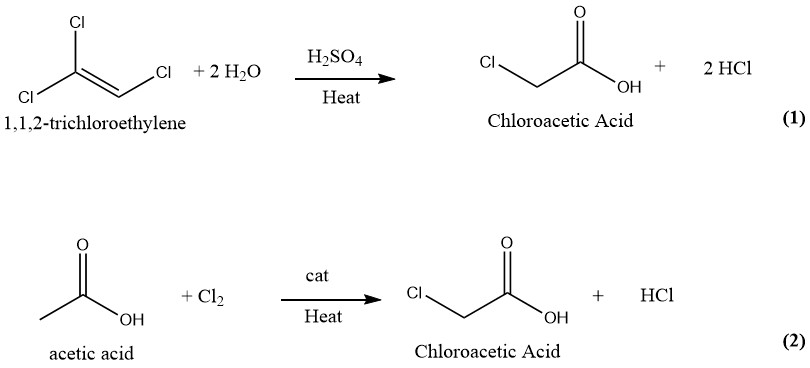
Sono state suggerite e brevettate numerose tecniche per la produzione di acido cloroacetico. In passato, la produzione industriale di acido cloroacetico comportava l’idrolisi dell’1,1,2-tricloroetilene con acido solforico come catalizzatore (1) e la clorurazione dell’acido acetico con cloro come catalizzatore (2). Tuttavia, solo quest’ultimo e più vecchio processo è attualmente impiegato per la produzione di acido cloroacetico su scala industriale.
3.1. Produzione di acido cloroacetico mediante idrolisi del tricloroetilene
L’acido cloroacetico può essere prodotto utilizzando un processo continuo in cui quantità uguali di tricloroetilene e acido solforico al 75% vengono fatte reagire a 130-140 °C. Dopo la conversione completa del tricloroetilene, la miscela di reazione contiene circa il 50% di acido cloroacetico e l’1-2% di acqua.
Successivamente, la miscela viene sottoposta a distillazione sotto vuoto per ottenere acido cloroacetico puro. Durante questo processo, i vapori vengono lavati con acqua, che viene successivamente riutilizzata come diluente per l’acido solforico.
Il gas di cloruro di idrogeno generato durante il processo viene lavato con tricloroetilene fresco e quindi purificato mediante congelamento e assorbimento in acqua.
Questo metodo produce 1000 kg di prodotto finito e 700-750 kg di gas HCl come sottoprodotto da 1500-1850 kg di tricloroetilene e 600 kg di H2SO4 (95%).
Il metodo del tricloroetilene per produrre acido cloroacetico produce acido cloroacetico altamente puro, privo di acido di- o tricloroacetico. Tuttavia, questo metodo non è più in uso a causa dell’elevato costo del tricloroetilene e della notevole quantità di HCl generata come sottoprodotto.
La procedura di purificazione prevede la separazione dell’acido cloroacetico da tricloroetilene, acido solforico e acqua.
3.2. Produzione di acido cloroacetico mediante clorurazione di acido acetico
3.2.1. Sintesi
La conversione altamente selettiva dell’acido acetico in acido cloroacetico è ottenibile mediante clorurazione di acido acetico che impiega catalizzatori appropriati. La reazione utilizza l’anidride acetica come catalizzatore, che facilita il seguente meccanismo di reazione:
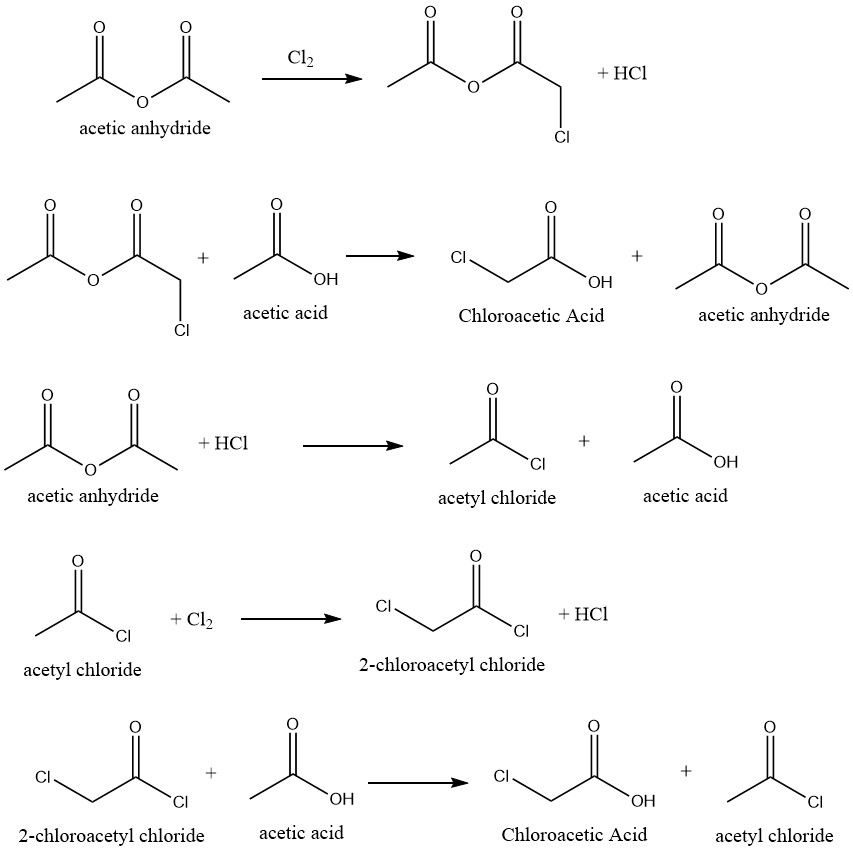
Sono stati suggeriti diversi inibitori per ostacolare la formazione di acido dicloroacetico, che viene generato dalla clorurazione dell’acido cloroacetico nella miscela grezza. In questo modo, elimina o riduce la necessità del processo di purificazione per produrre prodotti di qualità tecnica.
3.2.2. Purificazione
Per ottenere il livello di purezza richiesto per molti prodotti, è necessaria la separazione degli acidi di- e tricloroacetico. Tuttavia, i punti di ebollizione ravvicinati di questi acidi acetici clorurati rendono la distillazione frazionata impraticabile.
Sono state suggerite tecniche alternative, come la distillazione azeotropica e la distillazione estrattiva, per la separazione dell’acido dicloroacetico, ma la loro efficacia rimane incerta.
Un importante processo di purificazione industriale prevede la cristallizzazione senza solventi, che si basa sulla modifica α del punto di fusione più elevato dell’acido cloroacetico. Gli acidi di- e tricloroacetico vengono rimossi dal liquore madre dopo la cristallizzazione.
La cristallizzazione può avvenire in cristallizzatori fissi a dita o cristallizzatori agitati. Una centrifuga viene utilizzata per separare il liquore madre dalla sospensione cristallina dopo la cristallizzazione in quest’ultima.
Il prodotto viene quindi lavato con acqua o acido acetico. L’acido cloroacetico puro viene comunemente fuso e trasformato in scaglie. Nelle macchine fisse, la cristallizzazione viene eseguita utilizzando dita fredde.
Quando tutto l’acido cloroacetico si è cristallizzato, il liquore madre viene drenato e il prodotto cristallino puro viene fuso e ridotto in scaglie.
È stato proposto un processo di cristallizzazione a strato sottile con materie prime come metodo di purificazione alternativo.
Inoltre, sono stati segnalati processi di cristallizzazione a base di solventi che utilizzano tetracloruro di carbonio, diclorometano o idrocarburi con tre atomi di cloro, con conseguenti cristalli facilmente filtrabili.
Indipendentemente dal metodo utilizzato, viene generato un liquore madre costituito da acido acetico, acido cloroacetico e acidi di- e tricloroacetico. In condizioni ideali, questa miscela può essere ulteriormente clorurata per produrre l’utile acido tricloroacetico.
Un metodo di purificazione più significativo prevede l’idrodeclorazione catalitica di sottoprodotti indesiderati, come l’acido dicloro- e tricloroacetico. Gli acidi di- e tricloroacetico possono essere declorurati tramite idrogenazione catalitica ad alta temperatura, in genere utilizzando palladio su un supporto (ad esempio, carbonio o gel di silice).
Quando viene utilizzata l’idrodeclorazione catalitica in fase di vapore, l’acido dicloroacetico viene convertito principalmente in acido acetico. Tuttavia, l’uso di supporti inerti finemente dispersi con Pd nella fase liquida a 130-150 °C determina una declorurazione selettiva per formare acido cloroacetico.
Sono state proposte anche modifiche di questa procedura, come la spruzzatura di acido grezzo con idrogeno gassoso sotto vuoto o il gocciolamento di acido sul catalizzatore in un letto fisso. L’aggiunta di HCl all’acido grezzo prima del contatto con il catalizzatore nel letto fisso aumenta la selettività e saponifica i cloruri e le anidridi acide prima della declorazione.
Il catalizzatore Pd su un supporto di gel di silice (dimensione delle particelle 40-200 mm) è altamente attivo e selettivo e additivi efficaci co-cataliticamente, come l’acetato di sodio, possono migliorare ulteriormente i risultati.
L’arricchimento superficiale del metallo nobile aumenta l’efficienza del catalizzatore e il catalizzatore esaurito può essere riattivato tramite trattamento con cloro.
L’uso di catalizzatori Pd su supporti di carbone attivo ottimizzati riduce i sottoprodotti di sovra-riduzione (ad esempio, aldeidi) durante la fase di idrogenazione, che può essere eseguita utilizzando un reattore a ciclo.
Un metodo per ridurre la concentrazione di acido dicloroacetico nell’acido cloroacetico da 2000 a 210 ppm può essere realizzato utilizzando catalizzatori di metalli non nobili a 100-140 °C senza idrogeno.
La figura 1 mostra un processo di clorurazione industriale, in cui una miscela di acido acetico, anidride acetica e cloruro di acetile riciclato viene clorurata nel reattore (a) a 90-140 °C. Il gas HCl formato contiene solo tracce di cloro.
La miscela risultante di acido cloroacetico, acido acetico e anidride acetica viene condensata utilizzando condensatori raffreddati ad acqua (b) e riportata al reattore. Il cloruro di acetile trascinato nel gas HCl viene recuperato in un successivo processo a bassa temperatura (c) e riciclato.
Il gas HCl viene purificato e convertito in acido cloridrico acquoso concentrato.
Gli acidi acetici grezzi possono essere distillati sotto vuoto (d) prima della fase di declorazione, che viene eseguita a 120–150 °C utilizzando un catalizzatore al palladio e un grande eccesso di idrogeno. L’acido acetico viene prelevato in testa dalla colonna di frazionamento sotto vuoto (i), mentre il prodotto di fondo è acido cloroacetico puro.
Se lo si desidera, l’acido cloroacetico può essere ulteriormente purificato tramite distillazione per rimuovere le impurità altobollenti, come i prodotti di condensazione delle aldeidi formate durante la fase di idrogenazione.
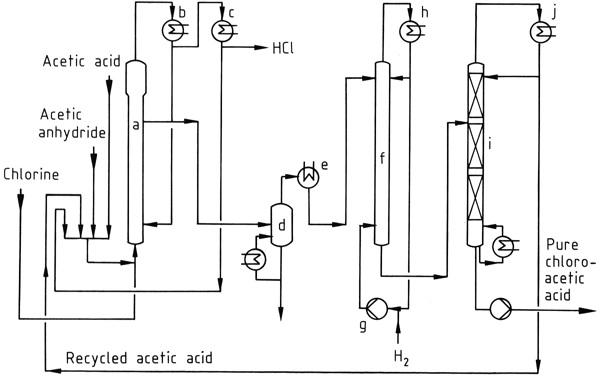
a) Reattore di clorurazione; b) Condensatore per acido acetico, anidride acetica, acido cloroacetico; c) Condensatore per cloruro di acetile; d) Evaporatore; e) Condensatore per acido cloroacetico; f) Reattore di idrogenazione; g) Compressore di idrogeno; h) Condensatore; i) Colonna di distillazione; j) Condensatore per acido acetico
4. Usi dell’acido cloroacetico
L’acido cloroacetico è un composto chimico versatile che viene utilizzato in un’ampia gamma di applicazioni industriali. Uno dei suoi usi principali è la produzione di carbossimetilcellulosa, o CMC, che ammonta a diverse centinaia di migliaia di tonnellate all’anno.
Oltre alla CMC, l’acido cloroacetico può anche reagire con l’amido per produrre amido carbossimetilico, che è ampiamente utilizzato quanto la CMC. Mentre altri polisaccaridi possono anche essere modificati con l’acido cloroacetico, non sono così comunemente impiegati.
Un’altra applicazione significativa dell’acido cloroacetico è nella produzione di erbicidi a base di acidi arilidrossiacetici, in particolare acidi clorofenossialcanoici. Questi erbicidi sono tra i più ampiamente utilizzati nel settore agricolo.
Inoltre, l’acido cloroacetico e il metilcloroacetato vengono utilizzati nella produzione dell’insetticida dimetoato, nonché degli erbicidi benazolina e metil b-naftilossiacetato.
Un terzo importante utilizzo dell’acido cloroacetico è nella produzione di acido tioglicolico, noto anche come acido mercaptoacetico. Ciò si ottiene facendo reagire l’acido cloroacetico con acido solfidrico di sodio o potassio o altri composti dello zolfo.
L’acido tioglicolico viene impiegato in varie forme, tra cui il suo sale, estere o derivato. La maggior parte dell’acido tioglicolico prodotto viene utilizzato nella produzione di stabilizzanti per poli(cloruro di vinile).
Viene utilizzato anche nei cosmetici per capelli e in altre applicazioni industriali come la produzione di betaine a catena lunga, come la N-lauril betaina, che sono tensioattivi utilizzati in detergenti e prodotti per la cura della persona.
Oltre a queste applicazioni, l’acido cloroacetico ha una moltitudine di altri usi nelle reazioni di sintesi organica. Ad esempio, l’acido cianoacetico o i suoi esteri possono essere impiegati per produrre caffeina e barbiturici, che sono importanti ipnotici.
L’acido cloroacetico può condensarsi con idrocarburi aromatici per formare acidi arilacetici.
Quando reagisce con il naftalene, l’acido 1-naftilacetico viene prodotto come prodotto principale e l’acido 2-naftilacetico viene generato come sottoprodotto. Entrambe le sostanze sono note per promuovere la crescita delle piante.
Infine, l’acido cloroacetico svolge un ruolo essenziale nella sintesi di cumarina e vitamina B6.
Riferimento
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
