Acetone: produzione, reazioni e usi

Cos’è l’acetone?
L’acetone, noto anche come 2-propanone, è un liquido incolore e infiammabile dall’odore pungente e bassa viscosità. È il chetone più semplice, con formula C3H6O. L’acetone è miscibile con l’acqua, il che significa che si mescola facilmente con l’acqua in qualsiasi proporzione.
Viene utilizzato principalmente come solvente e intermedio nella sintesi di vari prodotti chimici, come bisfenolo A, metilmetacrilato, prodotti chimici aldolici (alcol diacetonico, ossido di mesitile e metilisobutilchetone) e altri prodotti.
Storicamente, l’acetone veniva prodotto commercialmente tramite la distillazione a secco dell’acetato di calcio fino ai primi anni del 1900.
L’acetone è presente anche in natura, come negli alberi e nelle piante, ed è anche prodotto metabolicamente all’interno del corpo umano, principalmente dalla scomposizione dei grassi. Inoltre, l’acetone è facilmente biodegradabile.
Sommario
1. Produzione di acetone
Attualmente, il processo del cumene rappresenta il mezzo più significativo per la produzione di acetone, rappresentando oltre 6 milioni di tonnellate di produzione a livello globale ogni anno.
Altri metodi di produzione contribuiscono per meno del 5% alla capacità mondiale.
1.1. Produzione di acetone mediante processo del cumene
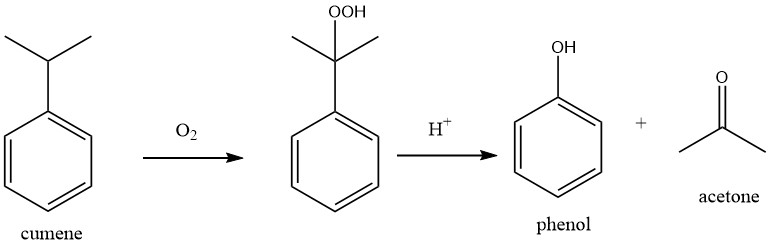
La produzione di acetone da benzene e propene comporta un processo in due fasi.
Nella prima fase, l’alchilazione di Friedel-Crafts viene utilizzata per produrre cumene da benzene e propene nel processo del cumene.
Durante questo processo, gli idrocarburi bassobollenti, come il propano, vengono separati dalla materia prima del propene nell’unità di distillazione del cumene. I componenti altobollenti, principalmente poliisopropilbenzeni, vengono separati e raccolti come residuo.
Le materie prime di benzene e propene generano una piccola quantità di acqua come impurità.
Nella seconda fase del processo, nota come processo Hock, il cumene viene ossidato con ossigeno atmosferico per produrre idroperossido di cumene. Utilizzando un acido minerale forte come catalizzatore, l’idroperossido di cumene viene quindi scisso per produrre fenolo e acetone.
Durante il processo di distillazione, i componenti bassobollenti, principalmente chetoni dall’acetone, vengono separati, mentre i componenti altobollenti formati nell’unità di ossidazione e scissione vengono raccolti come residuo.
Nel processo fenolo-acetone, viene generata una certa quantità di acqua di processo che deve essere trattata in un impianto di trattamento biologico delle acque reflue.
La reazione complessiva del processo può essere descritta come una doppia ossidazione, in cui il benzene viene ossidato a fenolo e il propene viene ossidato ad acetone.
1.2. Produzione di acetone mediante deidrogenazione del 2-propanolo

La deidrogenazione del 2-propanolo (isopropanolo), che si forma tramite l’idratazione del propene, rappresenta una via alternativa per produrre acetone. È noto che la reazione di deidrogenazione è endotermica.
Questo processo è stato responsabile di circa il 50-60% della produzione totale di acetone negli Stati Uniti durante gli anni ’70.
Tuttavia, attualmente, il processo di ossidazione del cumene con acetone come coprodotto è diventato la principale fonte di produzione di acetone in tutto il mondo.
In letteratura sono stati segnalati diversi catalizzatori per la deidrogenazione del 2-propanolo.
Il propene è il sottoprodotto primario, che si forma tramite la disidratazione dell’alcol corrispondente. Oltre al propene, si formano anche aldeidi e ossido di mesitile.
Il prodotto di deidrogenazione, che contiene aldeidi, ossido di mesitile, acqua, 2-propanolo e acetone, viene sottoposto a una fase di lavaggio con soda caustica acquosa al 35% per rimuovere le aldeidi. Segue la distillazione in diverse fasi per rimuovere le caldaie leggere e l’acetone dall’alcol e dall’acqua.
1.3. Produzione di acetone mediante ossidazione del propene

Il processo Wacker-Hoechst offre un metodo elegante per la produzione di acetone. Questo processo prevede l’ossidazione del propene utilizzando aria o ossigeno come ossidante, a una temperatura di 110-120 °C e una pressione di 10-14 bar.
Nel processo viene utilizzato un sistema catalizzatore costituito da PdCl2 e CuCl2.
Il PdCl2 funge da catalizzatore, mentre il CuCl2 riossida Pd° allo stato bivalente. Il cloruro di rame (I) può essere facilmente ossidato a cloruro di rame (II) utilizzando ossigeno.
La selettività di questo processo per l’acetone è di circa il 92%, con la propionaldeide formata come sottoprodotto, insieme a composti clorurati come monocloracetone e 1,1-dicloroacetone.
Sono possibili due diversi processi per l’ossidazione diretta, simili al processo dell’acetaldeide.
Nel primo processo, il catalizzatore viene trattato con propene e ossigeno in un’unica fase.
Nel secondo processo, il catalizzatore viene trattato con propene nella prima fase e poi rigenerato nella seconda fase utilizzando ossigeno.
Il processo a due fasi è preferito in quanto una miscela propene-propano può essere utilizzata come alimentazione. Il propano è inerte all’ossidazione e non partecipa alla reazione.
2. Reazioni chimiche dell’acetone
L’acetone puro è altamente sensibile a potenti agenti ossidanti, come il perossido di idrogeno e i perossidi organici.
Quando esposto ad acido diluito e perossido di idrogeno, si forma il trimero di perossido di acetone.
Quando l’acetone reagisce con forti agenti riducenti, genera calore e può causare esplosioni.
Anche un forte alcali innesca la produzione di calore quando reagisce con l’acetone.
Inoltre, l’acetone miscelato con cloroformio in presenza di alcali può causare una reazione violenta.
La reattività dell’acetone è regolata dal legame CO. L’atomo di ossigeno tende ad attrarre gli elettroni del doppio legame, come mostrato nella struttura mesomerica del gruppo carbonilico. Di conseguenza, il meccanismo di reazione carbonilica più comune è l’attacco nucleofilo all’atomo di C del gruppo carbonilico.
La protonazione dell’atomo di ossigeno accompagna frequentemente l’attacco nucleofilo.
La reazione dell’acetone con HCN in presenza di una base come KOH porta alla formazione di acetone cianidrina, con lo ione cianuro, derivato da HCN e KOH, responsabile dell’attacco nucleofilo.
Gli acidi catalizzano l’aggiunta di nucleofili deboli.
La protonazione dell’atomo di ossigeno del gruppo carbonilico crea un carbocatione che può essere attaccato più facilmente dal nucleofilo. Un esempio di tale reazione è la formazione di un emichetale o di un chetale dalla reazione di un alcol con acetone.
In letteratura sono state riportate varie reazioni nucleofile con acetone, come la formazione di alcoli terziari mediante reazione con reagenti di Grignard (RmgX), 2-propanolo con LiAlH4 o NaBH4 e immine con ammine primarie, ossima con idrossilammina e fenilidrazone con idrazina.
L’atomo di idrogeno α del gruppo carbonilico nell’acetone è acido. La presenza del gruppo carbonilico aumenta la polarizzazione degli elettroni, dando origine a un atomo di idrogeno più elettropositivo. L’anione risultante è stabilizzato dalla dislocazione mesomerica della carica negativa tra l’atomo di carbonio e l’atomo di ossigeno carbonilico.
La reazione aldolica catalizzata da basi di due molecole di acetone in presenza di alcali produce alcol diacetonico.
3. Usi dell’acetone
L’acetone è utilizzato come intermedio chimico nella produzione di diverse sostanze chimiche, tra cui metilmetacrilato, bisfenolo A e composti aldolici come alcol diacetonico, ossido di mesitile e metilisobutilchetone.
Il suo uso principale nell’industria chimica è la produzione di acetone cianidrina.
Oltre al suo uso come intermedio chimico, l’acetone è un solvente versatile con numerose applicazioni. Si stima che la produzione annuale globale di acetone sia di oltre 6 milioni di tonnellate.
Nel 2010, le applicazioni di solventi diretti rappresentavano il 29% dell’uso di acetone, seguite da acetone cianidrina/MMA al 24% e bisfenolo A al 22%.
Riferimento
- Acetone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_079.pub4
