Trichloroacétaldéhyde (Chloral)
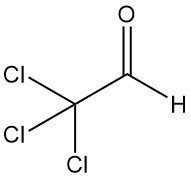
Le trichloroacétaldéhyde [75-87-6], également connu sous le nom de chloral ou 2,2,2-trichloroéthanal (CCl3CHO), est un liquide incolore d’un poids moléculaire de 147,39 g/mol. Il a été produit pour la première fois en 1832 par Justus von Liebig grâce à la chloration de l’éthanol.
Le chloral revêt une importance historique en tant que premier médicament hypnotique, introduit en 1869. En outre, il sert de précurseur au célèbre insecticide DDT (1,1,1-trichloro-2,2-bis(4-chlorophényl)éthane), découvert en 1941.
Alors que le chloral était un produit chimique précieux dans les années 1960, son utilisation a considérablement diminué depuis lors en raison des restrictions sur le DDT et d’autres insecticides chlorés dues à des préoccupations environnementales.
Table des matières
1. Propriétés physiques du trichloroacétaldéhyde
Le chloral, également connu sous le nom de trichloroacétaldéhyde ou trichloroéthanal, présente les propriétés physiques suivantes :
- Point de fusion : −56,5 °C
- Point d’ébullition : 97,8 °C à 101,3 kPa
- Densité : 1,5121 g/cm³ à 20 °C
- Indice de réfraction : 1,4557 à 20 °C
- Pression de vapeur : 4,7 kPa à 20 °C
- Apparence : Liquide incolore, mobile et huileux
- Odeur : Pénétrant
- Solubilité : Facilement soluble dans l’eau, l’alcool, l’éther et le chloroforme
- Coefficient de partage octanol-eau : 0,99 (faible)
- Formation d’azéotropes : forme des azéotropes avec le 1,2-dichloroéthane, l’heptane et benzène
2. Réactions chimiques du trichloroacétaldéhyde
Le trichloroacétaldéhyde possède des propriétés chimiques distinctes par rapport aux aldéhydes classiques, principalement en raison de la forte influence attractive d’électrons de ses trois atomes de chlore. Il se décompose lors de l’exposition au soleil ou à la chaleur.
Le chloral réagit facilement avec les nucléophiles, formant divers produits d’addition. Avec les alcools, il génère des hémiacétals isolables (CCl3CH(OH)OR) et, avec l’eau, il forme le célèbre hydrate de chloral [302-17-0] (CCl3CH(OH)2, point de fusion 53 °C et point d’ébullition 97,5 °C).
Contrairement à la plupart des aldéhydes, le chloral ne peut pas participer à de nombreuses condensations catalysées par une base. Les bases fortes ont tendance à cliver sa liaison carbone-carbone, conduisant à des produits comme le chloroforme et HCO2Na, ou HCONR2 (R = alkyle), selon le réactif spécifique.
CCl3CHO + NaOH → CHCl3 + HCO2Na
CCl3CHO + R2NH → CHCl3 + HCONR2 (R = alkyl)
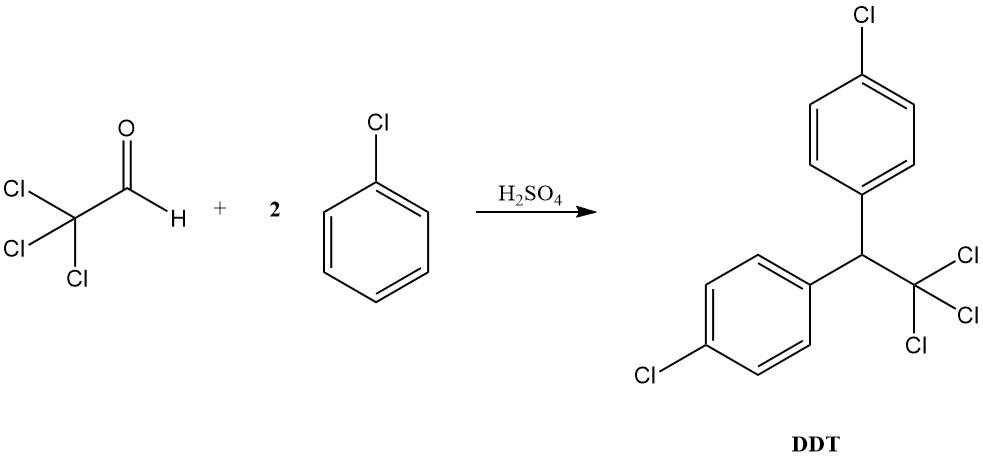
Dans des conditions acides, le chloral se comporte davantage comme un aldéhyde typique, formant des acétals avec des alcools et se condensant avec des composés aromatiques pour produire des diaryltrichloroéthanes, comme en témoigne la formation de DDT à partir du chlorobenzène.
En présence d’initiateurs anioniques comme le tert-butoxyde de lithium, le chloral polymérise en un haut polymère insoluble et ininflammable de formule [CH(CCl3)O]n. Ce polymère n’a cependant aucune application commerciale connue.
L’oxydation du trichloroacétaldéhyde donne de l’acide trichloroacétique.
3. Production de trichloroacétaldéhyde
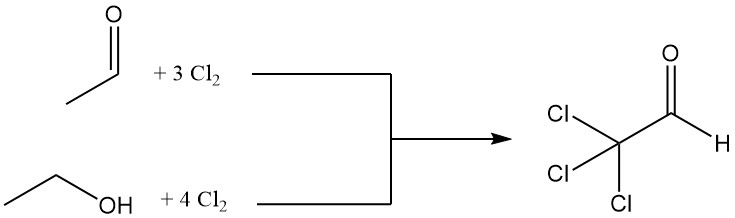
Le chloral est produit par chloration de l’acétaldéhyde ou de l’éthanol, l’acétaldéhyde étant souvent préféré en raison de ses avantages économiques.
CH3CHO + 3 Cl2 → CCl3CHO + 3 HCl
L’acétaldéhyde réagit avec le chlore dans une solution d’acide chlorhydrique pour réduire les sous-produits de condensation et l’oxydation de l’aldéhyde. Le trichlorure d’antimoine est utilisé comme catalyseur.
La température est augmentée progressivement de 0 °C à 90 °C pour maintenir la vitesse de réaction.
Le chloral est distillé du mélange sous forme d’hydrate, qui est ensuite décomposé avec de l’acide sulfurique concentré pour se séparer de la couche acide plus lourde. Il est ensuite distillé par une colonne de fractionnement.
La chloration d’une mole d’éthanol nécessite quatre moles de chlore, dont une mole est utilisée pour l’oxydation en acétaldéhyde.
CH3CH2OH + Cl2 → CH3CHO + 2 HCl
Les cuves de réaction et la tuyauterie sont recouvertes de matériaux résistants aux acides (céramique, etc.) pour résister à l’acide chlorhydrique chaud. Les vannes sont fabriquées en alliages nickel-molybdène (Hastelloy B) pour résister à la corrosion.
La pureté du chloral de qualité technique varie de 94 % à 99 %, l’eau étant la principale impureté.
4. Utilisations du trichloroacétaldéhyde
Le chloral a été initialement utilisé dans la production de l’insecticide DDT, mais ses utilisations vont bien au-delà. Bien que le DDT soit interdit dans de nombreux pays, le chloral a été utilisé dans la production de divers autres insecticides, comme le méthoxychlore et le Naled, et d’herbicides (acide trichloroacétique).
Il est également utilisé dans la production de mousse de polyuréthane rigide.
Le trichloroacétaldéhyde peut provoquer le gonflement des granules d’amidon à température ambiante, ce qui pourrait avoir un impact sur diverses industries basées sur l’amidon.
L’hydrate de chloral, la forme hydratée du chloral, était utilisé en médecine comme médicament sédatif et hypnotique (chloral bétaïne, α-chloralose et triclofos sodique). Bien qu’il soit principalement utilisé pour le traitement de l’insomnie à court terme, il a également été utilisé pour gérer l’anxiété, induire une sédation avant les procédures et traiter les symptômes de sevrage de l’alcool et d’autres drogues.
Son utilisation chez les enfants a diminué au profit d’alternatives plus sûres, mais elle trouve encore des applications dans certaines situations médicales.
En microscopie, la solution de Hoyer, contenant de l’hydrate de chloral, est utilisée pour monter divers organismes comme les bryophytes, les fougères, les graines et les arthropodes pour une observation détaillée.
5. Toxicologie du chloral
Symptômes d’exposition :
- Le chloral et son hydrate présentent des propriétés identiques et agissent comme dépresseurs du système nerveux central.
- Les doses thérapeutiques (0,5 à 1,0 g) affectent peu la respiration et la tension artérielle, mais des doses plus élevées dépriment les deux.
- Des effets synergiques se produisent avec l’éthanol, amplifiant l’action du chloral.
- L’irritation de la peau et des muqueuses est un effet secondaire connu.
- Le métabolisme convertit le chloral en trichloroéthanol, le principal contributeur à ses effets physiologiques.
- L’excrétion se produit principalement par conjugaison urinaire des glucuronides.
Toxicité :
- L’ingestion orale de 4 à 30 g s’est avérée mortelle chez les adultes.
- Les études d’inhalation chez le rat démontrent une toxicité élevée, avec une CL50 de 440 mg/m³ pour une exposition de 4 heures.
- Une exposition chronique à des concentrations plus faibles (75 à 78 mg/m³) induit de graves lésions pulmonaires et la mortalité chez les rats.
- Une mutagénicité est observée dans le test d’Ames.
- Il n’existe aucune valeur limite de seuil (TLV) ou concentration maximale autorisée (MAK) établie pour le chloral, ce qui incite à une manipulation prudente similaire à la chloroacétaldéhyde.
Cancérogénicité :
- Le Centre international de recherche sur le cancer (CIRC) classe le chloral et l’hydrate de chloral dans le groupe 3 : « inclassable quant à sa cancérogénicité pour l’homme ».
- Bien que des preuves limitées suggèrent une cancérogénicité dans les études animales, les données sur les humains restent insuffisantes.
Classification UE :
- Sur la base de la directive 67/548/CEE, le chloral et l’hydrate de chloral sont désignés comme « toxiques » (T) avec les phrases de risque R25-36/38, signifiant une toxicité lors de ingestion et irritation de la peau/des yeux.
Référence
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
