Procédés de production de dioxyde de titane
Le dioxyde de titane commercial est fabriqué selon deux méthodes industrielles distinctes : le procédé au sulfate et le procédé au chlorure.
Le procédé au sulfate, une technique plus ancienne, commence par la digestion de matières premières contenant du titane, telles que l’ilménite ou les scories de titane (→ article détaillé sur les matières premières), dans de l’acide sulfurique concentré. Cette réaction se produit à 150–220 °C, produisant une liqueur noire contenant du titane dissous, du fer et diverses impuretés.
L’hydrolyse ultérieure de la solution de sulfate de titanyle précipite de l’oxyde de titane hydraté relativement pur (TiO(OH)2 ou TiO2 dihydraté) et des étapes de purification supplémentaires éliminent les impuretés restantes. L’oxyhydrate de titane subit ensuite une calcination, un broyage et, généralement, un enrobage de composés inorganiques.
Le procédé au chlorure consiste à chlorer des matières premières contenant du titane, notamment l’ilménite, le leucoxène, le rutile, les scories de titane ou l’anatase, à des températures comprises entre 700 et 1 200 °C. Le tétrachlorure de titane (TiCl4) obtenu est ensuite oxydé entre 900 et 1 400 °C pour former du dioxyde de titane, qui est ensuite broyé et enrobé de composés inorganiques.
Ces deux procédés sont exclusivement utilisés pour la production de pigments de dioxyde de titane. D’autres méthodes de fabrication existent pour le TiO2 sans propriétés pigmentaires, principalement pour la synthèse de nanoparticules de dioxyde de titane. Parmi les exemples, on peut citer l’hydrolyse des alcoolates de titane ou la réaction pyrolytique du TiCl4 avec l’eau (procédé aérosil).
Table des matières
1. Production de dioxyde de titane par le procédé au sulfate
La production de dioxyde de titane par le procédé au sulfate comprend plusieurs étapes séquentielles, comme illustré à la Figure 1.
1.1. Broyage
Les matières premières contenant du titane sont séchées à moins de 0,1 % d’humidité afin d’éviter les réactions prématurées et l’échauffement lors du mélange avec de l’acide sulfurique. Les matières sont ensuite broyées dans des broyeurs à boulets ou à bol pour obtenir une granulométrie moyenne inférieure à 40 μm.
1.2. Digestion
La digestion discontinue est la procédure standard où les matières premières broyées (ilménite, scories de titane ou mélanges) sont mélangées à 80–98 % de H2SO4.
La réaction peut être initiée par ajout d’oléum à de l’acide sulfurique à 80 % ou par ajout d’eau et/ou de vapeur à une suspension de matières premières dans de l’acide sulfurique concentré. Dans les deux cas, l’enthalpie de mélange déclenche une digestion chimique exothermique qui atteint une température maximale d’environ 200 °C ou plus.
Le rapport H2SO4/matière première est ajusté pour obtenir un rapport de 1,8 à 2,2 en poids d’acide sulfurique/dioxyde de titane dans la liqueur noire obtenue (indice d’acidité).
La réaction dans le digesteur (f) débute par l’ajout d’eau, d’acide sulfurique dilué, d’oléum ou de vapeur. La chaleur d’hydratation de l’acide provoque une augmentation initiale de la température à 50-70 °C. La formation exothermique de sulfate qui s’ensuit porte la température à 170-220 °C.
L’eau ajoutée et générée par la réaction s’évapore complètement pour former un résidu de digestion solide. Un chauffage externe peut être nécessaire pour l’acide dilué ou les matières premières peu solubles.
Après avoir atteint la température maximale, le mélange réactionnel solide nécessite une maturation de 1 à 12 heures, la durée dépendant de la matière première. La maturation maximise la solubilité des composants contenant du titane. L’agitation de l’air pendant l’augmentation de la température influence positivement le rendement de la digestion.
Il existe des procédés de digestion en continu. Une méthode éprouvée consiste à alimenter en continu un convoyeur à vis à double palette avec un mélange d’ilménite et d’eau additionné d’acide sulfurique. Un résidu friable se forme après un court temps de séjour (moins d’une heure). Ce procédé est adapté aux matières premières hautement réactives.
1.3. Redigestion
En raison du coût élevé des matières premières titanifères, des tentatives ont été faites pour réutiliser les résidus solides de digestion (contenant 40 à 65 % de dioxyde de titane). Historiquement, ces développements n’ont pas été mis en œuvre à grande échelle en raison de la complexité et du coût élevé des équipements et des conditions de traitement.
Un procédé de redigestion utilisant des équipements et une technologie standard a été proposé en 2001.
1.4. Dissolution et réduction
Le résidu de digestion est dissous dans de l’eau froide ou de l’acide dilué recyclé à une température inférieure à 85 °C afin d’éviter une hydrolyse prématurée, notamment pour les produits d’ilménite. De l’air est introduit pour l’agitation pendant la dissolution. Pour l’ilménite, la concentration de la solution de dioxyde de titane est de 8 à 12 % en poids, et pour les scories, de 13 à 18 % en poids.
Le fer trivalent (Fe3+) est hydrolysé avec les composés du titane et adhère à l’hydrate d’oxyde de titane. Par conséquent, tout le Fe3+ doit être réduit en Fe2+ à l’aide de ferraille pendant la dissolution de l’ilménite ou lors d’une étape ultérieure.
Pour éviter la réoxydation du fer lors du traitement ultérieur, une petite quantité de Ti3+ est conservée jusqu’à la fin de l’hydrolyse. Le Ti3+ est formé par l’utilisation de ferraille excédentaire lors de la réduction du Fe3+. Le Ti4+ peut également être partiellement réduit en Ti3+ dans des conditions optimales. Cette solution concentrée de Ti3+ est ensuite ajoutée à la solution réactionnelle principale.
Les solutions obtenues à partir de scories de titane contiennent déjà des quantités plus élevées de Ti3+, qui doivent être réduites par oxydation à l’oxygène de l’air pour éviter toute perte de rendement lors de l’hydrolyse. Le Ti3+ présent lors de la digestion des scories réduit partiellement l’acide sulfurique en SO2 ou H2S, ce qui nécessite un nettoyage approfondi des gaz d’échappement, en particulier si les scories contiennent des métaux lourds.
La digestion mixte des scories d’ilménite et de titane est possible. Le Ti3+ des scories réduit alors tout le Fe3+ en Fe2+. Ceci peut également être réalisé en mélangeant les produits dissous issus de digestions séparées des scories d’ilménite et de titane.
1.5. Clarification
Toutes les matières solides non dissoutes doivent être soigneusement éliminées de la solution afin d’éviter toute contamination par l’hydrolysat. La méthode la plus économique consiste à effectuer une décantation préliminaire dans un épaississeur (g), puis à filtrer les sédiments à l’aide d’un filtre à tambour rotatif sous vide (h) ou d’un filtre-presse.
Le surnageant de l’épaississeur est également passé à travers des filtres-presses (i) pour éliminer les fines résiduelles. En raison de ses faibles propriétés de filtration, le filtre rotatif fonctionne généralement comme un filtre à précouche. L’ajout de produits chimiques peut favoriser la floculation et la sédimentation des fines dans l’épaississeur.
Une clarification en une seule étape utilisant des filtres-presses automatisés a également été proposée.
1.6. Cristallisation
Après réduction du Fe3+, les solutions issues de la digestion des scories contiennent 5 à 6 % en poids de FeSO4 et celles issues de la digestion de l’ilménite contiennent 16 à 20 % en poids de FeSO4. Les solutions d’ilménite sont refroidies sous vide pour cristalliser et séparer le FeSO4·7 H2O (copperas) (j) afin de réduire le FeSO4 rejeté avec l’acide résiduaire après hydrolyse. Cela augmente la concentration de dioxyde de titane dans la solution d’environ 25 %.
Le sel de cuivre est séparé par filtration ou centrifugation (k).
Le sulfate de fer est principalement utilisé pour la purification de l’eau, comme agent réducteur de chromate pour le ciment et comme matière première pour les pigments d’oxyde de fer. Il peut également être déshydraté pour former FeSO4·H2O ou décomposé thermiquement en oxyde de fer(III) et dioxyde de soufre.
1.7. Hydrolyse
L’hydrate d’oxyde de titane est précipité par hydrolyse à 94–110 °C. D’autres composants de la matière première solubles dans l’acide sulfurique, principalement le niobium sous forme d’hydrate d’oxyde, précipitent simultanément. L’hydrolyse est réalisée dans des cuves agitées revêtues de briques (n) avec injection de vapeur. L’hydrolysat obtenu est dépourvu de propriétés pigmentaires.
Les propriétés des hydrolysats sont fortement influencées par le degré de floculation des particules primaires. La taille des particules primaires d’hydrolysats est d’environ 5 nm, tandis que celle des particules de pigment TiO2 est de 200 à 300 nm. Plusieurs facteurs influencent les propriétés des hydrolysats :
1. L’hydrolyse des solutions concentrées de sulfate de titane (170 à 230 g de TiO2/L) est lente et incomplète sans noyaux appropriés, ce qui accélère l’hydrolyse. Les noyaux sont principalement produits par la méthode de Mecklenburg ou de Blumenfeld.
Dans la méthode de Mecklenburg, l’hydrate d’oxyde de titane colloïdal est précipité avec de l’hydroxyde de sodium à 100 °C. 1 % de cet hydrate est utilisé comme germe.
Dans la méthode Blumenfeld, une petite partie de la solution de sulfate est hydrolysée dans de l’eau bouillante, puis ajoutée à la solution principale. Le nombre de germes influence la granulométrie de l’hydrolysat et les caractéristiques de floculation.
2. La granulométrie de l’hydrolysat et le degré de floculation dépendent également de l’intensité de l’agitation pendant la formation des germes de Blumenfeld et la phase initiale d’hydrolyse.
3. La concentration en sulfate de titane influence grandement la floculation de l’hydrolysat et est ajustée par évaporation sous vide, si nécessaire, à 170-230 g/L de dioxyde de titane pendant l’hydrolyse. Des concentrations plus faibles produisent des floculats plus grossiers.
4. L’indice d’acidité doit être compris entre 1,8 et 2,2. Il a un impact significatif sur le rendement en TiO2, la granulométrie de l’hydrolysat et la taille des floculats. Des indices d’acidité élevés entraînent un rendement plus faible et un hydrolysat plus grossier. Une période d’hydrolyse normale (3 à 6 heures) produit 93 à 96 % de dioxyde de titane.
D’autres concentrations de sel, notamment FeSO4, affectent les propriétés de l’hydrolysat. Des concentrations élevées produisent généralement des floculats plus fins.
5. La température influence principalement le rendement volumique-temps et la pureté de l’hydrolysat.
La structure de l’hydrolysat est complexe. Les particules primaires nanocristallines d’anatase présentent une taille d’environ 5 à 6 nm (micrographies électroniques, données de surface BET). Les granulométries conventionnelles (par exemple, diffusion laser) montrent des valeurs allant de quelques centaines à quelques milliers de nanomètres, selon l’intensité de la dispersion.
Les particules primaires s’agrègent en particules secondaires d’environ 30 nm (Figure 3). Ces particules secondaires forment des structures tertiaires d’environ 1 μm. Ces structures tertiaires forment ensuite des structures quaternaires de quelques micromètres.
Le broyage ou la dispersion ultrasonore à haute intensité peuvent décomposer les structures quaternaires. Une énergie de dispersion suffisante peut décomposer partiellement les structures tertiaires.
Lors de la calcination, des transformations morphologiques se produisent :
- À 300–600 °C, les particules primaires se frittent. Les anciennes particules secondaires forment de nouvelles particules primaires d’anatase cristalline, d’environ 20 nm. Il s’agit d’une taille typique pour le dioxyde de titane catalytique.
- À 800–1 000 °C, les particules de 20 nm se frittent. Les particules tertiaires d’origine forment de nouvelles particules primaires de rutile cristallin ou d’anatase, d’environ 200 nm. Il s’agit d’une taille typique pour le dioxyde de titane pigmentaire. Les structures quaternaires d’origine forment des agglomérats de particules pigmentaires, qui sont séparés par une étape de broyage.
1.8. Purification de l’hydrolysat
Après hydrolyse, la phase liquide contient 20 à 28 % d’acide sulfurique et des quantités variables de sulfates dissous selon la matière première. L’oxyde de titane hydraté est séparé de la solution par filtration, puis lavé à l’eau ou à l’acide dilué. Même avec un lavage à l’acide, trop d’ions de métaux lourds restent adsorbés sur l’oxyde de titane hydraté pour la production de pigment blanc.
La plupart des impuretés peuvent être éliminées par réduction (blanchiment). Le résidu de filtration est mis en suspension dans 3 à 10 % d’acide dilué à 50-90 °C, puis mélangé à de la poudre de zinc ou d’aluminium (q). Des agents réducteurs non métalliques (par exemple, HOCH2–SO2Na) peuvent également être utilisés pour le blanchiment.
Après une seconde filtration et un second lavage, l’oxyde de titane hydraté présente de faibles concentrations d’impuretés colorées. Cependant, il contient encore 5 à 10 % d’acide sulfurique chimisorbé, qui ne peut être complètement éliminé par lavage. Il est éliminé par chauffage à haute température.
1.9. Dopage de l’hydrate
Pour produire du dioxyde de titane de haute pureté, l’hydrate d’oxyde de titane est calciné sans ajout afin d’obtenir une qualité de TiO2 relativement grossière, dont la teneur en rutile dépend de la température de chauffage. Pour produire des qualités de pigments spécifiques, l’hydrate d’oxyde de titane doit être traité avec des composés de métaux alcalins et de l’acide phosphorique avant la calcination (r).
Les pigments anatase contiennent plus d’acide phosphorique que les pigments rutiles. Pour les pigments rutiles, des noyaux de rutile (moins de 10 %, généralement 1 à 5 %) sont ajoutés. ZnO, Al2O3 et/ou Sb2O3 (moins de 3 %) sont ajoutés pour stabiliser la structure cristalline.
Les noyaux (ou germes de rutile) sont produits par conversion d’oxyde de titane hydraté purifié en titanate de sodium, lequel est lavé pour éliminer le sulfate, puis traité à l’acide chlorhydrique. Les noyaux de rutile peuvent également être préparés par précipitation à partir de solutions de tétrachlorure de titane avec une solution d’hydroxyde de sodium.
1.10. Calcination
L’oxyde de titane hydraté dopé est filtré à l’aide de filtres rotatifs à vide ou de filtres-presses pour éliminer l’eau. Les filtres rotatifs sous vide atteignent une teneur en TiO2 d’environ 30 à 40 %. Les filtres rotatifs sous pression ou les filtres-presses automatiques atteignent une teneur en TiO2 d’environ 50 % ou plus.
La calcination a lieu dans des fours rotatifs (t), chauffés directement au gaz ou au fioul à contre-courant. Environ les deux tiers du temps de séjour total (4 à 20 heures) sont consacrés au séchage du matériau. Au-dessus d’environ 500 °C, le trioxyde de soufre est éliminé et partiellement décomposé en dioxyde de soufre et en oxygène à des températures plus élevées.
Le produit atteint une température maximale de 800 à 1 100 °C, selon le type de pigment, le débit et le profil de température du four. La teneur en rutile, la granulométrie, la distribution granulométrique et la formation d’agrégats sont très sensibles aux régimes de fonctionnement du four.
À la sortie du four, le clinker peut être refroidi indirectement ou directement par air dans des refroidisseurs à tambour (u). La température des gaz d’échappement du four doit dépasser 300 °C afin d’éviter la condensation d’acide sulfurique dans les tuyauteries.
Il est possible d’économiser de l’énergie en faisant recirculer une partie du gaz vers la chambre de combustion du four. Ce gaz peut être mélangé aux gaz combustibles pour remplacer partiellement l’air ou servir à concentrer l’acide dilué. Il est ensuite acheminé vers le système de purification des gaz résiduaires.
1.11. Broyage
Les agglomérats et les agrégats du clinker sont réduits à l’état pigmentaire par broyage humide ou sec. La réduction grossière doit être effectuée dans des broyeurs à marteaux (broyeurs Raymond) ou des broyeurs à cylindres avant le broyage humide dans des broyeurs à boulets ou à sable (avec ajout d’un agent dispersant).
La fraction grossière peut être extraite de la suspension par centrifugation ou hydrocyclones et recyclée vers les broyeurs. Les broyeurs à marteaux, les broyeurs à battoirs, les broyeurs à cylindres, et en particulier les broyeurs pendulaires et à jet de vapeur, conviennent au broyage à sec.
Des additifs de broyage spéciaux peuvent être utilisés comme agents mouillants lors du traitement ultérieur des pigments ou pour améliorer la dispersibilité des pigments non traités.
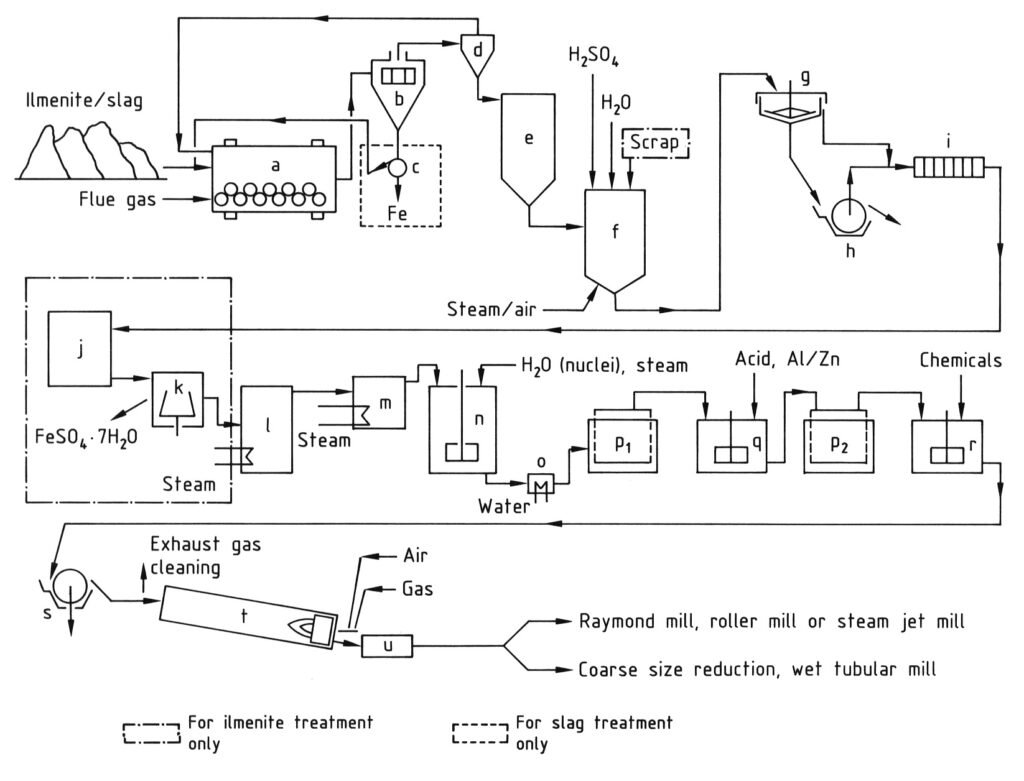
a) Broyeur à boulets/sécheur ; b) Tamis ; c) Séparateur magnétique ; d) Cyclone ; e) Silo ; f) Cuve de digestion ; g) Épaississeur ; h) Filtre rotatif ; i) Filtre-presse ; j) Cristallisoir ; k) Centrifugeuse ; l) Évaporateur sous vide ; m) Préchauffeur ; n) Cuve agitée pour l’hydrolyse ; o) Refroidisseur ; p) Filtres Moore ; q) Cuve agitée pour le blanchiment ; r) Cuve agitée pour le dopage ; s) Filtre rotatif pour la déshydratation ; t) Four rotatif ; u) Refroidisseur
2. Production de dioxyde de titane par le procédé au chlorure
La production de pigment de dioxyde de titane par le procédé au chlorure est illustrée à la Figure 2.
2.1. Chloration
Le titane présent dans les matières premières est converti en tétrachlorure de titane sous atmosphère réductrice. Le coke de pétrole calciné, à très faible teneur en cendres, est utilisé comme agent réducteur. Grâce à sa faible teneur en matières volatiles, la formation de HCl est minimale. Le dioxyde de titane réagit de manière exothermique selon l’équation suivante :
TiO2 + 2 Cl2 + C → TiCl4 + CO2
Lorsque la température augmente, une réaction endothermique se produit entre le dioxyde de carbone et le carbone pour former du monoxyde de carbone. L’oxygène doit être co-alimenté avec le chlore pour maintenir la température de réaction entre 800 et 1200 °C. La consommation de coke est de 250 à 300 kg par tonne de dioxyde de titane. Si l’on utilise du chlore contenant du CO2 issu de la combustion de TiCl4, la consommation de coke passe à 350 à 450 kg.
L’ancienne chloration en lit fixe est obsolète. Dans ce procédé, le titane broyé est mélangé à du coke de pétrole et à un liant. Des briquettes sont formées. La chloration est réalisée à 700-900 °C dans des réacteurs à revêtement en briques.
La chloration en lit fluidisé a débuté en 1950. Le titane (granulométrie semblable à celle du sable) et le coke de pétrole (granulométrie moyenne environ cinq fois supérieure à celle du dioxyde de titane) réagissent avec le chlore et l’oxygène. Cette réaction se produit dans un réacteur à lit fluidisé à revêtement en briques à 800-1200 °C.
Les matières premières doivent être très sèches pour éviter la formation de HCl. La conversion du chlore est de 98 à 100 %. La conversion du titane dans la matière première est de 95 à 100 %. L’efficacité de ce procédé dépend de la conception du réacteur et de la vitesse des gaz. Les pertes sont principalement dues à l’entraînement des poussières.
Le chlorure de magnésium et le chlorure de calcium peuvent s’accumuler dans le réacteur à lit fluidisé en raison de leur faible volatilité. Le dioxyde de silicium et le silicate de zirconium s’accumulent également car ils se chlorent très lentement à la température du procédé. Tous les autres constituants de la matière première se volatilisent sous forme de chlorures dans les gaz de réaction.
Le revêtement céramique du réacteur à lit fluidisé est sensible à l’abrasion et à la corrosion. Si la chloration est interrompue, il existe un risque de frittage des matières premières, ce qui peut empêcher la fluidisation ultérieure.
2.2. Refroidissement des gaz
Les gaz de réaction sont trempés avec du TiCl4 liquide et le refroidissement peut être indirect ou direct (d).
Les chlorures des autres composants cristallisent et ont tendance à s’accumuler sur les surfaces de refroidissement, en particulier les grandes quantités de chlorures de fer(II) et de fer(III) formées par la chloration de l’ilménite. Lors de cette étape initiale, les gaz de réaction sont refroidis à moins de 300 °C afin de séparer les chlorures qui les accompagnent du TiCl4 par condensation ou sublimation (e).
Le gaz contient principalement du TiCl4. Il est refroidi à moins de 0 °C afin de condenser la majeure partie du TiCl4 (f). Les faibles quantités de TiCl4 et de chlore restantes dans les gaz d’échappement (CO2, CO et N2) sont éliminées par lavage alcalin (t).
2.3. Purification de TiCl4
Les chlorures solides et les poussières entraînées sont séparés de TiCl4 par simple évaporation (distillation) (j). Le chlore dissous est éliminé par chauffage ou réduction avec des poudres métalliques (Fe, Cu ou Sn).
L’élimination du tétrachlorure et de l’oxychlorure de vanadium de TiCl4 par distillation est plus complexe car leurs points d’ébullition sont très proches. Ils sont donc réduits pour former des chlorures de vanadium solides de faible valence (i).
De nombreux agents réducteurs ont été recommandés. Parmi les exemples, on peut citer le cuivre, le trichlorure de titane, le sulfure d’hydrogène, les hydrocarbures, les savons, les acides gras et les amines. Après évaporation (j), le chlorure de titane devrait contenir moins de 5 ppm de vanadium.
Le phosgène et le SiCl4 peuvent être éliminés par distillation fractionnée.
2.4. Oxydation de TiCl4 et récupération de TiO2
Le pigment de dioxyde de titane et le chlore sont formés par réaction du tétrachlorure de titane avec l’oxygène à 900–1400 °C. Le TiCl4 purifié est vaporisé (k) et la vapeur est chauffée indirectement à environ 500–1000 °C (l).
TiCl4 + O2 → 2 Cl2 + TiO2
Cette réaction est modérément exothermique et nécessite une température de réaction élevée. L’oxygène doit donc être chauffé à plus de 1 000 °C (m) à l’aide d’une flamme plasma électrique, en faisant réagir une partie de l’oxygène avec du monoxyde de carbone ou un autre combustible.
Du TiCl4 chaud et de l’oxygène chaud (110 à 150 % de la quantité stœchiométrique) sont introduits séparément dans une chambre de réaction. Ils doivent être mélangés rapidement et complètement pour garantir une vitesse de réaction élevée. De nombreux modèles de réacteurs ont été proposés et utilisés.
Des considérations similaires s’appliquent à l’unité de refroidissement (o). Le pigment doit être refroidi rapidement à moins de 600 °C grâce à des zones de refroidissement de géométries variées. L’adhérence des matériaux aux parois est généralement évitée par l’ajout de particules abrasives telles que du sable, des particules grossières de TiO2, du chlorure de sodium ou d’autres matériaux.
Dans la production de dioxyde de titane par le procédé au chlorure, la conception du réacteur d’oxydation et des matériaux appropriés, ainsi que les paramètres de traitement, sont primordiaux. De nombreux brevets témoignent d’importants efforts d’optimisation pour cette étape du procédé. Seules quelques entreprises possèdent les connaissances nécessaires à l’échelle industrielle pour ce procédé.
Le mélange réactionnel, composé de gaz (Cl2, O2, CO2) et de pigment de dioxyde de titane, peut être refroidi davantage lors de la séparation des particules solides du pigment, soit indirectement, soit directement (p). Le TiO2 est séparé du flux gazeux par séparation gravitaire, cyclones, filtres ou combinaison de dispositifs.
Le flux gazeux est recyclé vers la zone de refroidissement (o) du réacteur d’oxydation et vers le procédé de chloration. Il est recyclé sous forme de chlore oxygéné via l’unité de liquéfaction (u) ou directement sous forme de gaz. Le chlore adsorbé sur le pigment de dioxyde de titane peut être éliminé par chauffage, balayage à l’azote ou à l’air, ou traitement chimique par voie humide.
La séparation par voie humide par trempe du mélange gazeux contenant le pigment (Cl2, O2 et CO2) dans l’eau n’a pas trouvé d’application à grande échelle.
La qualité du pigment de dioxyde de titane (granulométrie et distribution granulométrique) dépend de la température de réaction, des additifs, de l’excès d’oxygène et des conditions rhéologiques du réacteur. Des conditions sophistiquées doivent être établies pour chaque réacteur.
La présence d’eau et/ou de composés alcalins lors de la combustion du TiCl4 génère des noyaux qui favorisent la formation contrôlée de particules de pigment finement divisées à fort pouvoir diffusant. Les additifs peuvent être ajoutés directement à l’oxygène ou produits par combustion de matériaux contenant de l’hydrogène.
La présence de chlorure d’aluminium favorise la formation de rutile et une division pigmentaire plus fine. Il est ajouté en quantités de 0,2 à 2,0 % en poids. L’ajout de PCl3 et de SiCl4 inhibe la formation de rutile, ce qui produit du pigment anatase. Cependant, ce type de pigment n’a pas été jugé pertinent pour le procédé au chlorure.
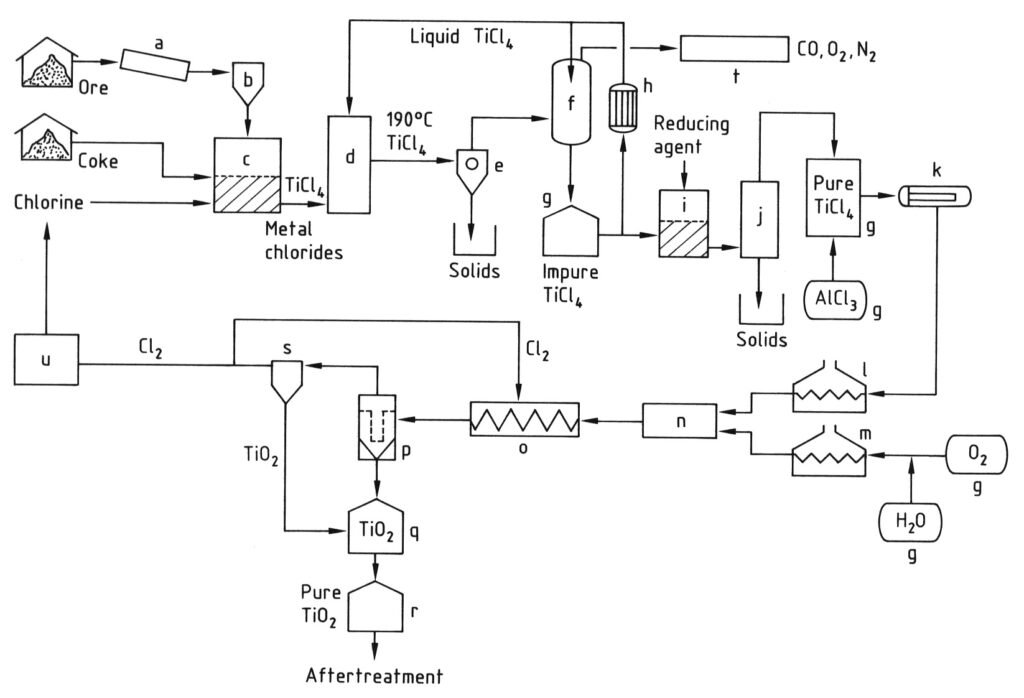
a) Broyeur ; b) Silo ; c) Réacteur à lit fluidisé ; d) Tour de refroidissement ; e) Séparation des chlorures métalliques ; f) Condensation de TiCl4 ; g) Réservoir ; h) Refroidisseur ; i) Réduction du vanadium ; j) Distillation ; k) Évaporateur ; l) Surchauffeur de TiCl4 ; m) Surchauffeur d'O2 ; n) Brûleur ; o) Serpentin de refroidissement ; p) Filtre ; q) Purification de TiO2 ; r) Silo ; s) Purification des gaz ; t) Épuration des gaz résiduaires ; u) Liquéfaction de Cl2
3. Procédé au chlorure et procédé au sulfate pour la production de dioxyde de titane
La capacité de production mondiale de dioxyde de titane est quasiment répartie entre les deux principaux procédés. Actuellement, le procédé au sulfate représente environ 47 % de la capacité, tandis que le procédé au chlorure en représente environ 53 %.
Les chiffres réels de production et de vente sont plus favorables au procédé au chlorure, car certaines usines de sulfate, notamment en Chine, fonctionnent en dessous de leur pleine capacité. La nette tendance à la hausse du procédé au chlorure, qui a culminé à environ 57 % en 1996, a récemment atteint un plateau grâce à l’augmentation significative des nouvelles capacités de production de sulfate en Chine.
Les pigments TiO2 produits par le procédé au chlorure présentent généralement une brillance supérieure et une teinte plus neutre que ceux produits par le procédé au sulfate. Ils présentent souvent un meilleur pouvoir diffusant et une durabilité accrue. Cependant, pour de nombreuses applications, ces deux types de pigments sont interchangeables.
Dans certaines applications, comme pour les fibres et les encres d’impression, les pigments au sulfate peuvent offrir des propriétés supérieures. Cela est souvent attribué à leur caractère moins abrasif. Les pigments de dioxyde de titane destinés à des applications exigeantes subissent presque toujours un post-traitement inorganique.
Les pigments anatase et les dioxydes de titane techniques, nécessitant une modification anatase, notamment ceux destinés aux catalyseurs, aux nanoparticules cosmétiques, aux applications photocatalytiques et aux électrocéramiques, sont produits exclusivement par le procédé au sulfate.
Le procédé au chlorure est souvent considéré comme ayant un impact environnemental moindre. Cette évaluation porte sur le volume de déchets générés sur site par l’usine de dioxyde de titane, hors déchets issus de la valorisation des matières premières.
Certaines grandes usines de sulfate ont réalisé un recyclage complet des acides faibles, et la plupart, voire la totalité, des sous-produits contenant du fer sont vendus ou transformés. En revanche, les déchets de nombreuses usines de chlorure sont encore éliminés dans des décharges ou des puits profonds.
| Classe de pigment | TiO2 (min.), % en poids | Sels hydrosolubles, % en poids | Composés volatils (max.), % en poids |
|---|---|---|---|
| Anatase A 1 (Type A) | 98 | 0,6 | 0,5 |
| Anatase A 2 | 92 | 0,5 | 0,8 |
| Rutile R 1 (Type R) | 97 | 0,6 | 0,5 |
| Rutile R 2 | 90 | 0,5 | 1,5 |
| Rutile R 3 | 80 | * | * |
4. Gestion des déchets dans la production de dioxyde de titane
4.1. Déchets aqueux
Le procédé au sulfate consomme 2,4 à 3,5 tonnes d’acide sulfurique concentré par tonne de dioxyde de titane produite, selon la matière première. Au cours du traitement, une partie de l’acide sulfurique se transforme en sulfates, principalement du sulfate de fer(II). L’acide sulfurique restant est obtenu sous forme d’acide sulfurique libre (acide faible).
La filtration fractionnée et le lavage de la suspension d’hydrolysat produisent 70 à 95 % en poids de SO42- dans une fraction acide faible, qui contient environ 20 à 25 % d’acide libre. Les 5 à 30 % de sulfate restants sont fortement dilués dans l’eau de lavage.
Historiquement, le rejet direct d’acide dans les eaux libres ou côtières était une pratique courante. Le problème de l’acide faible a suscité une importante controverse politique. Par conséquent, la Communauté européenne a imposé l’arrêt des rejets d’acides faibles en eaux libres dès 1993.
Les producteurs européens de dioxyde de titane ont développé divers procédés de traitement des effluents afin de respecter les réglementations environnementales. Parmi les principaux procédés figurent la précipitation du gypse à partir d’acides faibles et la concentration/récupération de l’acide libre et lié.
Dans le procédé de production de gypse, les effluents acides sont d’abord traités avec du CaCO3 finement divisé pour précipiter le gypse blanc. Ce dernier est ensuite filtré, lavé et séché. Il est ensuite utilisé pour la fabrication de plaques de plâtre. Dans un deuxième temps, les sulfates métalliques résiduels du filtrat sont précipités sous forme d’hydroxydes métalliques avec du gypse supplémentaire par ajout d’hydroxyde de calcium. Ce mélange, appelé gypse rouge, doit être mis en décharge.
La production de pigments d’oxyde de fer à partir d’une solution de sulfate de fer, obtenue après neutralisation partielle d’acides faibles par du CaCO3 ou du fer métallique, a également été suggérée.
Lors du processus de recyclage, l’acide sulfurique libre et lié (sous forme de sulfates métalliques) peut être récupéré à partir d’acide faible par concentration et craquage thermique dans un four à lit fluidisé (k, Figure 3). Le procédé comporte deux étapes :
- Concentration et récupération de l’acide libre par évaporation.
- Séparation et décomposition thermique des sulfates métalliques, et production d’acide sulfurique à partir du dioxyde de soufre obtenu.
En raison des besoins énergétiques, seul l’acide contenant plus de 20 % d’acide sulfurique est économiquement récupérable par évaporation. L’acide faible est concentré d’environ 20-25 % à environ 28 % avec une consommation de chaleur minimale, en utilisant la chaleur résiduelle de la production d’acide sulfurique par contact ou des gaz résiduaires du four de calcination du dioxyde de titane.
Après une évaporation préliminaire, une concentration supplémentaire a lieu dans des évaporateurs sous vide. La pression de vapeur d’eau diminue fortement avec l’augmentation de la concentration en H2SO4. L’évaporation produit une suspension de sulfates métalliques dans de l’acide sulfurique à 60-70 % (étape 1 de la figure 3).
La suspension est refroidie à 40-60 °C dans une série de cuves agitées (étape 2, d) afin d’obtenir un produit présentant de bonnes propriétés de filtration et un acide recyclable. La filtration (étape 3, e) est généralement réalisée avec des filtres sous pression afin d’obtenir un résidu de filtration à faible teneur en liquide résiduel.
Les exigences de concentration de l’acide recyclé dans le procédé de digestion dépendent de la qualité de la matière première contenant du titane. Pour les matières premières à forte teneur en titane, l’acide sulfurique à 65-70 % séparé des sulfates métalliques doit être concentré à 80-87 % (étape 5).
La concentration peut être réalisée dans des évaporateurs sous vide chauffés à la vapeur. On peut également utiliser la chaleur des fours de calcination au dioxyde de titane. Le refroidissement de l’acide après ce processus de concentration produit une suspension de sulfate métallique dans l’acide sulfurique. Cet acide peut être directement utilisé pour la digestion des matières premières.
Les sulfates métalliques récupérés et séparés de l’acide sulfurique à l’étape 3 (généralement par filtration, appelés « sel de filtration ») contiennent environ 15 à 30 % d’acide sulfurique à une concentration de 60 à 70 %. Ils peuvent être transformés en un matériau jetable par réaction avec des composés calciques.
La décomposition thermique des sulfates métalliques en oxydes métalliques, dioxyde de soufre, eau et oxygène est énergivore. Cependant, elle est écologiquement avantageuse. Le besoin énergétique est d’environ 4 × 109 J par tonne de résidu de filtration. La décomposition thermique se produit à 850–1 100 °C dans un four à lit fluidisé (étape 6).
L’énergie est fournie par le charbon, les pyrites ou le soufre. Le dioxyde de soufre formé lors de la décomposition thermique est purifié par des méthodes standard, séché et transformé en acide sulfurique ou oléum. Cet acide pur, ou oléum, est mélangé à l’acide sulfurique récupéré et utilisé dans le processus de digestion.
Les oxydes métalliques produits par décomposition thermique contiennent tous les éléments initialement présents dans la matière première, à l’exception du titane transformé en pigment. Ce mélange d’oxydes métalliques, principalement de l’oxyde de fer, peut être utilisé comme additif dans les matériaux de construction ou l’industrie du ciment.
La demande croissante de procédés industriels respectueux de l’environnement a favorisé le développement de techniques permettant de recycler les 5 à 30 % de sulfate restant dans les eaux de lavage acides. Les procédés modernes permettent de récupérer et de réutiliser jusqu’à 99 % de l’acide sulfurique en production.
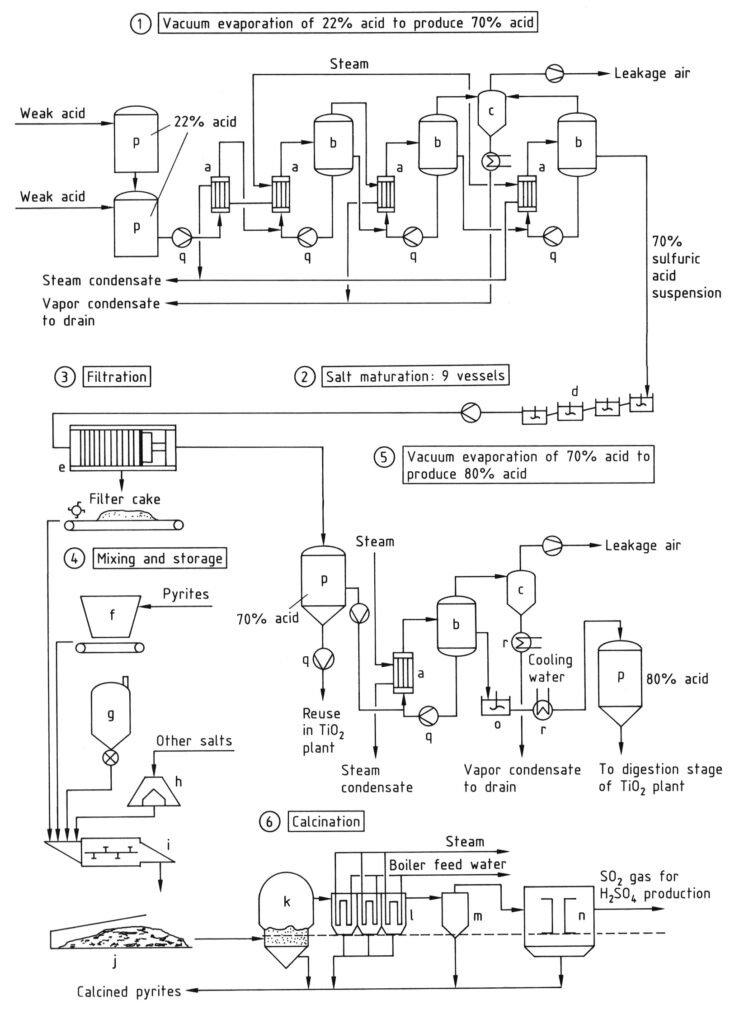
a) Échangeur de chaleur ; b) Évaporateur ; c) Condenseur à injection ; d) Cuves de maturation de sel agitées ; e) Filtre-presse ; f) Bunker pour pyrites ; g) Silo à charbon ; h) Bunker ; i) Unité de mélange à vis ; j) Stockage couvert pour résidu de filtration mixte ; k) Four de calcination ; l) Chaudière de récupération de chaleur ; m) Cyclone ; n) Précipitateur électrostatique ; o) Cuve agitée ; p) Cuve de stockage ; q) Pompe ; r) Refroidisseur
4.2. Déchets solides
Les résidus solides issus de la réaction de digestion sont souvent éliminés après neutralisation. Dans les années 1990, ces résidus ont commencé à être utilisés comme source de titane dans les hauts fourneaux pour stabiliser le revêtement intérieur et prolonger leur durée de vie. D’autres utilisations potentielles incluent le remplissage d’asphalte (en remplacement du calcaire), le revêtement de décharges ou les matériaux de construction. Des applications comme abrasif ont également été suggérées.
Le sulfate de fer heptahydraté (FeSO4·7 H2O, copperas), obtenu par cristallisation et séparation de liqueur noire ou d’acide faible, est principalement utilisé pour la purification de l’eau, le traitement des eaux usées et comme matière première pour les pigments d’oxyde de fer.
Depuis 1980, en Scandinavie, le FeSO4·7 H2O est utilisé comme agent réducteur de chromate dans le ciment. Le FeSO4·H2O monohydraté (issu du séchage thermique de l’heptahydrate) n’a pas trouvé d’utilisation majeure en raison de ses performances et de son coût défavorables.
Les sulfates métalliques (sels de filtration) récupérés par filtration d’acides faibles après concentration (principal constituant : sulfate de fer(II) sous forme monohydratée pure) ont été utilisés pendant de nombreuses années dans la fabrication d’engrais, le craquage thermique pour la production d’acide sulfurique, ou ont été mis en décharge.
Le sel de filtration a été proposé pour la première fois comme agent réducteur de chromate en 2003. Par la suite, les principaux fabricants européens de dioxyde de titane ont étudié et déposé de nombreux brevets sur divers aspects de l’utilisation de dérivés de sels de filtration comme agents réducteurs de chromate.
Le sel de filtration a montré des propriétés supérieures, notamment en termes de rhéologie, de résistance à la chaleur et de stabilité à long terme, et peut être directement appliqué dans les broyeurs à ciment. Par conséquent, des quantités croissantes de sels de filtration traités (par exemple, neutralisés au calcaire) sont utilisées dans l’industrie du ciment comme agent réducteur de Cr6+.
Ces développements, conjugués à la demande croissante d’agents réducteurs de chromate pour le ciment suite aux modifications de la législation européenne de 2005, ont transformé les déchets de sulfate de fer, autrefois considérés comme indésirables, en un produit commercial.
Le procédé au chlorure peut engendrer des problèmes d’eaux usées, notamment si la matière première contient moins de 90 % de dioxyde de titane. Les sous-produits de chlorure métallique sont parfois éliminés en solution par injection en puits profond.
Les solutions de chlorure métallique sont pompées par des forages profonds dans des couches géologiques poreuses. Des formations géologiques spécifiques sont nécessaires pour prévenir la contamination des eaux souterraines par des impuretés.
Le procédé au chlorure est également soumis à des restrictions croissantes. Des efforts ont été déployés pour utiliser les sous-produits de chlorure de fer, par exemple, dans le traitement des eaux et comme agent de floculation. Un procédé a été proposé, dans lequel les chlorures métalliques sont traités avec du ciment et des composés alcalins pour produire des granulats rocheux destinés à la construction routière.
Une autre méthode consiste à convertir le chlorure de fer en oxyde de fer par le procédé Ruthner, avec récupération d’acide chlorhydrique. Jusqu’à récemment, de nombreuses installations de traitement des chlorures devaient neutraliser leurs chlorures métalliques résiduaires, puis éliminer l’hydroxyde de fer obtenu.
4.3. Gaz résiduaires
Les gaz issus du four de calcination sont refroidis dans un échangeur de chaleur. Le pigment de dioxyde de titane entraîné est extrait, lavé et recyclé dans le procédé. Le SO2 et le SO3 formés lors de la calcination peuvent ensuite être éliminés des gaz pour former de l’acide sulfurique dilué, qui est ensuite recyclé.
Références
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Production of titanium dioxide. – https://ena-norm.eu/wp-content/uploads/2024/04/V.pl_.3.pdf
- A new method for production of titanium dioxide pigment. – https://www.sciencedirect.com/science/article/abs/pii/S0304386X12002423
- A Review of the Production Cycle of Titanium Dioxide Pigment. – https://www.scirp.org/journal/paperinformation?paperid=46456
- Titanium Dioxide. – https://www.ncbi.nlm.nih.gov/books/NBK524874/
- Process for manufacturing titanium dioxide pigments using ultrasonication. – https://patents.google.com/patent/US9353266B2/en
- Process for manufacturing titanium dioxide. – https://patents.google.com/patent/US4288418A/en
- An updated review of industrially relevant titanium dioxide and its environmental health effects. – https://www.sciencedirect.com/science/article/pii/S2666911023000114
