Nitrobenzène : production, réaction et utilisations
Le nitrobenzène est un composé chimique organique de formule moléculaire C6H5NO2. C’est un liquide jaune pâle avec une odeur caractéristique semblable à celle des amandes amères.
Table des matières
1. Propriétés physiques du nitrobenzène
Le nitrobenzène est connu sous le nom d’huile de mirbane. il a la formule chimique C6H5NO2 et une masse molaire de 123,1 g/mol. Ce liquide jaune pâle dégage un arôme rappelant les amandes amères et présente une grande solubilité dans divers solvants organiques.
Il présente une miscibilité complète avec le benzène en toutes proportions. Notamment, le nitrobenzène sert de solvant efficace pour le chlorure d’aluminium, ce qui en fait un composant précieux dans l’acylation et l’alkylation de Friedel-Crafts.
Le composé affiche une légère solubilité dans l’eau, soit environ 0,19 % à 20 °C et 0,8 % à 80 °C. De plus, il est facilement volatil avec la vapeur.
Diverses autres propriétés physiques du nitrobenzène sont les suivantes :
| Propriété | Valeur |
|---|---|
| mp | 5,85 °C |
| pb à 101 kPa | 210,9 °C |
| pb à 13 kPa | 139,9 °C |
| pb à 4 kPa | 108,2 °C |
| pb à 0,13 kPa | 53,1 °C |
| densité (solide) | 1.344 |
| densité (liquide) 25°C | 1.199 |
| Viscosité (15 °C) | 2,17 × 102 mPa · s |
| Tension superficielle (20 °C) | 43,35 mN/m |
| Constante diélectrique à 20 °C | 35,97 |
| Constante diélectrique à 170 °C | 18h15 |
| Chaleur spécifique (30 °C) | 1,418 J/g |
| Chaleur latente de fusion | 94,1 J/g |
| Chaleur latente de vaporisation | 331 J/g |
| Point d'éclair (coupe fermée) | 88 °C |
| Température d'auto-inflammation | 482 °C |
| Limite d'explosivité dans l'air (93 °C) | 1,8 vol% |
| Densité de vapeur | 4.1 |
| Indice de réfraction (15 °C) | 1.55457 |
2. Réactions chimiques du nitrobenzène
Le nitrobenzène subit diverses réactions chimiques dues à la présence du groupe nitro (-NO2) attaché au noyau benzénique. Le groupe nitro est un groupe attracteur d’électrons, qui affecte la réactivité du cycle benzénique.
Il retire la densité électronique du cycle, le désactivant vers des réactions de substitution aromatique électrophile (EAS). Cela signifie que l’anneau est moins réactif vis-à-vis de la substitution d’un électrophile à la place d’un autre électrophile, tel que l’hydrogène.
Les réactions chimiques impliquant le nitrobenzène englobent la méta-substitution électrophile du cycle aromatique par des processus tels que la nitration, la sulfonation ou l’halogénation.
Le nitrobenzène peut agir comme agent oxydant doux dans la synthèse de composés comme la quinoléine et la fuchsine.
À l’inverse, la réduction du groupe nitro conduit à une gamme diversifiée de produits, comme présenté dans le tableau suivant :
| Agent réducteur | Produit |
|---|---|
| Fe, Zn ou Sn/HCl, H2–catalyseur | aniline |
| Zn – H2O | N-phénylhydroxylamine (se réarrange avec l'acide en 4-aminophénol) |
| Na3AsO3 | azoxybenzène |
| Zn – NaOH | azobenzène, hydrazobenzène (se réarrange avec l'acide en benzidine) |
| LiAlH4 | azobenzène |
| Na2S2O3– Na3PO4< /td> | phénylsulfamate de sodium (C6H5NHSO3Na) |
| Réduction électrolytique | 4-aminophénol |
Les principaux produits de réduction sont le nitrosobenzène, la N-phénylhydroxylamine et l’aniline, tandis que d’autres produits résultent d’interactions et de réarrangements ultérieurs.
Il est essentiel d’employer des conditions de réduction hautement spécifiques pour obtenir des produits purs, et les étapes intermédiaires, telles que le nitrosobenzène, sont généralement difficiles à isoler.
3. Production de nitrobenzène
La procédure traditionnelle de nitration discontinue consiste à ajouter un mélange d’acide (acide nitrique/acide sulfurique/eau) (constitué de 27 – 32/56 – 60/8 – 17 % en poids) à un léger excès de benzène (pour éviter la présence d’acide nitrique dans l’eau usée). acide). La réaction est contrôlée à une température de 50 à 55 °C puis complétée par un chauffage à 80 à 90 °C.
Cependant, les procédés continus ont remplacé cette approche, fonctionnant dans des conditions similaires. Ces procédés continus offrent une économie et une sécurité accrues grâce à un mélange amélioré et à des vitesses de réaction plus élevées réalisables dans des réacteurs plus petits.
Remarquablement, un réacteur continu de 120 L peut produire la même quantité de nitrobenzène qu’un réacteur discontinu de 6000 L. Les configurations de réacteur varient, mais un exemple typique est un réacteur cylindrique agité fonctionnant à 50 – 100 °C.
La réutilisation de l’acide usé est importante, obtenue grâce à une concentration continue et à l’ajout d’acide frais. Cela contraste avec le concept de réutilisation par lots, mais les deux approches entraînent le même inconvénient de générer une quantité équivalente d’acide usé à éliminer.
De nombreuses installations de production d’aujourd’hui sont des unités d’assemblage basées sur des années d’expérience en conception. Par exemple, les unités Meissner, avec des capacités allant jusqu’à 12 t de nitroaromatiques par heure, sont équipées d’une couverture d’azote pour plus de sécurité.
Des étapes de purge sont appliquées à chaque flux de sortie ; ainsi, l’acide usé est extrait avec le benzène entrant pour éliminer le nitrobenzène et l’acide nitrique résiduels. De plus, les gaz résiduaires résiduels sont lavés par une boucle d’acide mixte pour répondre aux réglementations environnementales.
Un autre développement innovant est le circuit de nitration par pompe introduit par Nobel Chematur. Ce processus permet à la nitration d’avoir lieu dans la pompe elle-même, conduisant à des temps de réaction inférieurs à une seconde en raison d’un mélange intense et de nombreux avantages associés.
Le concept d’un procédé adiabatique qui utilise la chaleur de réaction pour la concentration d’acide usé existe depuis 1941. Le procédé adiabatique American Cyanamid, développé conjointement avec CLR, constitue la base de l’une des plus grandes usines de nitrobenzène au monde, évaluée à 159 000 t /un.
Ce procédé implique des courants co-courants de benzène (1,1 mol par mole de HNO3) et d’acide mixte (6 – 8/62 – 68/24 – 32 % en poids) traversant un réacteur tubulaire vigoureusement agité, avec une entrée à 60 – 80° C (en dessous du point d’ébullition du benzène) et sortir à environ 120 °C, en assurant un temps de séjour d’environ 4 minutes.
L’exigence d’acide sulfurique beaucoup plus faible rend le recyclage de l’acide beaucoup plus rentable, en particulier parce que la chaleur du procédé est presque suffisante pour l’évaporation, en particulier sous vide.
Une autre option pour éviter la nécessité d’une reconcentration séparée de l’acide sulfurique consiste à effectuer la nitration à des températures plus élevées (120 à 160 ° C) avec un excès d’eau distillée du nitrateur sous forme d’ azéotrope avec du benzène.
Dans un procédé duplex, l’azéotrope de benzène résultant de la réaction partielle de la première étape à haute température est utilisé dans une seconde étape à plus basse température pour achever la réaction. Bien que la nitration azéotropique offre des économies d’énergie importantes, elle n’est pas considérée comme aussi compétitive que la nitration adiabatique.
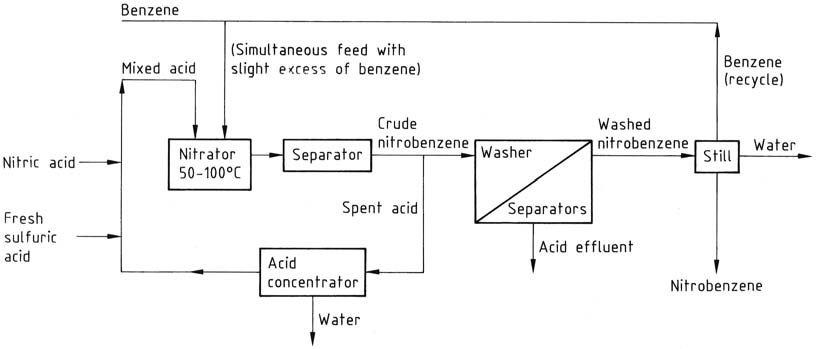
Tous ces processus partagent des flux de travail similaires. Le mélange réactionnel passe du nitrateur à un séparateur ou à une centrifugeuse, et l’acide usé aqueux est réinjecté dans la boucle de recyclage via un concentrateur ou une étape d’ajustement de la force, selon le cas.
Le nitrobenzène brut, en tant que couche supérieure, passe à travers une série de laveurs-séparateurs où l’acide résiduel est d’abord lavé avec un alcali dilué, puis avec de l’eau. Le produit lavé est soumis à un alambic pour éliminer l’eau et le benzène (recyclé).
Si nécessaire, le produit est finalement distillé sous vide pour obtenir un produit pur avec un rendement global d’environ 96 %. Les étapes de lavage créent un problème d’effluent, nécessitant un traitement des eaux usées, principalement pour éliminer le nitrobenzène.
En 1985, la capacité mondiale de production de nitrobenzène était d’environ 1,7 million de t/a, dont environ un tiers se situait en Europe occidentale et un autre tiers aux États-Unis.
4. Utilisations du nitrobenzène
L’utilisation du nitrobenzène comme solvant dans des réactions chimiques spécifiques joue un rôle mineur, mais significatif. La majorité (environ 95 % ou plus) du nitrobenzène produit est convertie en aniline, qui sert de précurseur à de nombreux produits en aval.
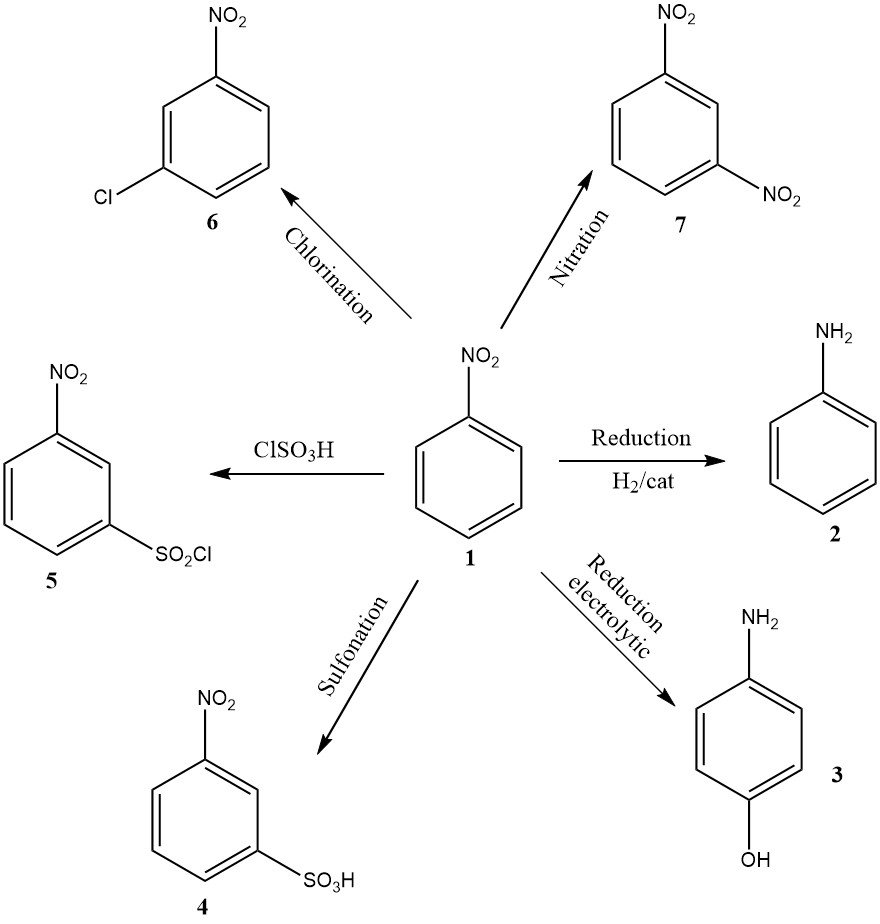
Bien qu’en volume inférieur, d’autres applications pertinentes sur le plan industriel comprennent la réduction électrolytique pour produire du 4-aminophénol, la nitration donnant du 1,3-dinitrobenzène (7), la chloration donnant du 3-chloronitrobenzène (6), la sulfonation donnant de l’acide 3-nitrobenzènesulfonique (4), et chlorosulfonation donnant le chlorure de 3-nitrobenzènesulfonyle (5).
Ces trois derniers produits sont principalement utilisés comme précurseurs de leurs produits de réduction : 3-chloroaniline, acide métanilique et 3-aminobenzènesulfonamide, respectivement.
L’aniline trouve des applications dans la fabrication de polymères d’uréthane, de produits chimiques pour le caoutchouc, de pesticides, de colorants (en particulier de colorants azoïques), d’explosifs et de produits pharmaceutiques. C’est un composé polyvalent avec un large éventail d’utilisations dans différentes industries.
En plus de son rôle de précurseur de l’aniline, le nitrobenzène est également utilisé comme solvant dans certains procédés de laboratoire et industriels. Il peut être utilisé pour dissoudre diverses substances, en particulier celles qui ne sont pas solubles dans l’eau.
La solubilité du nitrobenzène dans les solvants organiques en fait un outil utile dans certaines procédures expérimentales.
De plus, la nigrosine (C.I. Solvent Black 5) est obtenue sous la forme d’un mélange brut résultant de la réaction du nitrobenzène avec l’aniline et le chlorhydrate d’aniline à une température de 200 °C en présence de fer ou de cuivre.
5. Toxicité du nitrobenzène
Le nitrobenzène, avec une valeur limite d’exposition (VLE) de 5 mg/m³, est hautement toxique et peut entraîner une intoxication aiguë en raison de sa facilité d’absorption par la peau ou les voies respiratoires.
Les principaux effets de l’exposition comprennent une réduction des taux d’hémoglobine, la méthémoglobinémie, la cyanose et l’essoufflement. Une exposition prolongée peut entraîner des dommages à la rate et au foie, la jaunisse et l’anémie.
Il est important de noter que la consommation d’alcool peut accélérer et intensifier ces effets. Par conséquent, des conditions de travail strictes et bien définies doivent être établies et maintenues pour assurer un contrôle et une sécurité appropriés.
Référence
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
FAQ
Le nitrobenzène est un composé chimique organique de formule moléculaire C6H5NO2. C’est un liquide jaune pâle avec une odeur caractéristique semblable à celle des amandes amères.
La formule chimique du nitrobenzène est C6H5NO2.
Le nitrobenzène est généralement synthétisé par un processus appelé nitration. Dans ce procédé, le benzène est mis à réagir avec de l’acide nitrique ou un mélange d’acide nitrique et d’acide sulfurique pour introduire un groupe nitro (-NO2) sur le cycle benzénique.
Le nitrobenzène trouve diverses applications industrielles, telles que son utilisation comme précurseur dans la production d’aniline, qui est ensuite utilisée pour produire une large gamme de produits, notamment des colorants, des produits pharmaceutiques et des produits chimiques pour le caoutchouc. De plus, il sert de solvant dans certaines réactions chimiques.
Le nitrobenzène est réduit en aniline à l’aide d’agents réducteurs tels que le fer, le zinc ou l’étain en présence d’acide chlorhydrique (HCl) ou à l’aide d’autres catalyseurs comme l’hydrogène gazeux (H2).
Oui, le nitrobenzène est considéré comme hautement toxique et peut poser de graves risques pour la santé humaine. L’exposition au nitrobenzène peut entraîner une intoxication aiguë, entraînant des effets tels que la méthémoglobinémie, la cyanose, l’essoufflement et des lésions aux organes tels que le foie et la rate.
Non, le nitrobenzène n’est pas couramment utilisé comme explosif. Cependant, c’est un précurseur dans la synthèse d’autres composés qui peuvent être utilisés dans la production d’explosifs.
Le nitrobenzène est également connu sous son nom commun « Huile de Mirbane » en raison de son utilisation comme huile aromatique dans le passé.
