Indole : propriétés, réactions, production et utilisations

Qu’est-ce que l’indole ?
L’indole, également connu sous le nom de 1-benzo[b]pyrrole, est un composé organique hétérocyclique aromatique qui possède une structure bicyclique (un benzène fusionné à un pyrrole) et dont la formule chimique est C8H7N. Il s’agit d’un solide incolore avec une odeur de moisi très persistante.
L’indole a été découvert pour la première fois par A. V. Baeyer et C. A. Knop en 1866 à la suite de recherches sur la réduction de l’isatine, qui est dérivée du colorant naturel indigo. L’indole a été synthétisé en chauffant l’oxindole avec de la poussière de zinc. En 1910, R. Weissgerber a isolé l’indole du goudron de houille.
L’indole a été trouvé dans le Robinia pseudacacia, les jasmins et certains agrumes ; dans le parfum d’Hevea bruziLiensis, dans les fleurs d’oranger et dans le bois de Celtis reticulosa. Il constitue 2,5 % de l’huile de jasmin et 0,1 % de l’huile de fleur d’oranger. Lorsqu’il est utilisé dans les parfums à des concentrations plus élevées, il dégage une odeur fécale intense.
L’indole est planaire avec 10 électrons π dans un système complètement conjugué. Le cycle est classé comme un composé hétéroaromatique π-excessif en raison du caractère donneur d’électrons de l’atome d’azote de type pyrrole. Le système π est relativement riche en électrons, en particulier au niveau du carbone C-3.
Table des matières
1. Propriétés physiques de l’indole
L’indole est un solide cristallin incolore qui est facilement soluble dans l’alcool, le benzène, l’éther et la plupart des solvants organiques, mais peu soluble dans l’eau. Il est volatil avec la vapeur.
L’indole est un composé neutre (composé azoté non basique) mais peut être protoné ou déprotoné par un acide ou une base très forte, respectivement. Le pKa de l’acide conjugué est d’environ −2,4 ; celui du composé neutre est d’environ 16,7.
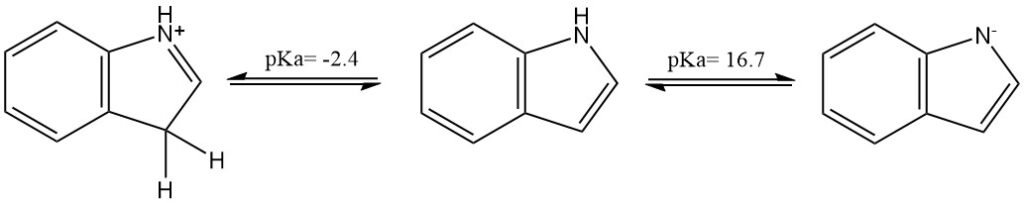
Les propriétés physiques de l’indole sont résumées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [120-72-9] |
| Formule chimique | C8H7N |
| Poids moléculaire | 117,15 g/mol |
| Point de fusion | 52–54◦C |
| Ébullition point | 254 °C |
| Densité | 1,22 g/cm3 |
| pKa | 16,7 |
| Chaleur de combustion | 3,650 kJ/kg (à 25 °C) |
| Enthalpie de vaporisation (10,3–27,4 °C) | 597,5 kJ/kg |
| Moment dipolaire | 2,11 D (benzène) |
2. Réactions chimiques de l’indole
L’indole en tant que composé hétérocyclique présente une réactivité caractéristique du pyrrole et du benzène. L’atome d’hydrogène attaché à l’azote peut être remplacé par des métaux alcalins. L’oxydation de l’indole donne de l’indigo, tandis qu’une hydrogénation douce produit du 2,3-dihydroindole (indoline). Les réactions avec les acides entraînent la formation de diindole, de triindole et de produits polymères.
2.1. Substitution aromatique électrophile de l’indole
L’indole peut subir une substitution aromatique électrophile en raison de la nature riche en électrons de la fraction pyrrole. Le carbone en position 3 est le plus réactif en raison de la distribution de densité électronique et de la stabilité des structures intermédiaires.
Des études informatiques utilisant des méthodes d’orbitales moléculaires ont révélé que la densité électronique en position 3 est plus élevée qu’en position 2. De plus, les énergies relatives des structures intermédiaires formées lors de la substitution électrophile suggèrent que la position 3 est plus favorable à l’attaque.
Cette préférence est probablement due à la conservation du caractère benzénoïde du cycle carbocyclique dans l’intermédiaire formé en position 3.
Dans le cas des indoles substitués en position 3, une attaque électrophile peut toujours se produire en position 3, même s’il est déjà substitué. Cela peut conduire à un schéma de substitution complexe, car le nouveau substituant ou le substituant d’origine peut migrer vers la position 2.
De nombreuses réactions de substitution aromatique électrophile courantes peuvent être réalisées sur l’indole. Cependant, des complications surviennent souvent en raison de la réactivité excessive de l’indole ou de l’instabilité relative des produits de substitution. L’halogénation en est un exemple.
2.1.1. Halogénation
L’halogénation de l’indole peut être réalisée à l’aide de divers réactifs, tels que l’ion hypochlorite, le chlorure de sulfuryle, le tribromure de pyridinium et l’iode. Le produit principal de l’halogénation est généralement le dérivé 3-haloindole.
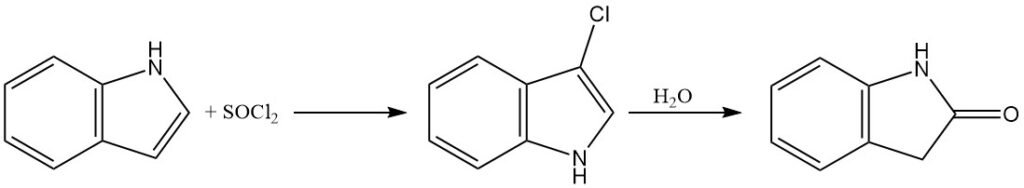
L’indole peut être chloré à l’aide d’ions hypochlorite ou de chlorure de sulfuryle pour produire du 3-chloroindole. Cependant, le 3-chloroindole est relativement instable dans les solutions aqueuses acides et peut subir une hydrolyse en oxindole.
Le 3-bromoindole peut être préparé en utilisant le tribromure de pyridinium comme source de brome électrophile. L’indole réagit avec l’iode pour donner le 3-iodoindole.
Le 3-bromoindole et le 3-iodoindole sont tous deux susceptibles d’être hydrolysés dans des conditions acides, mais sont relativement stables dans des environnements basiques.
2.1.2. Nitration
La nitration de l’indole peut être une réaction complexe en raison de la formation d’oxydes d’azote, qui peuvent participer aux transformations oxydatives. Dans les milieux fortement acides, la nitration des indoles substitués en position 2 se produit principalement en position 5.
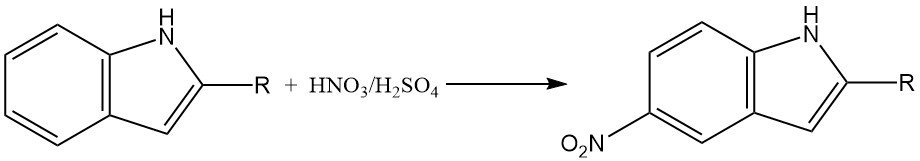
Cela est probablement dû à la formation d’un intermédiaire acide conjugué, qui a un caractère aromatique réduit et est plus sensible à la nitration en position 5.
2.1.3. C-alkylation
La C-alkylation de l’indole peut être obtenue en faisant réagir l’indole avec des agents alkylants dans des conditions appropriées. La régiosélectivité de la C-alkylation peut être influencée par les conditions de réaction et la nature de l’agent alkylant.
Les conditions qui favorisent la formation de l’intermédiaire de substitution aromatique électrophile, telles que l’utilisation de bases fortes ou d’une coordination métallique étroite au niveau de l’azote ou d’agents alkylants hautement réactifs comme les composés allyliques et benzyliques, favorisent l’alkylation C-3.
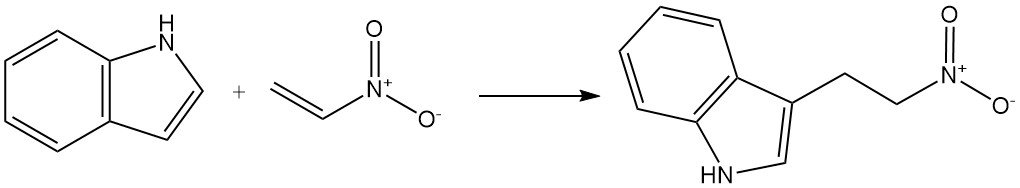
Les réactifs insaturés activés par des groupes attracteurs d’électrons peuvent également réagir avec l’indole pour subir une alkylation C-3. Un exemple est la réaction de l’indole avec le nitroéthylène pour former le 3-(2-nitroéthyl)indole.
La gramine, un intermédiaire formé par la réaction de l’indole avec l’ion N,N-diméthylformaldiminium, peut être utilisée pour introduire une variété de substituants en position 3. Le groupe diméthylamino de la gramine peut être déplacé par des nucléophiles, ou la gramine peut être convertie en son sel quaternaire avant la substitution.
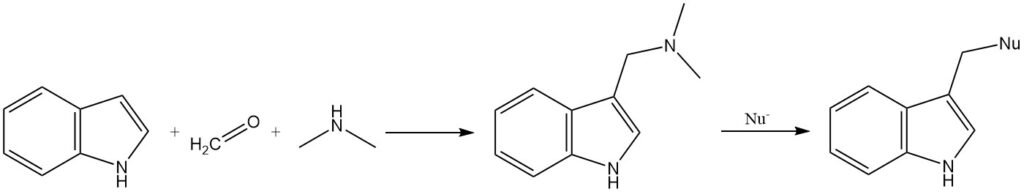
2.1.4. Acylation
L’acylation est une autre méthode importante pour introduire des substituants sur le cycle indole, en particulier en position 3. L’acylation peut être réalisée à l’aide de divers réactifs, tels que les halogénures d’acyle et les réactifs de Vilsmeier-Haack.
Les halogénures d’acyle hautement réactifs, tels que le chlorure d’oxalyle, peuvent directement acyler l’indole sans avoir besoin d’un catalyseur. Les chlorures d’acides normaux peuvent être mis à réagir avec les sels de magnésium ou de zinc de l’indole pour produire des produits d’acylation.
La réaction de Vilsmeier-Haack, impliquant un amide et un oxychlorure de phosphore, est une méthode courante pour l’acylation de l’indole.
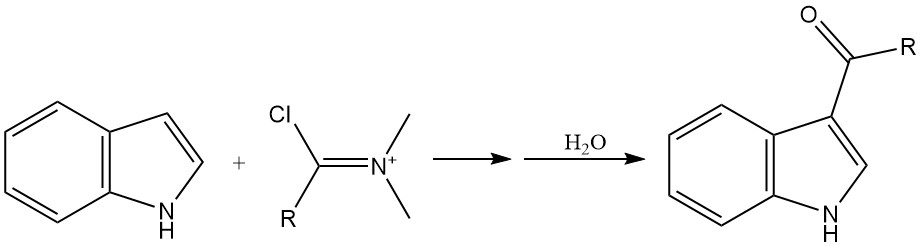
2.2. N-alkylation de l’indole
Pour faciliter la N-alkylation, le cycle indole doit être déprotoné pour générer l’anion indole, qui est un nucléophile plus fort que la molécule indole neutre.
Cette déprotonation peut être réalisée en utilisant diverses bases fortes, telles que l’amide de sodium dans l’ammoniac liquide, l’hydrure de sodium ou l’hydrure de potassium dans des solvants aprotiques (N,N-diméthylformamide et diméthylsulfoxyde), ou la catalyse par transfert de phase.
L’anion indole généré est alkylé par réaction avec un halogénure d’alkyle ou un autre agent alkylant. Le choix de l’agent alkylant et des conditions de réaction peut influencer la régiosélectivité de la N-alkylation.
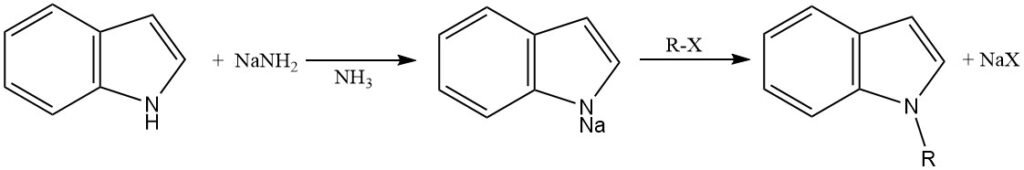
Les halogénures d’alkyle primaires, secondaires et tertiaires peuvent être utilisés pour la N-alkylation de l’indole. Cependant, les halogénures d’alkyle primaires sont généralement plus réactifs que les halogénures d’alkyle secondaires ou tertiaires. D’autres agents d’alkylation, tels que les sulfates de dialkyle, les tosylates d’alkyle et les triflates d’alkyle, peuvent également être utilisés.
2.3. Arylation de l’indole
L’arylation de l’indole est l’introduction d’un groupe aryle sur le cycle indole. Cette réaction est généralement réalisée par l’intermédiaire d’intermédiaires substitués plutôt que directement sur l’indole. Les réactions de couplage croisé catalysées par le palladium sont devenues la méthode préférée pour l’arylation des indoles et d’autres cycles hétéroaromatiques.
Les réactions de couplage croisé catalysées par le palladium impliquent le couplage d’un halogénure d’aryle ou d’un triflate d’aryle avec l’indole en présence d’un catalyseur au palladium. Le nucléophile aryle peut être un acide indole-étain, indole-zinc ou indole-boronique.
Les réactions de couplage croisé catalysées par le palladium sont très sélectives, peuvent être utilisées pour introduire une variété de groupes aryles sur le cycle indole et sont réalisées dans des conditions douces.
2.4. Lithiation et transformations ultérieures
La lithiation de l’indole est l’introduction d’un atome de lithium sur le cycle indole en position 2. Trois intermédiaires ont été fréquemment utilisés, tels que le 1-phénylsulfonylindole (1), le 1-t-butoxycarbonylindole (2) ou le lithium indole-1-carboxylate (3), et ont permis d’obtenir un bon rendement.
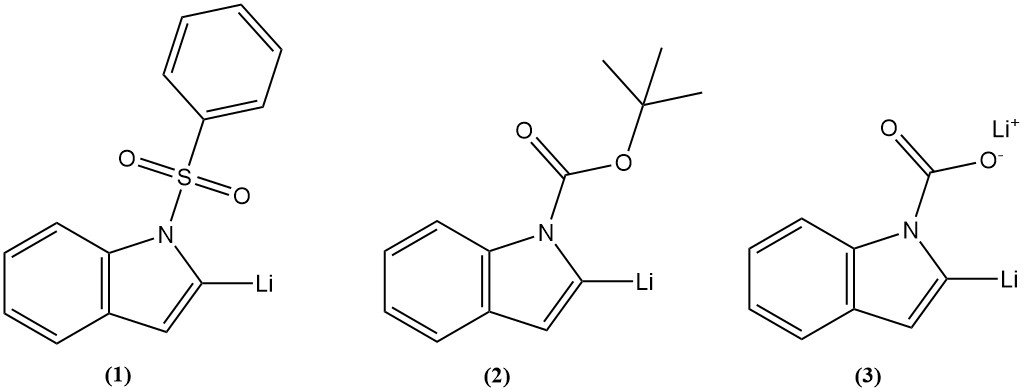
La lithiation de l’indole en position 2 peut être suivie d’une réaction avec divers électrophiles pour introduire une grande variété de substituants. La lithiation à d’autres positions sur le cycle indole peut être obtenue par échange halogène-métal.
2.5. Oxydation de l’indole
L’indole est susceptible d’être oxydé en raison de sa nature riche en électrons. L’oxydation de l’indole peut conduire à la formation de divers intermédiaires et produits, selon l’oxydant utilisé.
L’oxydation de l’indole avec de l’oxygène conduit souvent à la formation d’intermédiaires 3-hydroperoxy-3H-indole. Ces intermédiaires peuvent subir d’autres transformations, telles que la décomposition ou le réarrangement, pour former divers produits d’oxydation.
Les acides peroxycarboxyliques peuvent également oxyder l’indole pour produire des produits similaires à ceux obtenus avec de l’oxygène. D’autres oxydants chimiques, tels que le diméthylsulfoxyde dans un acide aqueux ou le MoO5·HMPA, produisent respectivement des oxindoles et des 3-hydroxy-2-méthoxyindolines.
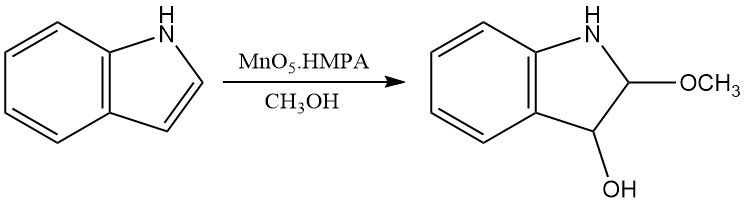
3. Production d’indole
L’indole est principalement obtenu à partir de deux sources : le goudron de houille et la synthèse chimique. Bien que des méthodes de synthèse aient été décrites pour la production d’indole, l’extraction à partir de la fraction distillée du goudron de houille est la seule source commerciale.
Le goudron de houille à haute température contient environ 0,2 % d’indole. Lors de la distillation du goudron de houille, l’indole est concentré dans une fraction de biphényl-indole qui bout dans une plage de température étroite de 245 à 255 °C.
Après avoir éliminé les phénols et les bases, l’indole est séparé du biphényle par :
- Réaction avec l’hydroxyde de potassium pour former son sel de potassium, qui peut être séparé du biphényle.
- Distillation azéotropique avec du diéthylène glycol.
- Extraction du mélange biphényle-indole à l’aide de solvants sélectifs tels que les glycols, le diméthylsulfoxyde aqueux ou la monoéthanolamine.
L’indole brut obtenu à partir de ces procédés peut être purifié davantage par cristallisation à partir de solvants hydrocarbonés aliphatiques.
Plusieurs méthodes chimiques ont été développées pour la synthèse de l’indole à l’échelle technique, notamment :
- La synthèse de Madelung implique la formylation de l’o-toluidine à l’aide d’acide formique, suivie d’une cyclisation pour former de l’indole.
- La déshydrogénation et la cyclisation de la 2-éthylaniline pour former de l’indole.
- La cyclocondensation de l’aniline et de l’éthylène glycol en phase liquide ou gazeuse pour produire de l’indole.
- La cyclisation du 2-(2-nitrophényl)éthanol.
3.1. Production d’indole par synthèse de Madelung
La synthèse de Madelung est une méthode classique de préparation des indoles. Cette réaction est une condensation intramoléculaire d’un o-alkylanilide. L’O-toluidine réagit avec l’acide formique pour produire de la N-formyl-o-toluidine, qui est traitée avec de l’amide de sodium pour former de l’indole.
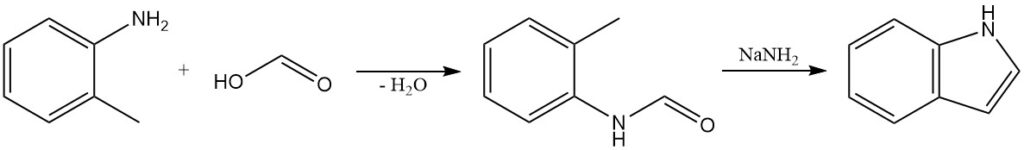
La synthèse de Madelung a été utilisée pour préparer une variété d’indoles substitués, y compris ceux avec des groupes fonctionnels tels que des halogènes, des groupes alkyles et des groupes aryles.
La synthèse originale de Madelung utilisait des températures élevées et des bases fortes comme l’amide de sodium. Par exemple, l’o-méthylacétanilide peut être converti en 2-méthylindole en le chauffant avec de l’amide de sodium à des températures élevées.
Ces dernières années, les chercheurs ont développé des conditions plus douces pour la synthèse de Madelung, ce qui peut être avantageux pour les substrats sensibles ou lorsqu’il est important d’éviter les réactions secondaires.
Une méthode consiste à utiliser des bases fortes et non nucléophiles comme le n-butyllithium ou le diisopropylamide de lithium pour former un dérivé dilithio de l’anilide, qui peut ensuite subir une cyclisation dans des conditions plus douces.
3.2. Autres méthodes de synthèse
L’indole peut être synthétisé par diverses voies, notamment la réaction de l’aniline avec du bromure d’éthylène, le chauffage de l’o-amino-ω-chlorostyrène avec de l’éthoxyde de sodium et le chauffage du dianilide de l’acide tartrique avec du chlorure de zinc.
L’acide indole-2-carboxylique, qui donne de l’indole par décaraboxylation, peut être formé en chauffant l’o-formylphénylglycine avec de l’anhydride acétique et de l’acétate de sodium.
D’autres méthodes de synthèse de l’indole comprennent la distillation de l’acide oxal-o-toluique avec de la poussière de zinc ou son sel de baryum, la pyrolyse de la N-éthylaniline, la déshydrogénation catalytique de l’o-éthylaniline et le chauffage du chlorhydrate de o,o’-diaminostilbène sous pression réduite.
L’indole peut également être obtenu par réduction de l’o-nitrophénylacétonitrile, de l’acide o-nitrocinnamique ou de l’o-nitrophénylacétaldéhyde.
Enfin, l’indole peut être préparé en traitant l’acide acétyl-o-aminocinnamique avec de l’acide chlorhydrique à haute température ou en réduisant l’o-ω-dinitrostyrène. Le chauffage de l’acide indole-2-carboxylique et de l’acide quinoléine-2,3-dicarboxylique avec du carbonate de calcium donne également de l’indole.
3.3. Synthèse de l’indole par Fischer
La réaction de Fischer s’est avérée être la plus polyvalente pour la synthèse de dérivés de l’indole, bien que la réaction ne puisse pas produire d’indole elle-même. D’un point de vue théorique, l’acétaldéhyde phénylhydrazone donnerait de l’indole par la synthèse de Fischer, mais en réalité, on n’en obtient pas.
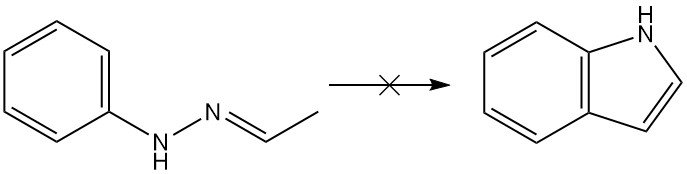
La synthèse d’indole de Fischer est une méthode classique de préparation d’indoles qui implique la cyclisation d’une N-arylhydrazone dans des conditions acides pour former un indole.
L’étape clé de la synthèse d’indole de Fischer est un réarrangement sigmatropique [3,3] du tautomère ènehydrazone de l’hydrazone. Pour que la cyclisation se produise, il doit y avoir au moins un atome d’hydrogène α sur la liaison C-N. La régiosélectivité de la réaction est influencée par les substituants sur le carbone de l’hydrazone.
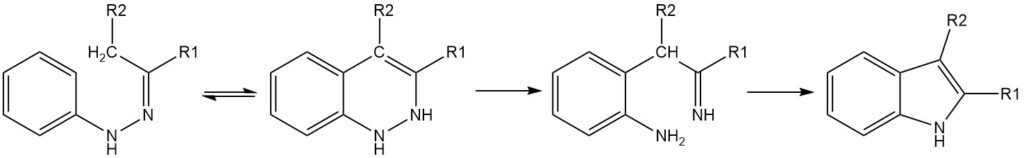
Si un seul atome d’hydrogène est en α de la liaison C-N, le produit sera un 3,3-disubstitué-3H-indole. Si les deux substituants du carbone de l’hydrazone ont un ou plusieurs hydrogènes en α, des mélanges de produits peuvent en résulter.
En général, le substituant le plus ramifié est plus susceptible de subir une cyclisation. Par exemple, les phénylhydrazones dérivées de méthylalkylcétones produisent généralement des 2-méthylindoles. Cependant, la sélectivité peut être inversée dans certaines conditions de réaction.
La présence de substituants sur le cycle phényle de l’hydrazone peut également influencer la régiosélectivité de la synthèse d’indole de Fischer. Les méta-substituants peuvent conduire à la formation d’indoles isomères, tandis que les ortho-substituants compliquent la réaction.
3.4. Biosynthèse de l’indole à partir du tryptophane
L’une des principales sources d’indole dans les systèmes biologiques est l’acide aminé tryptophane. La conversion du tryptophane en indole se produit par une série de réactions enzymatiques connues sous le nom de voie de dégradation du tryptophane. Cette voie se trouve principalement dans les bactéries et les champignons, mais elle peut également être active dans certains tissus de mammifères, tels que le foie et l’intestin.
L’étape initiale de cette voie est le clivage du tryptophane par l’enzyme tryptophanase. Cette réaction produit de l’indole, du pyruvate et de l’ammoniac.
En plus de la voie tryptophanase, le tryptophane peut également être dégradé par la voie kynurénine, qui est principalement impliquée dans la production de niacine (vitamine B3) mais produit également des dérivés de l’indole.
4. Utilisations de l’indole
L’indole est utilisé dans diverses industries, notamment dans les domaines pharmaceutique, de la parfumerie et des arômes. Il est également un composant naturel de plusieurs substances, telles que la fumée de tabac, l’huile de jasmin et l’huile de fleur d’oranger. Il s’agit d’un produit de dégradation bactérienne du tryptophane dans l’intestin.
En raison de son arôme agréable, l’indole est utilisé depuis de nombreuses années comme fixateur de parfum. Il est également utilisé comme agent aromatisant synthétique.
L’indole peut agir comme une kairomone, un produit chimique volatil libéré par les plantes pour attirer les insectes phytophages.
L’indole est un précurseur de la synthèse de l’acide aminé essentiel tryptophane. Des méthodes chimiques et biotechnologiques peuvent être utilisées pour produire du tryptophane à partir de l’indole.
L’indole est utilisé pour synthétiser des régulateurs de croissance des plantes tels que l’acide indole-3-acétique et l’acide indole-3-butanoïque. L’indoline, un dérivé de l’indole, est utilisée dans la synthèse de produits phytosanitaires fongicides et bactéricides.
Les dérivés de l’indole ont une large gamme d’applications pharmaceutiques, telles que :
- L’indométhacine et d’autres dérivés de l’indole sont utilisés comme analgésiques légers.
- L’indoline et ses dérivés sont utilisés dans la synthèse de médicaments antihypertenseurs.
- La tryptamine, un dérivé de l’indole, est utilisée dans la synthèse du vasodilatateur Vincamine.
- Les pyridylalkylindoles, dérivés de l’indole, sont utilisés comme antidépresseurs, antihistaminiques et antihypertenseurs.
- Les 3-péridinylindoles, obtenus à partir de l’indole, sont utilisés pour prévenir l’anoxie.
- Le 5-chloroindole, un dérivé de l’indole, est utilisé dans la production de tranquillisants, de médicaments hypotenseurs et d’antiémétiques, ainsi que dans le traitement de la maladie de Parkinson.
L’indole et ses dérivés sont utilisés comme intermédiaires dans la synthèse de divers colorants, notamment les colorants diazoïques cationiques, les colorants cyanine, les colorants indolylméthane et les colorants carbazole phtaléine.
5. Toxicologie de l’indole
La population générale peut être exposée à l’indole par inhalation de l’air ambiant ou de la fumée de tabac, par ingestion d’aliments contaminés et par contact cutané avec des vapeurs, des aliments, des parfums ou d’autres produits contenant de l’indole. L’exposition professionnelle peut se produire sur les lieux de travail où l’indole est produit ou utilisé.
L’indole peut être absorbé par diverses voies, notamment par inhalation, ingestion et contact cutané.
L’indole absorbé par le tractus gastro-intestinal est métabolisé dans le foie pour former de l’indoxyl, qui est ensuite conjugué avec du sulfate pour produire de l’indican. Ces métabolites sont excrétés principalement par l’urine.
L’indole est facilement absorbé par le tractus gastro-intestinal et subit un métabolisme rapide dans le foie. Les principaux métabolites de l’indole comprennent l’indican et l’oxindole, qui sont excrétés principalement dans l’urine.
La DL50 orale aiguë de l’indole chez les rats et les souris est d’environ 1 000 à 1 100 mg/kg et 500 mg/kg, respectivement. Des études d’autopsie après une exposition aiguë ont révélé des hémorragies et une hyperémie dans les organes et les tissus internes. L’indole a une odeur désagréable et peut provoquer des nausées à de faibles concentrations.
L’indole peut provoquer une légère irritation temporaire de la peau et des yeux lorsqu’il est appliqué par voie topique. Contrairement à son dérivé méthylé, le skatole, l’indole n’induit pas de lésions pulmonaires chez les bovins après une application orale répétée.
Des doses chroniques élevées d’indole (20 à 200 mg/kg/jour pendant plus de trois mois) chez la souris, le rat, le lapin et le chien ont été associées à des effets hématologiques, notamment une anémie, une leucocytose et une leucopénie. Chez les bovins, une hémolyse et une néphrose hémoglobinurique ont été observées après administration répétée de doses orales.
Bien qu’il n’existe aucune preuve expérimentale définitive de la cancérogénicité de l’indole, il peut influencer la formation de tumeurs causées par d’autres agents. Il a été démontré que des doses élevées d’indole (800 mg/kg/jour) accélèrent le développement de tumeurs cutanées et de carcinomes de la vessie dans des modèles animaux.
En ce qui concerne la génotoxicité, il a été constaté que l’indole renforce les effets mutagènes d’autres agents dans le test d’Ames. Cependant, l’indole lui-même n’était pas mutagène dans le test d’Ames ou dans un test de transformation cellulaire. Dans un test de réparation de l’ADN, l’indole a causé des dommages réparables à l’ADN chez Bacillus subtilis.
L’indole a reçu le statut GRAS (generally recognize as safe) de la Flavor and Extract Manufacturer’s Association (FEMA) et est approuvé pour une utilisation comme matière aromatisante dans les aliments. Cependant, il n’existe pas de limites d’exposition professionnelle spécifiques pour l’indole établies par les organismes de réglementation.
Références
- Indole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_167
- Indole; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0914041519211404.a01
- Indole; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543008605
- Indole; Chemistry of Heterocyclic Compounds, Volume 8. – https://onlinelibrary.wiley.com/doi/10.1002/9780470186572.ch1
- https://www.sciencedirect.com/science/article/abs/pii/S092809871630207X
- https://www.sciencedirect.com/science/article/abs/pii/S0040403921007413
