Dioxyde de titane : un aperçu complet

Qu’est-ce que le dioxyde de titane ?
Le dioxyde de titane est un composé inorganique de formule chimique TiO2. C’est un solide blanc insoluble dans l’eau. On le trouve naturellement sous forme de polymorphes de rutile, d’anatase et de brookite.
Le rutile et l’anatase sont utilisés industriellement pour produire des pigments, des catalyseurs, des céramiques et divers autres matériaux techniques.
Le dioxyde de titane est le pigment blanc le plus important en raison de ses propriétés de diffusion exceptionnelles, de sa grande stabilité chimique et de son absence de toxicité. En 2007, environ 5 millions de tonnes de pigments de dioxyde de titane ont été produites.
Le dioxyde de titane figure parmi les cinq premiers produits chimiques inorganiques en termes d’importance économique, avec des ventes annuelles mondiales dépassant les 12 milliards de dollars.
Français La production de dioxyde de titane est passée de 1,389 million de tonnes en 1965 à 3,220 millions de tonnes en 1995. Le procédé au sulfate a dominé la production au début (90,3 % en 1965) mais a diminué à 46,0 % en 1995 alors que le procédé au chlorure est passé de 9,7 % à 54,0 %. La capacité de production a atteint 5,915 millions de tonnes en 2008, le procédé au chlorure conservant une légère domination à 53,2 % contre 46,8 % pour le procédé au sulfate.
Table des matières
1. Propriétés physiques du dioxyde de titane
Le dioxyde de titane existe sous trois formes cristallines : le rutile, l’anatase et la brookite. Le rutile est la plus stable thermodynamiquement. Malgré cela, l’anatase et la brookite possèdent des énergies de réseau similaires, ce qui contribue à leur stabilité à long terme. L’anatase se transforme irréversiblement en rutile au-delà de 700 °C. Les applications industrielles de la brookite sont limitées en raison de sa difficulté de production.
Dans les trois formes de dioxyde de titane, chaque atome de titane est coordiné octaédriquement par six atomes d’oxygène, et chaque atome d’oxygène est coordiné trigonalement par trois atomes de titane. Les trois structures cristallines correspondent à différentes manières de relier les octaèdres à leurs sommets et à leurs arêtes.
Le tableau 1 présente les constantes de réseau cristallin et les densités de ces modifications de TiO2.
Le rutile et l’anatase cristallisent dans le système tétragonal, tandis que la brookite cristallise dans le système rhombique. Le dioxyde de titane fond à environ 1800 °C. Au-delà de 1000 °C, la pression partielle d’oxygène augmente en raison de la libération d’oxygène et de la formation d’oxydes de titane inférieurs. Ce processus induit des changements de couleur et altère la conductivité électrique. Une coloration jaune réversible apparaît au-dessus de 400 °C suite à la dilatation thermique du réseau.
Le rutile présente la densité et le compactage atomique les plus élevés, ce qui lui confère une dureté supérieure (Mohs 6,5–7,0) à celle de l’anatase (Mohs 5,5–6,0). Les additifs peuvent influencer significativement la dureté de ces matériaux dans les applications pratiques.
Un indice de réfraction élevé associé à une absorption minimale du spectre visible fait du dioxyde de titane un pigment blanc exceptionnel. Les indices de réfraction moyens sont de 2,55 pour l’anatase et de 2,80 pour le rutile, qui dépendent de la longueur d’onde.
Le dioxyde de titane est un semi-conducteur photosensible qui absorbe le rayonnement électromagnétique proche de l’UV. L’énergie de la bande interdite, qui représente la différence d’énergie entre les bandes de valence et de conduction, est de 3,03 eV pour le rutile et de 3,15 eV pour l’anatase, ce qui correspond aux seuils d’absorption à 415 nm et 385 nm, respectivement.
D’après le point d’inflexion de la courbe d’absorption, ces valeurs sont de 3,13 eV (397 nm) pour le rutile et de 3,29 eV (377 nm) pour l’anatase. Des traces d’impuretés, telles que des parties par million de fer, peuvent entraîner une absorption de la lumière visible et une déviation du blanc pur.
L’absorption de l’énergie lumineuse excite un électron de la bande de valence vers la bande de conduction. L’électron mobile et le trou d’électron qui en résultent peuvent migrer à la surface du solide, où ils peuvent participer à des réactions redox.
| Phase | Numéro de registre CAS | Système cristallin | Constantes de réseau, nm | Densité, g/cm3 |
|---|---|---|---|---|
| Rutile | [1317-80-2] | Tétragonal | a = 0,4594, c = 0,2958 | 4,21 |
| Anatase | [1317-70-0] | Tétragonale | a = 0,3785, c = 0,9514 | 4,06 |
| Brookite | [12188-41-9] | rhombique | a = 0,9184, b = 0,5447, c = 0,5145 | 4,13 |
2. Propriétés chimiques du dioxyde de titane
Le dioxyde de titane présente des propriétés amphotères avec des caractéristiques acides et basiques faibles. Par conséquent, les titanates de métaux alcalins et les acides titaniques libres sont instables en milieu aqueux et subissent une hydrolyse pour former des hydroxydes d’oxyde de titane amorphes.
Le dioxyde de titane est chimiquement très stable et ne réagit pas avec la plupart des réactifs organiques et inorganiques. Il se dissout dans l’acide sulfurique concentré après un chauffage prolongé et dans l’acide fluorhydrique. Les substances alcalines et acides fondues l’attaquent et le dissolvent également.
À des températures élevées, le TiO2 réagit avec des agents réducteurs tels que le monoxyde de carbone, l’hydrogène et l’ammoniac pour produire des oxydes de titane de plus faible valence sans formation de titane métallique. Au-dessus de 500 °C, le dioxyde de titane réagit avec le chlore en présence de carbone pour former du tétrachlorure de titane.
3. Propriétés de surface des pigments de dioxyde de titane
Les surfaces spécifiques du dioxyde de titane commercial varient de 0,5 à >300 m²/g selon les applications. Les pigments standards présentent des surfaces spécifiques de 5 à 30 m²/g.
La surface du dioxyde de titane est naturellement recouverte d’eau liée de manière coordonnée pour former des groupes hydroxyles, ce qui rend la surface du dioxyde de titane non enrobé polaire. La couverture de surface par des groupes hydroxyles influence les caractéristiques du pigment, telles que sa dispersibilité et sa résistance aux intempéries.
La présence de ces groupes hydroxyles de surface permet diverses réactions photochimiques, telles que la décomposition photocatalytique de l’eau en hydrogène et en oxygène, et la réduction de l’azote en ammoniac et en hydrazine.
4. Production industrielle de dioxyde de titane
Le dioxyde de titane commercial est principalement produit selon deux méthodes industrielles distinctes : le procédé au sulfate et le procédé au chlorure. Ces deux méthodes permettent de former des pigments de dioxyde de titane.
Le procédé au sulfate est une technique plus ancienne qui consiste à faire réagir des matières premières riches en titane, comme l’ilménite, avec de l’acide sulfurique concentré à haute température (150-220 °C). Cette réaction crée une solution contenant du titane, du fer et d’autres impuretés. Les étapes suivantes, comprenant l’hydrolyse et la purification, précipitent un hydrate d’oxyde de titane. Cet hydrate est ensuite calciné (chauffé à haute température), broyé et souvent enrobé pour obtenir le pigment final.
Le procédé au chlorure consiste à chlorer des matières premières contenant du titane, comme l’ilménite ou le rutile, à des températures encore plus élevées (700-1 200 °C). Cela produit du tétrachlorure de titane (TiCl4), qui est ensuite oxydé à 900–1400 °C pour former du dioxyde de titane. Comme pour le procédé au sulfate, le TiO2 obtenu est ensuite broyé et enrobé.
Il est important de noter que si ces deux procédés dominent la production de pigments, d’autres méthodes spécialisées existent pour produire du dioxyde de titane sans propriétés pigmentaires, notamment pour la synthèse de nanoparticules. Ces méthodes alternatives incluent des techniques comme l’hydrolyse des alcoolates de titane ou la réaction pyrolytique du tétrachlorure de titane avec l’eau.
Pour un article détaillé sur les processus de production du dioxyde de titane, visitez le lien suivant.
4.1. Production de dioxyde de titane par le procédé au sulfate
Le procédé au sulfate pour la production de dioxyde de titane comprend une série d’étapes commençant par le broyage des matières premières contenant du titane en une poudre fine (moins de 40 μm) après séchage. Cette étape est suivie d’une digestion, où la matière broyée est mélangée à de l’acide sulfurique concentré (80–98 %) à haute température (jusqu’à 220 °C), ce qui donne une masse solide de digestion.
Cette masse solide est ensuite dissoute et réduite dans de l’eau froide ou de l’acide dilué pour former une solution de dioxyde de titane, le fer trivalent étant réduit en fer divalent afin d’éviter toute contamination.
La solution est ensuite clarifiée pour éliminer tous les solides non dissous par décantation et filtration. Pour les solutions dérivées de l’ilménite, le sulfate de fer est cristallisé par refroidissement afin de réduire sa concentration.
L’étape clé est l’hydrolyse, au cours de laquelle l’hydrate d’oxyde de titane est précipité de la solution à 94–110 °C, souvent à l’aide de noyaux pour contrôler les propriétés des particules. Cet hydrolysat est ensuite purifié par réduction (blanchiment) avec des agents tels que la poudre de zinc ou d’aluminium pour éliminer les impuretés colorées restantes, puis une seconde filtration et un lavage sont effectués.
Avant l’étape finale de chauffage, l’hydrate est dopé avec des composés de métaux alcalins et de l’acide phosphorique, et parfois avec des noyaux de rutile et des stabilisants, afin d’obtenir des pigments aux caractéristiques spécifiques.
Enfin, l’hydrate dopé est calciné dans des fours rotatifs à 800–1100 °C pour éliminer l’eau et l’acide sulfurique résiduel et le convertir en dioxyde de titane cristallin. Le clinker obtenu est ensuite broyé (par voie humide ou sèche) pour obtenir la finesse pigmentaire souhaitée.
4.2. Production de dioxyde de titane par le procédé au chlorure
Le procédé au chlorure pour la production de pigment de dioxyde de titane commence par la chloration. Des matières premières contenant du titane et du coke de pétrole réagissent avec du chlore et de l’oxygène dans un réacteur à lit fluidisé à haute température (800–1200 °C) pour produire du tétrachlorure de titane (TiCl4).
Les gaz de réaction chauds résultants sont refroidis, d’abord pour séparer les autres chlorures solides et les poussières du TiCl4, puis pour condenser la majeure partie du tétrachlorure de titane en le refroidissant à une température inférieure à 0 °C.
Le TiCl4 condensé est ensuite purifié par distillation pour éliminer les chlorures solides et les impuretés dissoutes comme le chlore, le tétrachlorure de vanadium et le phosgène, afin d’obtenir du tétrachlorure de titane de haute pureté.
Enfin, la vapeur de TiCl4 purifiée est chauffée et mise en réaction avec de l’oxygène préchauffé à très haute température (900–1400 °C) dans un réacteur spécialement conçu. Cette réaction produit du pigment de dioxyde de titane et du chlore gazeux.
Le pigment TiO2 est ensuite séparé du flux gazeux, et le chlore gazeux est souvent recyclé vers l’étape de chloration. La qualité du pigment (granulométrie et distribution) est soigneusement contrôlée par des facteurs tels que la température de réaction et l’ajout de composés spécifiques.
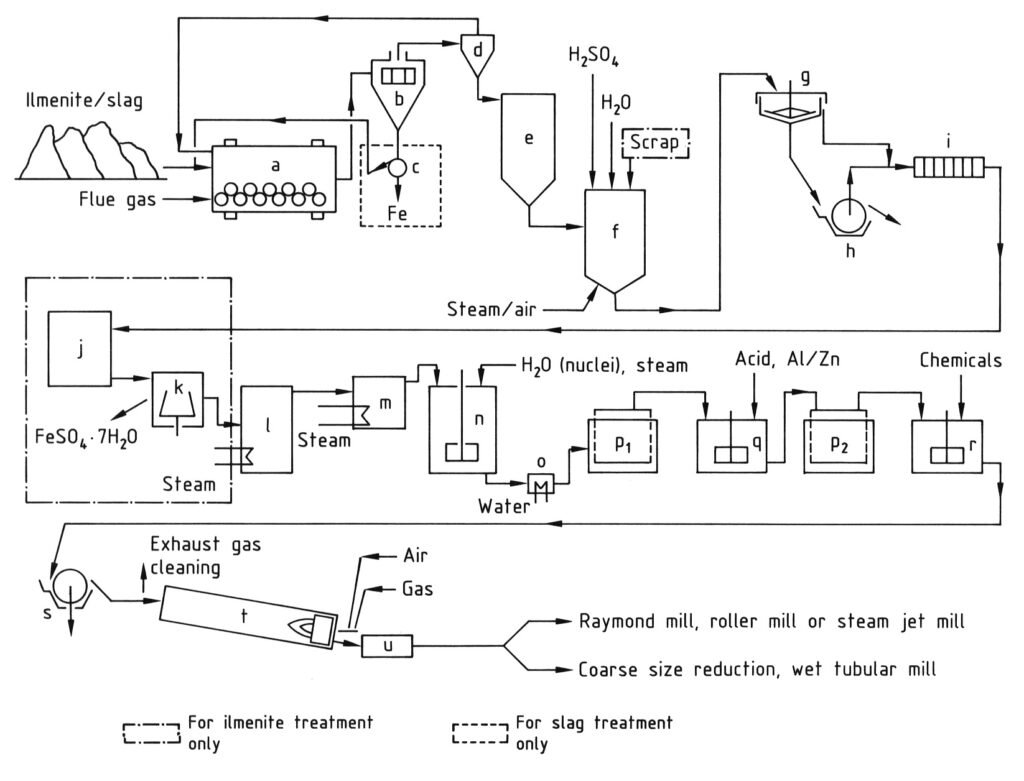
a) Broyeur à boulets/sécheur ; b) Tamis ; c) Séparateur magnétique ; d) Cyclone ; e) Silo ; f) Cuve de digestion ; g) Épaississeur ; h) Filtre rotatif ; i) Filtre-presse ; j) Cristallisoir ; k) Centrifugeuse ; l) Évaporateur sous vide ; m) Préchauffeur ; n) Cuve agitée pour l’hydrolyse ; o) Refroidisseur ; p) Filtres Moore ; q) Cuve agitée pour le blanchiment ; r) Cuve agitée pour le dopage ; s) Filtre rotatif pour la déshydratation ; t) Four rotatif ; u) Refroidisseur
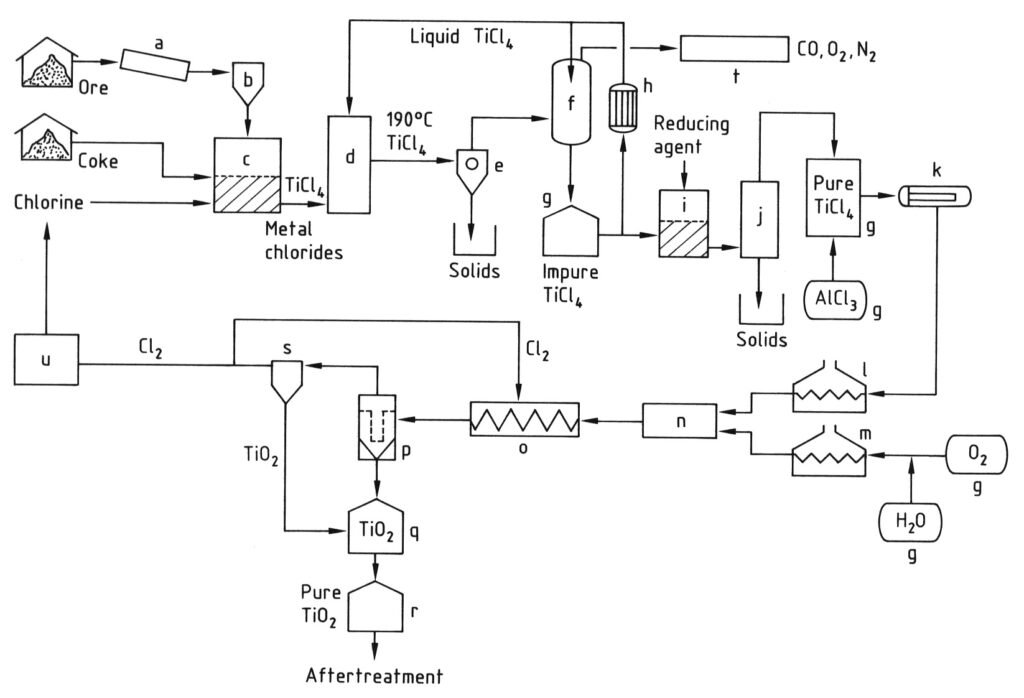
a) Broyeur ; b) Silo ; c) Réacteur à lit fluidisé ; d) Tour de refroidissement ; e) Séparation des chlorures métalliques ; f) Condensation de TiCl4 ; g) Réservoir ; h) Refroidisseur ; i) Réduction du vanadium ; j) Distillation ; k) Évaporateur ; l) Surchauffeur de TiCl4 ; m) Surchauffeur d'O2 ; n) Brûleur ; o) Serpentin de refroidissement ; p) Filtre ; q) Purification de TiO2 ; r) Silo ; s) Purification des gaz ; t) Épuration des gaz résiduaires ; u) Liquéfaction de Cl2
5. Propriétés pigmentaires du dioxyde de titane
Les principales caractéristiques pigmentaires du dioxyde de titane comprennent le pouvoir diffusant, le pouvoir couvrant, la brillance, la teinte dans la masse, la formation de brillant, le voile de brillant, la dispersibilité, la résistance à la lumière et la résistance aux intempéries. Ces propriétés dépendent de la pureté chimique, de la stabilisation du réseau, de la granulométrie et des revêtements de surface. L’évaluation des propriétés nécessite la prise en compte des interactions pigment-matrice.
5.1. Pouvoir diffusant
Les indices de réfraction du rutile (n = 2,80) et de l’anatase (n = 2,55) sont même supérieurs à ceux du diamant (n = 2,42). Les coefficients de réfraction relatifs varient généralement de 1,5 à 2,0 pour différents systèmes de liants.
Selon la théorie de Mie, la diffusion optimale se produit pour des particules de 0,2 μm. Le pouvoir diffusant dépend de la longueur d’onde ; Les petites particules de dioxyde de titane diffusent les nuances bleues, tandis que les plus grosses diffusent les nuances jaunes.
5.2. Massstone et couleur
La blancheur du dioxyde de titane dépend de la pureté, de la modification cristalline et de la taille des particules. Les pigments anatase ont une nuance jaune plus faible que le rutile, car leur bande d’absorption (385 nm) est décalée dans l’UV.
La présence d’impuretés d’éléments de transition affecte la blancheur, ce qui explique la pureté supérieure des pigments obtenus par procédé au chlorure, car le TiCl4 est purifié par distillation avant oxydation.
5.3. Dispersion
Une désintégration et une dispersion efficaces des pigments de dioxyde de titane sont essentielles pour obtenir une brillance élevée et minimiser le voile de brillance. Elles sont obtenues par broyage intensif et revêtement de surface organique. Le choix du traitement de surface dépend des exigences de l’application.
5.4. Résistance à la lumière et aux intempéries
L’altération des peintures et revêtements contenant du dioxyde de titane entraîne un farinage des pigments. L’absence d’oxygène ou la faible perméabilité à l’oxygène des liants (par exemple, les résines mélamine-formaldéhyde) prévient le farinage, mais provoque un grisonnement réversible. Ce grisonnement est considérablement réduit en l’absence d’eau.
L’anatase est plus sensible à ces deux effets. Les fabricants de pigments utilisent des méthodes de stabilisation, telles que le dopage au zinc ou à l’aluminium avant la calcination ou pendant l’oxydation.
En présence d’un liant stable, les pigments de dioxyde de titane agissent comme photocatalyseurs, induisant la dégradation du liant. Avec des liants peu stables, ils protègent le liant de la dégradation. Par conséquent, les tests de durabilité nécessitent des systèmes de liants hautement stables.
Le mécanisme de dégradation suit un cycle en cinq étapes :
- L’adsorption d’eau forme des groupes hydroxyles en surface.
- L’absorption de la lumière à courte longueur d’onde (anatase <385 nm, rutile <415 nm) génère un électron et un trou d’électron (exciton) au sein du réseau cristallin, qui migrent vers la surface du pigment.
- À la surface, un ion OH– est oxydé en radical OH• par le trou d’électron. Ce radical OH• se désorbe et peut dégrader le liant par oxydation. Simultanément, Ti4+ est réduit en Ti3+ par l’électron restant.
- L’ion Ti3+ est oxydé par l’oxygène adsorbé pour former un ion O2–, qui réagit avec H+ pour donner un radical HO2•.
- Le cycle se termine par la liaison de l’eau à la surface TiO2 régénérée.
En résumé, le processus de farinage est la réaction de l’eau et de l’oxygène pour former des radicaux OH• et HO2• sous l’influence du rayonnement à ondes courtes et de l’activité catalytique de la surface du dioxyde de titane.
Ce cycle peut être interrompu par exclusion d’air ou d’eau. L’exclusion de l’oxygène ou la diffusion limitante de l’oxygène dans le liant entraîne l’accumulation d’ions Ti3+ et un grisonnement, qui s’inverse par exposition progressive à l’oxygène. L’exclusion de l’eau empêche la réhydratation et la formation d’hydroxyles en surface.
Malgré cette activité photochimique, les pigments rutiles traités stabilisent de nombreux liants en empêchant la pénétration de la lumière dans les couches de revêtement. Les pigments TiO2 de haute qualité doivent présenter une excellente résistance aux intempéries, notamment au farinage important ou à la détérioration du brillant après une exposition de deux ans en Floride.
5.5. Abrasivité
L’abrasivité est une propriété indésirable des pigments au dioxyde de titane. L’anatase présente une abrasivité inférieure (Mohs 5,5-6,0) à celle du rutile (Mohs 6,5-7,0). Bien que ces valeurs de dureté intrinsèque semblent similaires, les additifs dopants influencent significativement la dureté pratique.
Par exemple, les pigments rutiles dopés à l’alumine présentent une abrasivité considérablement supérieure à celle des pigments anatase sans alumine. Les pigments issus du procédé au chlorure, généralement plus riches en alumine, présentent souvent une abrasivité supérieure à celle des pigments au sulfate.
Ce phénomène est attribué à la ségrégation d’ions accepteurs comme Al2O3 à la surface lors de la calcination, même à de faibles concentrations (< 0,4 %). Par conséquent, les études sur la topologie de surface et les paramètres de maille du dioxyde de titane nécessitent des matériaux de très haute pureté pour éviter toute erreur d’interprétation.
6. Utilisations du dioxyde de titane pigmentaire
Le dioxyde de titane est universellement adopté, remplaçant quasiment les autres pigments blancs. En 2007, l’Asie était en tête de la consommation mondiale, suivie de l’Europe et de l’Amérique du Nord. Le rutile représente environ 90 % de la consommation totale, et l’anatase 10 %.
6.1. Utilisations dans les peintures et les revêtements
Les peintures et les revêtements sont les plus gros consommateurs de dioxyde de titane. Le pigment TiO2 renforce les propriétés protectrices des matériaux de revêtement. Les pigments TiO2 modernes peuvent former des couches minces (quelques micromètres) pour assurer une couverture complète du substrat. Les concentrations volumiques de pigment varient de 10 % à 35 % dans les peintures brillantes et peuvent dépasser 80 % dans les peintures mates en émulsion.
Les pigments commerciaux permettent la fabrication de peintures à l’aide d’équipements de dispersion de base tels que les dissolveurs à disques. Un traitement organique avant la micronisation par jet de vapeur améliore les propriétés de brillance et réduit le voile de brillance dans les émaux à cuire. La sédimentation ne se produit pas lors du stockage de ces produits, qui présentent une bonne résistance à la lumière et aux intempéries.
6.2. Utilisations dans les encres d’imprimerie
L’impression moderne nécessite des épaisseurs de couche inférieures à 10 μm, ce qui nécessite des pigments de dioxyde de titane de la plus haute qualité. Ces films ultra-fins ne sont possibles qu’avec des pigments TiO2, dont le pouvoir éclaircissant (réducteur) est sept fois supérieur à celui du lithopone.
Une dispersibilité exceptionnelle est essentielle pour obtenir un brillant optimal. La neutralité du dioxyde de titane le rend particulièrement adapté à l’éclaircissement des pigments colorés.
6.3. Utilisations dans les plastiques
Le dioxyde de titane est largement utilisé pour colorer les produits en plastique durables et non durables, notamment les jouets, les appareils électroménagers, les automobiles, les meubles et les films d’emballage. Les pigments TiO2 absorbent les rayons UV inférieurs à 415 nm ; ils sont donc utilisés pour protéger les plastiques pigmentés des rayons nocifs.
Même une quantité minime de dioxyde de titane confère de l’opacité aux plastiques. On l’ajoute donc aux produits de couleur foncée pour éviter un aspect translucide et « sale ».
6.4. Utilisations dans les fibres
Les pigments de dioxyde de titane confèrent un aspect solide aux fibres synthétiques en éliminant les propriétés translucides et l’aspect gras associé. Les pigments anatase sont privilégiés pour cette application en raison de leur effet abrasif moindre sur les équipements de filature que le rutile. Un couchage approprié peut améliorer la faible résistance à la lumière des pigments anatase dans les fibres polyamides.
6.5. Utilisations dans le papier
En Europe, des charges telles que le kaolin, la craie ou le talc sont couramment utilisées pour l’éclaircissement et l’opacification du papier. Les pigments de dioxyde de titane sont idéaux pour les papiers à haute blancheur nécessitant une opacité sur des épaisseurs très fines (par exemple, le papier avion ou le papier d’impression fin).
Le TiO2 peut être ajouté à la pâte à papier ou appliqué comme couchage pour obtenir un papier d’art de qualité supérieure. Les papiers laminés sont généralement colorés avec des pigments rutiles extrêmement résistants à la lumière avant d’être imprégnés de résine mélamine-urée pour former des couches ou des films décoratifs.
6.6. Autres applications
Les pigments de dioxyde de titane sont utilisés dans les industries de l’émail et de la céramique, la fabrication du ciment blanc et la coloration du caoutchouc et du linoléum. Ils sont également utilisés comme absorbeurs d’UV dans les crèmes solaires, les savons, les poudres cosmétiques, les crèmes, les dentifrices et les feuilles de papier pour cigares.
Le dioxyde de titane est également utilisé comme colorant alimentaire et, plus largement, dans l’industrie cosmétique en raison de ses propriétés telles que sa non-toxicité (absorption orale), sa compatibilité avec la peau et les muqueuses, et sa bonne dispersibilité dans diverses solutions et liants.
Des pigments TiO2 conducteurs d’électricité ont été produits par traitements de surface avec des revêtements d’oxydes mixtes d’indium-étain ou d’antimoine-étain. Ces pigments sont utilisés dans les fibres des papiers électrophotographiques et dans la production de plastiques antistatiques.
7. Utilisations du dioxyde de titane non pigmentaire

Le TiO2 non pigmentaire est utilisé dans les émaux vitreux, le verre et les vitrocéramiques, les électrocéramiques, les catalyseurs et supports de catalyseurs, les flux de soudage, les pigments colorés, les conducteurs électriques, les intermédiaires chimiques (par exemple, le fluorotitanate de potassium), les céramiques structurales, les absorbeurs UV et les revêtements réfractaires.
7.1. Électrocéramiques
Les titanates (par exemple, les titanates de baryum, de strontium, de calcium et de plomb), synthétisés à partir de substrats de dioxyde de titane de haute pureté, sont utilisés dans la production de condensateurs, de résistances PTC et de matériaux piézoélectriques.
Les exigences relatives aux matières premières à base de TiO2 en matière de pureté, de réactivité et de frittage deviennent de plus en plus strictes en raison de la tendance à la miniaturisation des composants électroniques, qui nécessite des couches céramiques plus fines et des particules plus petites.
Les progrès récents de l’utilisation de l’hydrate d’oxyde de titane (issu du procédé au sulfate) ont permis la production à l’état solide de BaTiO3 ultrapur et ultrafin à moins de 500 °C.
Les composants piézocéramiques multicouches, tels que les actionneurs pour systèmes d’injection de carburant, nécessitent des céramiques à faible frittage. Les composants TiO2 et ZrO2 hautement réactifs du titanate de zirconate de plomb (PZT) facilitent la formation de structures pérovskites et le frittage ultérieur à des températures suffisamment basses pour réduire considérablement la teneur en palladium, coûteuse, des électrodes de ces actionneurs.
La consommation mondiale de dioxyde de titane pour l’électrocéramique dépasse 10 000 tonnes par an. Malgré l’effet de la miniaturisation des composants électrocéramiques, qui réduit la quantité de matière première nécessaire par pièce électronique, une croissance annuelle continue est prévisible.
7.2. Catalyseurs
Le dioxyde de titane est utilisé comme catalyseur actif pour diverses réactions thermiques et photochimiques, impliquant des composés inorganiques et organiques. Il peut être autoporteur ou déposé sur d’autres matériaux. Un dopage avec des éléments supplémentaires renforce généralement son effet catalytique souhaité.
La principale application catalytique du dioxyde de titane est l’élimination des oxydes d’azote des gaz résiduaires industriels (centrales électriques, incinérateurs et véhicules diesel). Dans ce procédé appelé réduction catalytique sélective (RCS), les oxydes d’azote réagissent avec l’ammoniac en présence d’oxygène au-dessus du catalyseur pour produire de l’azote et de l’eau.
La consommation mondiale de dioxyde de titane pour les catalyseurs RCS est d’environ 25 000 t/an. Ces catalyseurs contiennent généralement jusqu’à 15 % d’oxyde de tungstène et environ 1 % de V2O5, en plus du TiO2. Les méthodes de fabrication des catalyseurs comprennent l’extrusion en nid d’abeille, le revêtement sur des substrats (par exemple, la cordiérite) ou le dépôt sur des feuilles de métal.
Des exigences strictes en matière de pureté, de granulométrie et de porosité sont requises pour garantir une activité catalytique soutenue sur de longues durées de vie. On s’attend à une demande croissante d’élimination des oxydes d’azote des moteurs diesel fixes et mobiles.
De nombreuses autres applications catalytiques utilisent du TiO2 pur, du TiO2 avec additifs incorporés ou du TiO2 avec des métaux déposés en surface (par exemple, Rh, Pt, Pd, Au, Ag).
7.3. Photocatalyseurs
De nombreuses recherches mondiales se concentrent sur l’exploitation de la photoactivité des nanoparticules de dioxyde de titane traitées ou non traitées. Le dioxyde de titane peut être utilisé pour la décomposition catalytique de composés organiques dans les eaux usées ou pour la purification photocatalytique de l’air.
La photocatalyse du TiO2 pur nécessite un rayonnement UV en raison de sa bande interdite semi-conductrice d’environ 3,1 eV ; elle est donc réservée aux applications extérieures. Cependant, le dopage du dioxyde de titane avec des métaux, du carbone ou de l’azote permet des réactions photocatalytiques utilisant la partie visible du spectre. Néanmoins, l’intensité du rayonnement peut être un facteur limitant, même pour les applications en lumière visible.
Des exemples d’applications photocatalytiques récentes sont les revêtements architecturaux autonettoyants (extérieurs), les revêtements intérieurs pour la décomposition des polluants atmosphériques dans les bâtiments, et les carrelages, revêtements ou bétons incorporant du dioxyde de titane nanostructuré pour la décomposition des oxydes d’azote urbains.
Ces technologies sont limitées à des applications spécialisées, telles que les hôpitaux ou les lieux d’intérêt public.
7.4. Pigments d’oxydes métalliques mixtes
Les pigments d’anatase, ou hydrolysats de dioxyde de titane, sont calcinés avec des oxydes de métaux de transition pour former des pigments de chrome rutile ou de nickel rutile (pigments d’oxydes métalliques mixtes).
7.5. Absorption UV
Les particules de TiO2 nanostructurées (5–50 nm) sont incorporées dans les crèmes solaires destinées à l’industrie cosmétique et dans les revêtements de protection UV (par exemple, pour le bois). On utilise généralement des particules de rutile nanostructurées avec des revêtements inorganiques et éventuellement organiques.
Le dioxyde de titane nanostructuré est transparent ; il absorbe efficacement les rayons UV-B (280–320 nm) et UV-A (320–400 nm). En raison de leur petite taille, ces particules de dioxyde de titane nanostructurées nécessitent un revêtement inorganique ou organique plus important que le TiO2 pigmentaire.
7.6. Autres applications
Le dioxyde de titane non pigmentaire est également utilisé dans les batteries, les piles à combustible, le clivage de l’eau et les systèmes photovoltaïques. Les batteries à base de titanate de lithium suscitent un intérêt croissant comme systèmes de stockage d’énergie rechargeables pour diverses applications.
Si les systèmes photovoltaïques à base de TiO2 (cellules Grätzel) sont bien connus, l’application du dioxyde de titane aux piles à combustible et à la production photocatalytique d’hydrogène à partir de l’eau grâce à la lumière solaire nécessite encore des recherches approfondies.
8. Toxicologie du dioxyde de titane
Le dioxyde de titane présente une bonne stabilité et une absence totale de toxicité après administration orale. Des études animales à long terme avec du TiO2 alimentaire n’ont montré aucune preuve d’absorption de titane.
Historiquement, l’absorption de pigments de dioxyde de titane finement divisés dans les poumons n’était pas associée à des effets cancérigènes spécifiques. Par conséquent, le Centre international de recherche sur le cancer (CIRC) a initialement classé le dioxyde de titane dans la classe 3, ce qui signifie qu’il n’était pas classable quant à sa cancérogénicité pour l’homme.
Cependant, en 2007, le CIRC a reclassé le TiO2 dans la classe 2B, indiquant qu’il est « possiblement cancérogène pour l’homme ». Cette classification s’applique aussi bien au dioxyde de titane pigmenté (granulométrie primaire de 200 à 300 nm) qu’aux particules ultrafines (granulométrie primaire inférieure à 50 nm).
Malgré cette reclassification, les études épidémiologiques sur l’exposition aux poussières de dioxyde de titane chez les travailleurs n’ont pas montré d’augmentation de la mortalité ni de l’incidence du cancer du poumon.
Références
- Auer, G., Woditsch, P., Westerhaus, A., Kischkewitz, J., Griebler, W.-d., Rohe, M. and Liedekerke, M. (2017). Pigments, Inorganic, 2. White Pigments. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.n20_n01.pub2
- Kang, X.; Liu, S.; Dai, Z.; He, Y.; Song, X.; Tan, Z. « Titanium Dioxide: From Engineering to Applications. » Catalysts, 2019, 9 (2), 191. DOI: 10.3390/catal9020191.
- Haider, A. J.; Jameel, Z. N.; Al-Hussaini, I. H. M. « Review on: Titanium Dioxide Applications. » Energy Procedia, 2019, 157, 17-29. DOI: 10.1016/j.egypro.2018.11.159.
- Fujishima, A.; Rao, T. N.; Tryk, D. A. « Titanium dioxide photocatalysis. » Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000, 1 (1), 1-21. DOI: 10.1016/S1389-5567(00)00002-2.
- Diebold, U. « The surface science of titanium dioxide. » Surface Science Reports, 2003, 48 (5–8), 53-229. DOI: 10.1016/S0167-5729(02)00100-0.
- Chen, X.; Mao, S. S. « Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications. » Chem. Rev., 2007, 107 (7), 2891–2959. DOI: 10.1021/cr0500535.
- Racovita, A. D. « Titanium Dioxide: Structure, Impact, and Toxicity. » Int. J. Environ. Res. Public Health, 2022, 19 (9), 5681. DOI: 10.3390/ijerph19095681.
- Weir, A.; Westerhoff, P.; Fabricius, L.; Hristovski, K.; von Goetz, N. « Titanium Dioxide Nanoparticles in Food and Personal Care Products. » Environ. Sci. Technol., 2012, 46 (4), 2242–2250. DOI: 10.1021/es204168d.
- Ghamarpoor, R.; Fallah, A.; Jamshidi, M. « Investigating the use of titanium dioxide (TiO2) nanoparticles on the amount of protection against UV irradiation. » Sci Rep, 2023, 13, 9793. DOI: 10.1038/s41598-023-37057-5.
- Middlemas, S.; Fang, Z. Z.; Fan, P. « A new method for production of titanium dioxide pigment. » Hydrometallurgy, 2013, 131–132, 107-113. DOI: 10.1016/j.hydromet.2012.11.002.
- Gázquez, M.; Bolívar, J.; Garcia-Tenorio, R.; Vaca, F. « A Review of the Production Cycle of Titanium Dioxide Pigment. » Materials Sciences and Applications, 2014, 5, 441-458. DOI: 10.4236/msa.2014.57048.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. « Titanium Dioxide. » In Some Organic Solvents, Resin Monomers and Related Compounds, Pigments and Occupational Exposures in Paint Manufacture and Painting; IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 47; International Agency for Research on Cancer: Lyon (FR), 1989. Available from: https://www.ncbi.nlm.nih.gov/books/NBK524874/.
- Goparaju, V. R. R.; Marshall, D. F.; Kazerooni, V. « Process for manufacturing titanium dioxide pigments using ultrasonication. » U.S. Patent 9,353,266, 2016. Available from: https://patents.google.com/patent/US9353266B2/en.
- Davis, B. R.; Rahm, J. A. « Process for manufacturing titanium dioxide. » U.S. Patent 4,288,418, 1981. Available from: https://patents.google.com/patent/US4288418A/en.
- Ayorinde, T.; Sayes, C. M. « An updated review of industrially relevant titanium dioxide and its environmental health effects. » J. Hazard. Mater. Lett., 2023, 4, 100085. DOI: 10.1016/j.hazl.2023.100085.
