Dichloroacétaldéhyde

Dichloroacétaldéhyde [79-02-7], ou 2,2-dichloroéthanal, est un acétaldéhyde chloré avec la formule chimique Cl2CHCHO. C’est un liquide incolore avec une odeur piquante et irritante qui a été produite pour la première fois en 1868 par F. paterno par distillation de dichlorodiéthyl acétal, CHCl2CH(OC2H5)2, avec de l’acide sulfurique.
Table des matières
1. Propriétés physiques du dichloroacétaldéhyde
Le dichloroacétaldéhyde, également connu sous le nom de 2,2-dichloroéthanal, est un liquide incolore doté d’une odeur âcre caractéristique. Il possède plusieurs propriétés physiques clés :
- Poids moléculaire : 112,94 g/mol
- Point de fusion : -37,6 à -37,4 °C
- Point d’ébullition : 89,2 °C
- Densité (25 °C) : 1,4113 g/cm³
- Moment dipolaire (30 °C) : 2,36 D
- Solubilité : miscible dans l’eau, formant un hydrate, et facilement soluble dans les solvants organiques courants.
Le dichloroacétaldéhyde réagit facilement avec l’eau pour former un monohydrate (CAS : 16086-14-9), connu sous le nom de 2,2-dichloro-1,1-éthanediol. Ce solide cristallin présente des propriétés distinctes :
- Poids moléculaire : 130,96 g/mol
- Point de fusion : 35–50 °C
- Point d’ébullition : 85–95 °C à 101,3 kPa
- Densité (20 °C) : 1,53–1,54 g/cm³
- Pression de vapeur : 6,5 kPa à 20 °C, 25 kPa à 50 °C
- Solubilité : soluble dans les solvants organiques polaires, insoluble dans les solvants non polaires.
- Point d’éclair : Environ 95 °C
- Température d’inflammation : Environ 605 °C
2. Réactions chimiques du dichloroacétaldéhyde
Le dichloroacétaldéhyde subit une polymérisation spontanée lors du stockage, formant un polymère solide et incolore. Ce polymère est reconverti en sa forme monomère lors du chauffage à 120 °C.
Le dichloroacétaldéhyde présente les réactions caractéristiques des aldéhydes, telles que l’oxydation, la réduction et la condensation.
La réaction d’oxydation avec l’acide chromique produit de l’acide dichloroacétique.
La réduction du dichloroacétaldéhyde avec de l’éthylaluminium donne du 2,2-dichloroéthanol.

L’autocondensation conduit à la formation de 2,2,4,4-tétrachloroacétaldol.
La réaction de condensation du dichloroacétaldéhyde avec l’éthylbenzène donne le p,p’-diéthyl-1,1-diphényl-2,2-dichloroéthane, un insecticide connu sous le nom de Perthane.

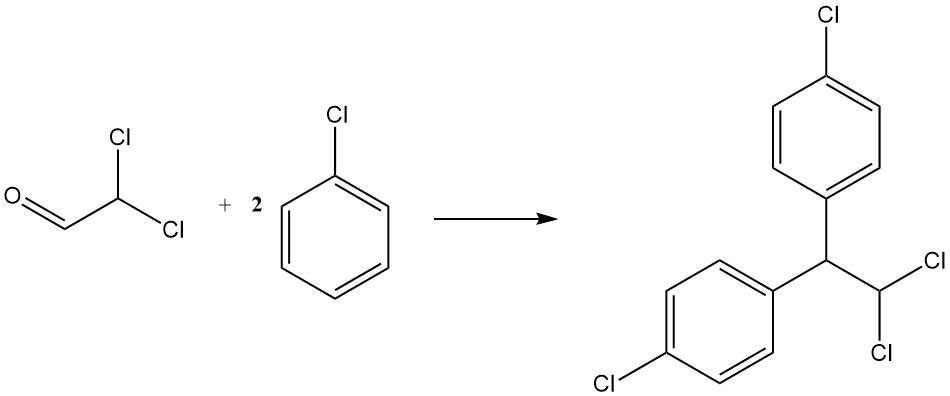
La condensation avec le chlorobenzène donne du p,p’-dichloro-1,1-diphényl-2,2-dichloroéthane, un autre insecticide connu sous le nom de TDE ou DDD. Il est représenté par l’équation suivante :
CHCl2CHO + 2 C6H5Cl → CHCl2CH(C6H4Cl)2 + H2O
3. Production de dichloroacétaldéhyde
Le processus de production industrielle le plus important du dichloroacétaldéhyde est la chloration de l’acétaldéhyde ou du paraldéhyde. Une autre méthode de production de dichloroacétaldéhyde pur est l’hypochloration du 1,2-dichloroéthylène.
3.1. Chloration de l’acétaldéhyde ou du paraldéhyde
Cette méthode génère du dichloroacétaldéhyde ainsi que du chloroacétaldéhyde et trichloroacétaldéhyde. Des rendements élevés sont possibles avec des catalyseurs comme le trichlorure d’antimoine (83 %) ou l’acide phosphorique (> 90 %). L’oxychloration pendant le procédé Wacker pour la production d’acétaldéhyde peut également produire du dichloroacétaldéhyde comme sous-produit.
3.2. Hypochloration du 1,2-dichloroéthylène
Ce procédé permet d’obtenir du dichloroacétaldéhyde pur, exempt d’impuretés comme le chloral et le monochloroacétaldéhyde. Il s’agit de traiter le 1,2-dichloroéthylène avec une mole de chlore dans des conditions spécifiques de température et de solvant.
3.3. Chloration de l’éthanol
La chloration contrôlée de l’éthanol en présence de chlorure de nickel (II) peut principalement produire du dichloroacétaldéhyde, ainsi qu’un peu de chloral et de monochloroacétaldéhyde. L’hémiacétal résultant peut être directement utilisé sans isoler le dichloroacétaldéhyde pur ou son hydrate.

4. Utilisations du dichloroacétaldéhyde
Le dichloroacétaldéhyde et ses acétals sont utilisés dans l’industrie pharmaceutique pour la production de trichlorométhiazide, un diurétique utilisé pour traiter des affections telles que l’hypertension artérielle et œdème et mitotane (1,1-dichloro-2-(o-chlorophényl)-2-(p-chlorophényl)éthane), un agent cytostatique utilisé dans le traitement de cancers spécifiques des glandes surrénales.
Il est également utilisé dans la production d’insecticides comme le Perthane et le TDE ou DDD.
5. Toxicologie du dichloroacétaldéhyde
Le dichloroacétaldéhyde présente une irritation potentielle des voies respiratoires, bien que les données formelles des tests de toxicité soient absentes. Par mesure de précaution, il doit être manipulé avec précaution.
6. Polymères de dichloroacétaldéhyde
6.1. Hexachloroparaldéhyde
- Formule : C6H6Cl6O3
- Masse molaire : 338,83 g/mol
- Apparence : cristaux incolores
- Point de fusion : 131-132 °C
- Point d’ébullition : 210-220 °C (décomposition)
L’hexachloroparaldéhyde est produit par la réaction du dichloroacétaldéhyde avec des acides de Lewis comme le trichlorure d’antimoine, le chlorure de fer(III) ou le trifluorure de bore ou par chloration directe du paraldéhyde avec 6-7 mole de chlore à 35 °C dans des conditions anhydres.
Il forme du dichloroacétaldéhyde hydraté en présence d’acides aqueux et se décompose en dichloroacétaldéhyde à des températures élevées.
6.2. Polydichloroacétaldéhydes
- Formule : (C2H2Cl2O)n
- Solubilité : variable selon le degré de polymérisation, généralement soluble dans les solvants organiques courants.
Les formes cristallines des polydichloroacétaldéhydes sont produites en traitant le dichloroacétaldéhyde à -78 °C avec des composés organométalliques comme le triéthylaluminium, et les formes amorphes sont préparées à l’aide d’acides de Lewis à des températures inférieures à 0 °C.
Ces polymères sont solubles dans l’acide sulfurique concentré à 100 °C avec décoloration et dans le diméthylformamide. Ils peuvent former des copolymères avec d’autres aldéhydes.
Référence
- Chloroacétaldéhydes ; Encyclopédie Ullmann de chimie industrielle. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
