Cumène : propriétés, réactions, production, utilisations et toxicologie
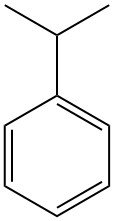
Qu’est-ce que le cumène ?
Le cumène, également appelé isopropylbenzène ou 2-phénylpropane, est un hydrocarbure aromatique de formule chimique C9H12. C’est un liquide incolore et inflammable à l’odeur caractéristique d’essence.
Le cumène est un constituant mineur du pétrole brut et des carburants dérivés du pétrole. Il est principalement utilisé comme intermédiaire dans l’industrie chimique, notamment pour la production de phénol et d’acétone.
Table des matières
1. Propriétés physiques du cumène
Le cumène est un liquide incolore et volatil à l’odeur aromatique caractéristique. Il est miscible à de nombreux solvants organiques, notamment l’éthanol, l’éther diéthylique, l’acétone, le benzène, l’éther de pétrole et le tétrachlorure de carbone. Sa solubilité dans l’eau est faible, environ 61,3 mg/L à 25 °C.
Le cumène forme des azéotropes avec l’eau, les acides carboxyliques aliphatiques, les éthers d’éthylène glycol, le cyclohexanol et la cyclohexanone.
Le cumène possède un seuil olfactif variable, les valeurs rapportées allant de 0,008 à 0,13 ppm. Si certaines études font état d’une perception olfactive humaine aussi faible que 0,0032 ppm, d’autres citent des valeurs plus proches de 0,012 ppm. La détection des odeurs n’est pas une méthode fiable pour évaluer une exposition dangereuse au cumène.
Les limites d’explosivité des mélanges cumène-air se situent entre 0,8 % et 6,0 % en volume. Cela correspond à une concentration de cumène de 40 à 300 g/m³.
Le tableau 1 répertorie toutes les propriétés physiques importantes du cumène.
| Propriété | Valeur |
|---|---|
| Numéro CAS | 98-82-8 |
| Formule chimique | C9H12 |
| Masse molaire | 120,2 |
| Point de congélation, °C | −96,03 |
| Point d'ébullition, °C | 152,39 |
| Densité, g/cm3 (0 °C) | 0,8797 |
| Densité, g/cm3 (20 °C) | 0,8633 |
| Densité, g/cm3 (40 °C) | 0,8465 |
| Indice de réfraction, n20D | 1,4915 |
| Conductivité thermique à 25 °C, W/(m·K) | 0,124 |
| Viscosité, mPa·s (0 °C) | 1,073 |
| Viscosité, mPa·s (20 °C) | 0,790 |
| Viscosité, mPa·s (40 °C) | 0,610 |
| Tension superficielle à 20 °C, mN/m | 28,2 |
| Pression de vapeur à 35 °C, kPa | 1 |
| Pression de vapeur à 100 °C, kPa | 21 |
| Pression de vapeur à 120 °C, kPa | 40 |
| Pression de vapeur à 140 °C, kPa | 73 |
| Pression de vapeur à 180 °C, kPa | 196 |
| Point d'éclair, °C | 33 |
| Température d'auto-inflammation, °C | 425 |
| Limites d'inflammabilité dans l'air, % vol. (inférieures) | 0,9 |
| Limites d'inflammabilité dans l'air, % vol. (supérieures) | 6,5 |
| Température critique, °C | 358,0 |
| Pression critique, kPa | 3220 |
| Densité critique, g/cm3 | 0,280 |
| Chaleur de vaporisation au point d'ébullition, J/g | 312 |
| Chaleur de vaporisation à 25 °C, J/g | 367 |
| Chaleur de formation (liquide) à 25 °C, J/mol | −44 150 |
| Énergie libre (vapeur) à 25 °C, J/mol | 137 000 |
| Chaleur de combustion (brute, eau liquide), J/g | 43 370 |
| Chaleur de combustion (nette, vapeur d'eau), J/g | 41 170 |
| Capacité thermique (liquide) à 25 °C, J/(mol·K) | 197 |
| Capacité thermique (vapeur idéale) à 25 °C, J/(mol·K) | 153 |
2. Réactions chimiques du cumène
L’oxydation du cumène en hydroperoxyde de cumène est la réaction industrielle la plus importante du cumène. D’autres réactions incluent la substitution aromatique classique (nitration, sulfonation, halogénation, alkylation et acylation), l’halogénation des chaînes latérales, l’hydrogénation et la combustion.
2.1. Le procédé au cumène
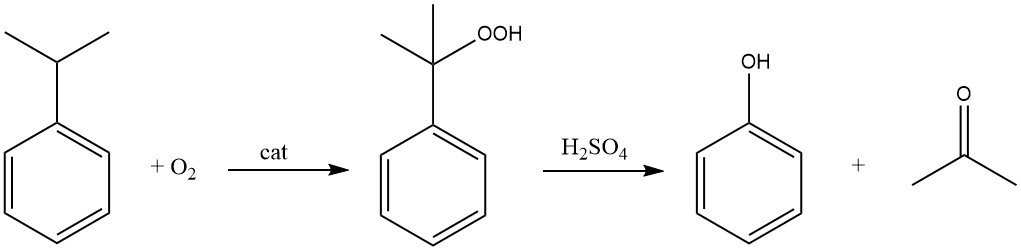
Le procédé au cumène, également appelé procédé Hock, commence par la synthèse du cumène lui-même, suivie d’une conversion en deux étapes en phénol et en acétone.
Le cumène est oxydé par l’air (oxygène) en présence d’un initiateur radicalaire pour former de l’hydroperoxyde de cumène. Cette réaction cible l’atome d’hydrogène tertiaire du carbone lié au cycle benzénique.
À l’aide d’un catalyseur acide comme l’acide sulfurique, l’hydroperoxyde de cumène est ensuite clivé pour produire du phénol et de l’acétone.
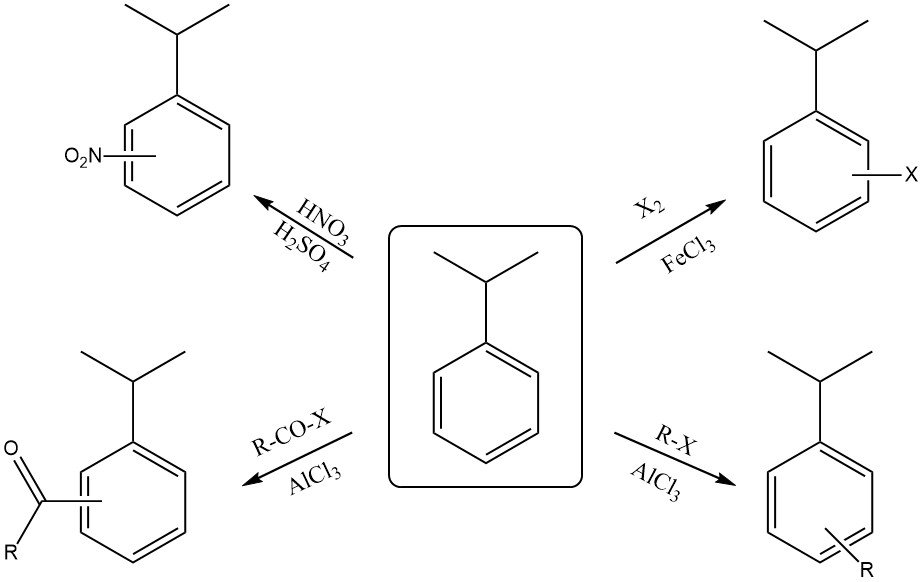
2.2. Réactions sur le cycle aromatique
Le cumène réagit avec un mélange d’acide nitrique concentré et d’acide sulfurique pour former un mélange d’ortho-nitrocumène et de para-nitrocumène. L’isomère para est généralement le produit majoritaire en raison de l’encombrement stérique dû au groupe isopropyle volumineux.
L’halogénation du cycle avec des réactifs comme le chlore ou le brome en présence d’un catalyseur acide de Lewis (FeCl3 ou FeBr3) produit également des substitutions ortho et para.
La réaction avec l’acide sulfurique fumant produit de l’acide cumènesulfonique.
Le cumène peut réagir avec un halogénure d’alkyle et un catalyseur acide de Lewis (AlCl3 ) pour former de l’alkylcumène. La réaction du cumène avec un halogénure d’acyle en présence d’un catalyseur acide de Lewis (AlCl3) produit un ortho- et un para-acylcumène.
2.3. Réactions sur la chaîne latérale alkyle
L’hydrogène benzylique (l’hydrogène présent sur le carbone directement lié au cycle benzénique) est particulièrement sensible aux réactions radicalaires en raison de la stabilité du radical benzylique obtenu.
Le cumène peut être oxydé par des agents oxydants puissants comme le permanganate de potassium ou l’acide chromique. Cette réaction oxyde complètement le carbone benzylique en un groupe acide carboxylique pour produire de l’acide benzoïque et non du phénol.
À haute température, sous l’effet de la lumière UV ou en présence d’initiateurs radicalaires, les halogènes comme le chlore ou le brome réagissent exclusivement en position benzylique pour remplacer l’atome d’hydrogène.
L’hydrogénation du cycle aromatique donne de l’isopropylcyclohexane en utilisant des catalyseurs tels que Ni, Pt ou Pd.
Comme d’autres hydrocarbures, le cumène brûle en présence d’oxygène pour produire du dioxyde de carbone et de l’eau.
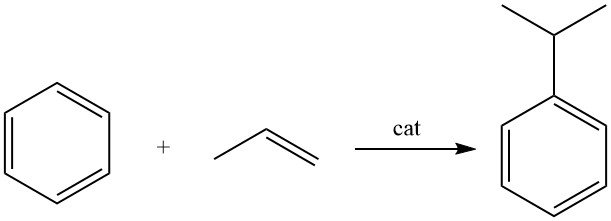
3. Production industrielle de cumène
Le cumène est produit par alkylation du benzène avec du propène en présence d’un catalyseur acide.
Historiquement, le cumène a été synthétisé en grandes quantités pour être utilisé comme composant de l’essence aviation pendant la Seconde Guerre mondiale. Malgré son pouvoir calorifique et son indice d’octane élevés, il n’est plus compétitif comme carburant. Sa présence dans l’essence moderne est un sous-produit mineur des procédés de raffinage tels que le reformage catalytique et le vapocraquage.
La production de cumène a connu des avancées significatives grâce au développement de nouvelles technologies de catalyseurs, notamment les systèmes à base de zéolites, qui ont remplacé les anciennes méthodes utilisant de l’acide phosphorique solide et du chlorure d’aluminium. Cette évolution technologique, amorcée au milieu des années 1990, a révolutionné l’industrie.
Outre sa production synthétique, le cumène est naturellement présent dans le pétrole brut et les produits pétroliers raffinés.
3.1. Réactions d’alkylation et de transalkylation
Le cumène est produit par alkylation du benzène avec du propylène en phase liquide à l’aide d’un catalyseur acide.
Cette réaction directe est thermodynamiquement favorable. Cependant, la conversion du propylène peut être limitée par l’activité du catalyseur et le transfert de masse. Bien que le n-propylbenzène soit thermodynamiquement plus stable que le cumène, il n’est produit qu’en faible quantité car le carbone secondaire de la molécule de propylène est plus réactif.
Ce carbone secondaire se transforme en carbocation sur le site acide du catalyseur, qui réagit ensuite avec le benzène pour former du cumène. Une sélectivité élevée pour le cumène par rapport au n-propylbenzène, avec un rapport pouvant atteindre 10 000:1, est importante, car ces isomères sont difficiles à séparer par distillation.
Une alkylation supplémentaire peut également se produire, où le cumène réagit avec davantage de propylène pour produire des polyisopropylbenzènes, notamment des diisopropylbenzènes, des triisopropylbenzènes et des tétraisopropylbenzènes.
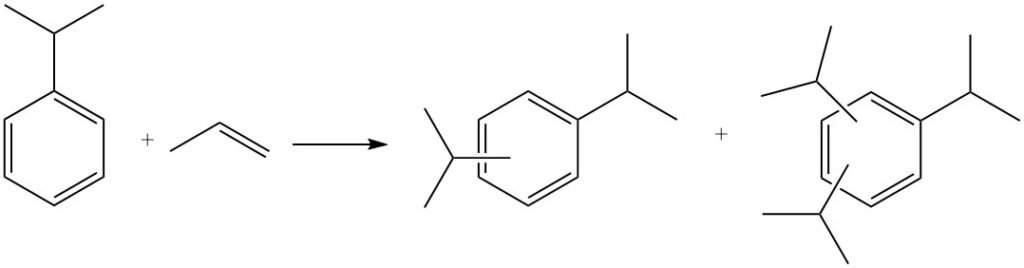
Les polyisopropylbenzènes peuvent être transformés en cumène par réaction avec le benzène lors d’un processus appelé transalkylation.
L’alkylation est une réaction exothermique, tandis que la transalkylation est essentiellement isotherme. Un excès de benzène est généralement utilisé lors de l’alkylation pour gérer la température, minimiser la formation de polyisopropylbenzènes et prévenir l’oligomérisation du propylène.
Si un rapport benzène/propylène élevé favorise la sélectivité en cumène, il augmente également le coût et l’énergie nécessaires à la récupération de l’excédent de benzène par distillation.
3.2. Production de cumène par le procédé à l’acide phosphorique solide (ASP)
Avant 1996, le procédé ASP était la méthode la plus courante de production de cumène, représentant plus de 80 % de la production mondiale. Ce procédé utilisait de l’acide phosphorique sur support d’alumine comme catalyseur.
Dans cette méthode, dont la licence internationale a été accordée par UOP, un mélange de propylène liquide (souvent un mélange propane-propylène) et de benzène, ainsi qu’une petite quantité d’eau pour maintenir l’activité du catalyseur, était préchauffé et introduit dans un réacteur à lit fixe fonctionnant à 180–200 °C et à environ 550 psig.
Le rapport molaire benzène/propylène variait généralement de 5:1 à 8:1. Les réacteurs fonctionnaient adiabatiquement, et la chaleur dégagée par la réaction était partiellement utilisée pour vaporiser le propane recyclé.
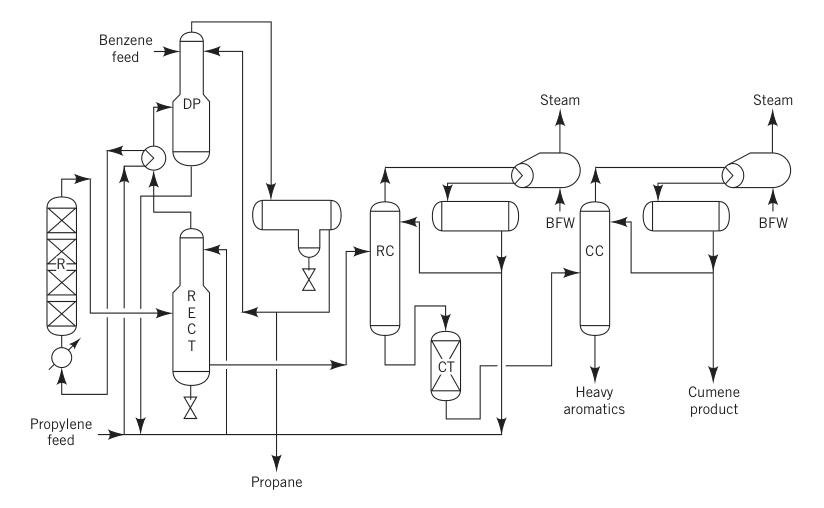
R = réacteur ; RECT = rectificateur ; DP = dépropaniseur ; RC = colonne de recyclage ; CT = dispositif de traitement d'argile ; CC = colonne de cumène ; et BFW = eau d'alimentation de la chaudière.
Le procédé SPA était populaire en raison de son faible investissement initial et de sa flexibilité en termes de matières premières, car il pouvait utiliser du propylène de qualité raffinerie et du benzène de faible pureté. Les sous-produits, tels que les aromatiques lourds, pouvaient être utilisés pour le mélange d’essences, ce qui constituait un avantage clé pour les raffineries.
Cependant, ce procédé présentait un rendement relativement faible (environ 5 % de perte) et produisait des impuretés. Les tentatives de récupération et de transalkylation des aromatiques lourds ont échoué en raison de fortes concentrations d’impuretés comme les hexylbenzènes.
3.3. Production de cumène par le procédé au chlorure d’aluminium
Une autre méthode plus ancienne de fabrication du cumène utilisait un complexe de chlorure d’aluminium comme catalyseur et fonctionnait à des températures inférieures à 100 °C et à basse pression. Ce procédé nécessitait des matières premières de plus grande pureté et une déshydratation minutieuse du benzène pour maintenir l’activité du catalyseur et réduire la corrosion.
Le procédé au chlorure d’aluminium offrait l’avantage de pouvoir transalkyler les polyisopropylbenzènes en cumène, ce qui permettait d’obtenir des rendements plus élevés. Cependant, il nécessitait des réacteurs coûteux et résistants à la corrosion, comme ceux en Hastelloy ou avec un revêtement en verre, un lavage intensif des effluents et posait des problèmes environnementaux liés à l’élimination des catalyseurs.
3.4. Production de cumène par procédés modernes à base de zéolites
Depuis le milieu des années 1990, l’industrie du cumène a rapidement adopté des technologies d’alkylation à base de zéolites. Ces catalyseurs ont éliminé les problèmes de corrosion et d’élimination des déchets associés aux procédés antérieurs, tout en offrant des rendements élevés, une sélectivité élevée et une pureté de produit très élevée.
Les catalyseurs à base de zéolites modernes peuvent être régénérés à plusieurs reprises, ce qui réduit les déchets et les coûts d’exploitation. Ils permettent également des ratios d’alimentation benzène/propylène plus faibles, ce qui réduit la taille du système de distillation et diminue la consommation d’énergie.
Le procédé ExxonMobil/Badger, qui utilise un catalyseur MCM-22 exclusif, en est un exemple notable. Dans ce procédé en phase liquide, le propylène et le benzène sont prémélangés et introduits dans un réacteur d’alkylation à lit fixe, où le propylène est entièrement consommé. L’effluent est ensuite purifié par une série de colonnes de distillation.
L’excédent de benzène est recyclé, et les polyisopropylbenzènes sont récupérés et envoyés vers un réacteur de transalkylation séparé où ils réagissent avec le benzène pour former du cumène.
Ce procédé permet d’obtenir des rendements quasi stœchiométriques et un produit d’une grande pureté. Les usines de SPA ou de chlorure d’aluminium existantes peuvent être converties à cette technologie, avec des augmentations de capacité allant de 30 à plus de 100 % pour un investissement relativement modeste.
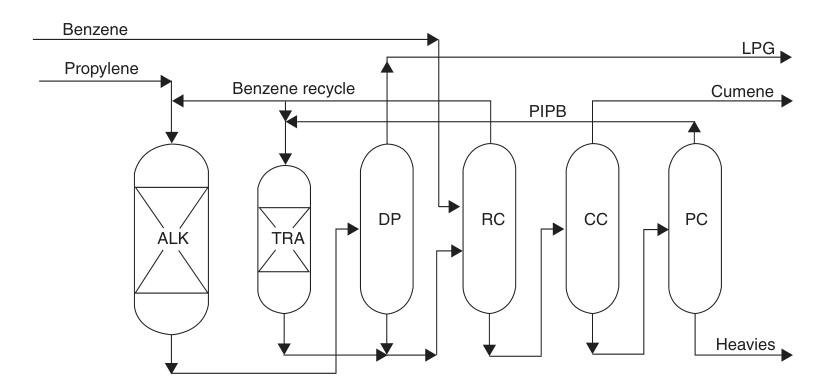
ALK = réacteur d'alkylation ; TRA = réacteur de transalkylation ; DP = propaniseur ; RC = colonne de recyclage ; CC = colonne cumène ; et PC = colonne de polyisopropylbenzènes.
D’autres entreprises, dont CDTech, Dow/Kellogg et UOP, ont également développé leurs propres technologies à base de zéolites. Par exemple, le procédé Q-Max d’UOP utilise une nouvelle génération de catalyseurs régénérables à plusieurs reprises, éliminant ainsi le besoin de les éliminer.
Cette technologie permet également d’augmenter la capacité des usines existantes avec un investissement minimal. Le passage à ces procédés avancés a permis à de nombreuses usines de cumène d’accroître considérablement leur capacité de production.
4. Utilisations du cumène
Le cumène a un indice d’octane de 109, comparable à celui du toluène. Dans les années 1940, cette propriété en faisait un additif précieux pour l’essence aviation.
Le cumène est aujourd’hui presque entièrement utilisé (95 % de la production totale) comme intermédiaire pour la production de phénol et d’acétone. En présence d’oxygène, le cumène subit une oxydation en hydroperoxyde de cumène, qui, après clivage acide-catalysé, produit du phénol et de l’acétone.
La production mondiale de cumène a atteint environ 18 millions de tonnes en 2020 et devrait augmenter, principalement grâce à la demande croissante de bisphénol A dans la fabrication de polycarbonates et de résines époxy.
Les sous-produits mineurs formés lors du processus d’oxydation du cumène comprennent l’α-méthylstyrène, l’acétophénone, les alcools cumyliques et le diisopropylbenzène.
L’α-méthylstyrène est utilisé dans la production de résines acrylonitrile-butadiène-styrène (ABS), de p-cumylphénol et d’autres intermédiaires.
L’hydroperoxyde de cumène est également utilisé comme initiateur radicalaire dans la copolymérisation du styrène avec le butadiène et les acrylates, ainsi que dans la réticulation des résines polyesters insaturées. La réaction de l’hydroperoxyde de cumène avec l’α-méthylstyrène donne le peroxyde de dicumyle, un initiateur de la réticulation radicalaire des polyoléfines.
L’hydrogénation du cumène produit de l’isopropylcyclohexane (hydrocumène), un solvant cycloaliphatique à point d’ébullition élevé (154,5 °C) et à point de congélation bas (–90 °C).
Le cumène est également utilisé en plus petites quantités comme diluant pour peintures, émaux et laques, ainsi que comme solvant pour graisses et résines, remplaçant parfois le benzène dans les applications industrielles.
Selon la Consumer Product Information Database (2022), le cumène est présent dans plus d’une centaine de produits de consommation et ménagers, notamment les pesticides et les produits de nettoyage.
5. Toxicologie du cumène
L’exposition au cumène se produit principalement par inhalation d’air contaminé en milieu professionnel et par évaporation de produits pétroliers. Parmi les autres sources figurent la fumée de cigarette, les aliments et l’eau contaminés, ainsi que l’ingestion accidentelle ou l’absorption cutanée.
L’inhalation est la voie d’exposition la plus importante, car le cumène est facilement absorbé par les poumons, métabolisé par le foie en composés hydrosolubles et efficacement excrété, principalement dans les urines, sans signe d’accumulation à long terme.
Des études toxicocinétiques humaines confirment que le cumène et son métabolite, le 2-phényl-2-propanol, sont éliminés dans les 40 heures suivant l’exposition.
Une exposition aiguë à de fortes concentrations de cumène induit une dépression du système nerveux central, se manifestant par des maux de tête, des étourdissements, une narcose, des nausées et une perte de connaissance à des niveaux bien supérieurs aux limites d’exposition professionnelle.
Le cumène est également un irritant primaire pour la peau, les yeux et les voies respiratoires. Un contact répété ou prolongé avec la peau peut provoquer des dermatites et des éruptions cutanées, tandis que l’ingestion comporte un risque élevé de pneumopathie d’aspiration.
Dans des études animales, une inhalation de courte durée à des concentrations supérieures à 1 000 ppm a induit des effets neurotoxiques réversibles, tandis qu’une exposition à des doses très élevées a entraîné une toxicité grave du système nerveux central et la mort.
La DL50 orale chez le rat est d’environ 1 400 mg/kg et les valeurs de CL50 par inhalation varient entre 2 000 et 8 000 ppm selon l’espèce.
| Voie d'exposition | Symptômes | Premiers secours |
|---|---|---|
| Inhalation et odorat |
Vertiges Incoordination Somnolence Maux de tête |
Sortir à l'air libre et se reposer Consulter un médecin si nécessaire |
| Contact cutané |
Peau sèche Éruptions cutanées Démangeaisons Rougeur de la peau |
Retirer immédiatement les vêtements contaminés et laver la peau à l'eau. Certaines références suggèrent de se laver la peau à l'eau et au savon après rinçage Si l'irritation persiste après le lavage, consulter un médecin. |
| Contact avec les yeux |
Irritation oculaire Rougeur |
En cas de contact avec les yeux, rincer immédiatement les yeux à grande eau, en soulevant de temps en temps les paupières inférieures et supérieures. Consulter immédiatement un médecin. |
| Avalement et ingestion |
Vertiges Incoordination Somnolence Maux de tête |
Risque d'aspiration.
Un bain de bouche et un rinçage sont recommandés. Éviter de faire vomir. Consulter immédiatement un médecin. |
Les données sur l’exposition chronique chez l’homme sont limitées, mais les études animales indiquent de légers effets hématologiques et organiques après une exposition subchronique par inhalation, tels qu’une congestion passive des poumons, du foie, des reins et de la rate. Aucun effet immunotoxique significatif n’a été rapporté.
Les preuves de toxicité pour la reproduction et le développement sont faibles, les études suggérant un métabolisme et une excrétion rapides sans effets significatifs sur la fertilité ou le développement de la progéniture.
Les tests de génotoxicité ont produit des résultats majoritairement négatifs dans les systèmes bactériens, in vitro et in vivo, bien que certaines études animales à fortes doses aient rapporté de faibles effets cytogénétiques.
Les données de cancérogénicité chez l’homme sont insuffisantes, mais les études d’inhalation à long terme chez les rongeurs ont démontré une incidence accrue de tumeurs du foie, des reins et des poumons, ce qui a conduit le Programme national de toxicologie des États-Unis à classer le cumène comme « raisonnablement considéré comme cancérogène pour l’homme ».
Le Centre international de recherche sur le cancer (CIRC) a également classé le cumène comme cancérogène possible pour l’homme (Groupe 2B).
L’Administration de la sécurité et de la santé au travail (OSHA) et l’American Conference of Governmental Industrial Hygienists (ACGIH) ont établi une limite d’exposition admissible moyenne pondérée dans le temps sur 8 heures et une valeur seuil de 50 ppm (245 mg/m³).
Si les effets aigus sont généralement réversibles, l’induction et l’élimination lentes de son action dépressive sur le système nerveux central suggèrent des risques cumulatifs potentiels.
Références
1. Hwang, S.Y. and Chen, S.S. (2010). Cumene. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0321130519030821.a01.pub3
2. Abdolmaleki, G.; Bayrami, Z. Cumene. In Encyclopedia of Toxicology, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 337–343. DOI: 10.1016/B978-0-12-824315-2.00295-5
3. Dimian, A.C. and Bildea, C.S. (2008). Alkylation of Benzene by Propylene to Cumene. In Chemical Process Design (eds A.C. Dimian and C.S. Bildea). https://doi.org/10.1002/9783527621583.ch6
4. Gollapudi, B. B.; Williams, A. L.; Bus, J. S. « A review of the genotoxicity of the industrial chemical cumene. » Mutat. Res./Rev. Mutat. Res., 2021, 787, 108364. DOI: 10.1016/j.mrrev.2021.108364
5. Schmidt, R., Griesbaum, K., Behr, A., Biedenkapp, D., Voges, H.-W., Garbe, D., Paetz, C., Collin, G., Mayer, D. and Höke, H. (2014). Hydrocarbons. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a13_227.pub3
