Chlorure de benzyle : production, réactions et utilisations
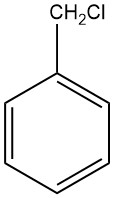
Le chlorure de benzyle est un dérivé du toluène avec substitution chlore dans la chaîne latérale. Il s’agit d’un composé important avec de nombreuses applications industrielles. Il a été synthétisé à l’origine par S. Cannizzaro en 1853 par réaction entre l’alcool benzylique et l’acide chlorhydrique.
Table des matières
1. Propriétés physiques du chlorure de benzyle
Le chlorure de benzyle est un liquide incolore avec une odeur forte et âcre. C’est un puissant lacrymateur, provoquant une irritation intense des yeux et des muqueuses.
Voici quelques propriétés physiques clés du chlorure de benzyle :
| Propriété | Valeur |
|---|---|
| Poids moléculaire (M.) | 126,58 |
| Point d'ébullition à 101,3 kPa | 179,4°C |
| Point de fusion (mp) | -39,2°C |
| Densité (ρ) à 10°C | 1,1188 g/cm³ |
| Densité (ρ) à 20°C | 1,1081 g/cm³ |
| Densité (ρ) à 30°C | 1,1004 g/cm³ |
| Densité (ρ) à 50°C | 1,0870 g/cm³ |
| Densité (ρ) à 87°C | 1,072 g/cm³ |
| Indice de réfraction (n20D) | 1,5389 |
| Viscosité dynamique (η) à 15°C | 1,501 mPa·s |
| Viscosité dynamique (η) à 20°C | 1,38 mPa·s |
| Viscosité dynamique (η) à 25°C | 1,289 mPa·s |
| Viscosité dynamique (η) à 30°C | 1,175 mPa·s |
| Tension superficielle (σ) à 15°C | 38,43 mN/m |
| Tension superficielle (σ) à 20°C | 37,80 mN/m |
| Tension superficielle (σ) à 30°C | 36,63 mN/m |
| Tension superficielle (σ) à 88°C | 29,15 mN/m |
| Tension superficielle (σ) à 17°C | 19,5 mN/m |
| Chaleur spécifique à 0°C | 178 J mol⁻¹ K⁻¹ (1 403 J kg⁻¹ K⁻¹) |
| Chaleur spécifique à 20°C | 181 J mol⁻¹ K⁻¹ (1 432 J kg⁻¹ K⁻¹) |
| Chaleur spécifique à 25°C | 183 J mol⁻¹ K⁻¹ (1 444 J kg⁻¹ K⁻¹) |
| Chaleur spécifique à 50°C | 189 J mol⁻¹ K⁻¹ (1 495 J kg⁻¹ K⁻¹) |
| Chaleur spécifique à 100°C | 212 J mol⁻¹ K⁻¹ (1 675 J kg⁻¹ K⁻¹) |
| Chaleur de Vaporisation à 25°C | 50,1 kJ/mol (396 kJ/kg) |
| Chaleur de combustion à volume constant | 3 708 kJ/mol (29,29 × 10³ kJ/kg) |
| Point éclair | 60°C |
| Température d'inflammation | 585°C |
| Limites d'explosivité dans l'air | Inférieur : 1,1 % en volume, Supérieur : 14 % en volume |
| Limites d'explosivité dans le chlore | Inférieur : environ 6 % en volume, Supérieur : environ 60 % en volume |
| Conductivité spécifique à 20°C | 1,5 × 10⁻⁸ S/cm |
| Pression de vapeur à 0°C | 0,025 kPa |
| Pression de vapeur à 10°C | 0,05 kPa |
| Pression de vapeur à 20°C | 0,12 kPa |
| Pression de vapeur à 30°C | 0,37 kPa |
| Pression de vapeur à 50°C | 0,99 kPa |
| Pression de vapeur à 100°C | 7,96 kPa |
| Pression de vapeur à 130°C | 23,40 kPa |
| Pression de vapeur à 179,4°C | 101,33 kPa |
Le chlorure de benzyle forme divers azéotropes, dont des exemples peuvent être trouvés dans le tableau suivant :
| Composant | point d'ébullition, °C | Chlorure de benzyle, % en poids |
|---|---|---|
| Benzaldéhyde | 178 | 50 |
| Acide hexanoïque | 179 | 95 |
| Acide isovalérique | 171 | 38 |
| Acide valérique | 175 | 25 |
| Acétoacétate d'éthyle | 175 | 35 |
| Acétoacétate de méthyle | 167 | <80 |
| 1,3-Dichloro-2-propanol | 169 | 57 |
| 2,3-Dichloro-2-propanol | 171 | 40 |
| Éthylène glycol | env. 167 | env. 30 |
La solubilité du chlorure de benzyle dans l’eau varie avec la température, étant de 0,33 g/L à 4°C, 0,49 g/L à 20°C et 0,55 g/L à 30°C. Il se dissout facilement dans des solvants tels que le chloroforme, l’acétone, les esters acétiques, l’éther diéthylique et l’éthanol.
La solubilité du chlore dans 100 g de chlorure de benzyle change avec la température, atteignant 8,0 g à 30°C, 5,4 g à 50°C et 2,1 g à 100°C.
2. Réactions chimiques du chlorure de benzyle
Le chlorure de benzyle est une matière première pour la synthèse du chlorure de benzal et du benzotrichlorure par chloration des chaînes latérales. La chloration nucléaire produit des chlorures de chlorobenzyle. Il est oxydé dans une solution aqueuse avec du bichromate de sodium et du carbonate de sodium pour former du benzaldéhyde et de l’acide benzoïque.

Le chlorure de benzyle réagit avec les métaux pour produire différents produits. Par exemple, il réagit avec le magnésium dans l’éther diéthylique pour former du chlorure de benzylmagnésium, un réactif de Grignard. Avec de la poudre de cuivre ou du sodium, il produit du 1,2-diphényléthane comme produit principal de la synthèse Wurtz.
Il réagit avec des catalyseurs acides de Lewis puissants tels que FeCl3, AlCl3 et ZnCl2 pour former des produits d’autocondensation de Friedel – Crafts du type (C7H6)n. Cependant, ces polymères ne sont pas commercialement significatifs malgré leur capacité à contrôler le degré de condensation en modifiant les conditions de réaction.
Il réagit avec le benzène ou le toluène en présence de catalyseurs Friedel-Crafts pour former respectivement du diphénylméthane ou des benzyltoluènes isomères.
Le chlorure de benzyle réagit avec le sulfure d’hydrogène et les métaux alcalins pour produire respectivement du benzylmercaptan et du sulfure de dibenzyle. Sa réaction avec les sels de sodium des acides carboxyliques produit les esters benzyliques correspondants.
Il forme de l’alcool benzylique lorsqu’il est hydrolysé avec de l’eau chaude, mais cette réaction n’est pas utilisée industriellement car l’alcool benzylique formé est reformé en chlorure de benzyle par l’acide chlorhydrique formé au cours du processus. Il favorise également la formation d’éther dibenzylique. Cependant, l’hydrolyse en présence d’alcali donne de l’alcool benzylique.
Le chlorure de benzyle réagit avec le cyanure de sodium pour produire du phénylacétonitrile (cyanure de benzyle). Lorsqu’il réagit avec de l’ammoniac ou des amines, il donne des amines primaires, secondaires et tertiaires et des sels d’ammonium quaternaire.
La réaction avec l’hexaméthylènetétramine produit du benzaldéhyde, connue sous le nom de réaction de Sommelet.
3. Production de chlorure de benzyle

3.1. Mécanisme de réaction
Le processus de chloration du toluène implique deux mécanismes distincts : les mécanismes de chaîne radicalaire et les mécanismes polaires électrophiles. Le mécanisme en chaîne radicale comprend plusieurs étapes : 1. Initiation en chaîne :- Le chlore gazeux (Cl2) est initié par l’énergie lumineuse (hν), produisant deux radicaux chlore (2 Cl•).
- Les radicaux chlore (Cl•) réagissent avec la chaîne latérale aliphatique (RH), formant un radical méthyle (R•) et du chlorure d’hydrogène (HCl).
- Les radicaux méthyle (R•) réagissent alors avec davantage de chlore (Cl2), produisant du chlorure de méthyle (RCl) et davantage de radicaux chlorés (Cl•).
- Les radicaux chlore (Cl•) peuvent terminer la chaîne en se combinant pour former du chlore gazeux (Cl2).
- Les radicaux méthyle (R•) peuvent également terminer la chaîne en réagissant les uns avec les autres pour former des composés diméthyles (RR).
- Concentration optimale de radicaux : Maintenir une concentration idéale de radicaux.
- Éliminer les effets électrophiles : supprimer les composants susceptibles d’introduire des réactions électrophiles.
- Prévenir la terminaison de la chaîne : éliminez les substances qui peuvent mettre fin prématurément aux chaînes radicalaires.
- Évitez les réactions secondaires : minimisez les conditions qui conduisent à des réactions indésirables.
- Favoriser les réactions radicales : prenez des précautions qui favorisent les réactions radicales par rapport aux réactions électrophiles.
3.2. Processus de production
Pour produire du chlorure de benzyle avec une production minimale de produits secondaires comme le chlorure de benzal et le benzotrichlorure, une approche consiste à limiter la chloration à seulement 30 à 40 % de l’apport de toluène, puis à séparer le mélange résultant par fractionnement. Une autre méthode consiste à utiliser des sulfures d’alkyle ou d’aryle comme initiateurs de chaîne radicalaire pour monochlorer la chaîne latérale sans avoir besoin de lumière UV. Dans les processus industriels modernes, le chlorure de benzyle est produit via la chloration de la chaîne latérale du toluène dans des photoréacteurs à boucle continue en acier ou en verre revêtus de verre. Les anciennes méthodes utilisant des colonnes de réaction recouvertes d’argent, de plomb ou de nickel ont été abandonnées en raison de problèmes de corrosion. Dans le processus continu, la chloration est généralement limitée à 20 à 40 % de l’apport de toluène afin de minimiser la formation de sous-produits plus chlorés. Le mélange résultant, contenant encore une quantité importante de toluène et généralement 0,5 à 2 % de chlorure de benzal, est distillé. Pendant la distillation, les produits à point d’ébullition élevé sont séparés pour une purification plus poussée, et le toluène est recyclé vers le réacteur. La spectroscopie proche infrarouge en ligne est utilisée pour surveiller la composition du mélange réactionnel dans les réacteurs de chloration et les unités de distillation, permettant un contrôle efficace des alimentations en toluène et en chlore dans le processus continu. Cependant, le principal inconvénient de cette méthode est le coût élevé associé aux procédés de distillation en raison de la quantité importante de toluène recyclé. Une configuration d’usine typique pour la production continue de chlorure de benzyle est illustrée à la figure 1.
Le toluène frais entre dans le préchlorateur (R0) puis traverse une cascade de quatre photoréacteurs supplémentaires (R1-R4), alimentés en chlore en quantités mesurées avec précision, avec des niveaux de chlore décroissants d’un réacteur à l’autre.
Généralement, le dernier réacteur de la cascade est purgé avec de l’azote pur pour éliminer le chlore gazeux dissous du mélange réactionnel avant purification. Lors de la distillation brute ultérieure (C1), le toluène n’ayant pas réagi est éliminé, laissant le chlorure de benzyle (avec de petites quantités de chlorure de benzal) dans le puisard de distillation.
Le produit brut chloré est dirigé vers l’unité de distillation fine (C2) pour une purification ultérieure afin d’atteindre la qualité finale. Le produit restant du puisard est un mélange de chlorures de benzyle et de benzal, adapté au recyclage dans la production de chlorure de benzal ou de trichlorure de benzo.
Les gaz d’échappement combinés des réacteurs sont renvoyés vers le préchlorateur (R0), où le chlore résiduel réagit avec le toluène frais ou recyclé.
Les gaz d’échappement sans chlore, principalement composés de chlorure d’hydrogène et d’azote, sont traités dans un système d’épuration où le HCl est absorbé par l’eau, produisant de l’acide chlorhydrique concentré de qualité technique.
Alternativement, le chlorure de benzyle pur peut être produit par chloration en phase vapeur dans des réacteurs spécialisés, maintenant la température au point d’alimentation en chlore dans la plage des points d’ébullition du toluène et du chlorure de benzyle.
Dans ces conditions, le chlorure de benzyle est rapidement condensé et collecté, tandis que le chlorure d’hydrogène sort par la tête et que le toluène est liquéfié et recyclé. Le réacteur fonctionne en continu et le produit de queue est généralement constitué de 0,9 % de toluène, 93,6 % de chlorure de benzyle et 5,5 % de résidu de distillation.
Cette méthode comporte des risques inhérents, notamment la température d’inflammation du toluène dans le chlore gazeux (185°C) et la nature explosive des mélanges toluène-chlore et chlorure de benzyle-chlore sur une large gamme de concentrations.
Une autre approche pour produire du chlorure de benzyle implique la chlorométhylation du benzène, bien que cette méthode manque de signification commerciale.
4. Utilisations du chlorure de benzyle
Le chlorure de benzyle est utilisé pour produire de l’alcool benzylique, du phtalate de benzyle et de butyle, de l’acide phénylacétique et des sels d’ammonium quaternaire. Il est également utilisé pour produire des esters benzyliques, des colorants triphénylméthane, du disulfure de dibenzyle, du benzylphénol et de la benzylamine.
L’alcool benzylique est utilisé comme solvant, parfum et antiseptique. Le phtalate de benzyle et de butyle est un plastifiant utilisé dans le chlorure de polyvinyle (PVC). L’acide phénylacétique est utilisé pour produire de la pénicilline synthétique. Les sels d’ammonium quaternaire sont utilisés comme désinfectants et catalyseurs de transfert de phase.
Les esters benzyliques sont utilisés dans l’industrie des arômes et des parfums. Les colorants triphénylméthane sont utilisés comme colorants et pigments. Le disulfure de dibenzyle est un antioxydant utilisé dans les lubrifiants. Le benzylphénol est utilisé comme stabilisant pour les polymères. Les benzylamines sont utilisées comme produits pharmaceutiques et intermédiaires dans la production d’autres produits chimiques.
5. Toxicologie du chlorure de benzyle
La toxicité orale aiguë du chlorure de benzyle chez le rat est de 1 230 mg/kg et chez la souris, de 1 620 mg/kg. Cependant, le dossier d’enregistrement REACH suggère une valeur DL50 inférieure de 560 mg/kg chez le rat. Lorsqu’elle est administrée par voie sous-cutanée dans une solution huileuse, la DL50 chez le rat est de 1 000 mg/kg.
L’exposition au chlorure de benzyle à des concentrations de 100 à 1 000 mg/m3 pendant 2 heures chez le rat et la souris a entraîné une irritation des muqueuses et une conjonctivite.
Dans une étude subchronique à doses répétées impliquant des rats, une gastrite aiguë et chronique sévère du préestomac, souvent accompagnée d’ulcères, ainsi qu’une nécrose aiguë du myocarde et un œdème du cœur, ont été les principales causes de décès.
Le chlorure de benzyle est connu pour être un puissant agent sensibilisant cutané chez les cobayes et présente de faibles propriétés mutagènes.
Dans des expériences chez le rat, des injections sous-cutanées de doses hebdomadaires de 80 mg/kg pendant un an, suivies d’une période de post-observation, ont conduit au développement de sarcomes locaux avec métastases pulmonaires. Le temps d’induction moyen de ces tumeurs était de 500 jours.
L’application cutanée de chlorure de benzyle chez la souris a entraîné l’observation de carcinomes cutanés.
Une étude ultérieure sur la cancérogénicité du chlorure de benzyle administré dans l’huile de maïs a révélé une augmentation statistiquement significative des tumeurs des cellules C de la thyroïde chez les rats femelles et de divers types de tumeurs, notamment l’hémangiosarcome, le carcinome du pré-estomac et le carcinome alvéolaire-bronchiolaire du poumon chez la souris, à une dose -manière dépendante.
Le chlorure de benzyle est facilement absorbé par les poumons et le tractus gastro-intestinal. Après administration orale, il entraîne l’excrétion de divers composés dans l’urine, notamment la N-acétyl-S-benzylcystéine, l’alcool benzylique, le benzaldéhyde et l’acide benzoïque.
Pour l’homme, l’exposition à une concentration de 16 ppm de chlorure de benzyle dans l’air est considérée comme intolérable en une minute seulement. C’est un puissant lacrymateur, provoquant une forte irritation des yeux, du nez et de la gorge, et pouvant potentiellement provoquer un œdème pulmonaire.
Bien qu’il existe des preuves limitées concernant la cancérogénicité des toluènes α-chlorés et du chlorure de benzoyle chez l’homme, sur la base des données disponibles et de preuves suffisantes d’effets cancérigènes chez les animaux, le chlorure de benzyle est classé comme probablement cancérogène pour l’homme selon divers systèmes de classification, y compris le SGH ( catégorie 1B), CIRC (catégorie 2A) et classification MAK (catégorie 2).
Référence
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
