Chloroacétaldéhyde : propriétés, production et utilisations

Le chloroacétaldéhyde [107-20-0], également connu sous le nom de 2-chloroéthanal, est un composé organique liquide incolore de formule CH2ClCHO. Il a été produit pour la première fois sous forme pure par K. Natterer en 1882 en chauffant du diéthylacétal de chloroacétaldéhyde avec de l’acide oxalique anhydre à 100-150°. C.
Table des matières
1. Propriétés physiques du chloroacétaldéhyde
1.1. Chloroacétaldéhyde anhydre
Le chloroacétaldéhyde anhydre est un liquide incolore et mobile avec une odeur âcre qui possède les propriétés physiques suivantes :
- Poids moléculaire : 78,50 g/mol
- Point d’ébullition : 85–85,5°C (99,7 kPa)
- Enthalpie de formation : -256,4 kJ/mol
- Enthalpie de combustion : -981,4 kJ/mol (101,3 kPa, 20°C)
- Moment dipolaire : 1,99 D (298 K, benzène)
- Soluble dans l’eau (formation d’hydrates) et les solvants organiques courants
- Coefficient de partage octanol-eau : 0,16 (très faible)
1.2. Monochloroacétaldéhyde hémihydraté
- Formule : CH2ClCH(OH)2OCH(OH)CH2Cl (1,1′-dihydroxy-2,2′-dichlorodiéthyléther)
- Poids moléculaire : 175,01 g/mol
- Cristaux incolores avec point de fusion compris entre 43 et 50 °C (déshydratation)
- Se décompose au point d’ébullition (84 °C)
- Soluble dans l’eau, l’éthanol, l’éther, le benzène, le dichlorométhane et le chloroforme.
- Numéros CAS [34789-09-8] (« acétaldéhyde chloro dimère hydraté ») et [7737-02-2] (« 1,1′-oxybis( 2-chloroéthanol) ») font référence au même composé.
- Forme un mélange azéotropique avec l’eau, indissociable par simple distillation.
- Point d’éclair : 60°C
- Point d’inflammation : 405°C
- Limites d’explosivité dans l’air (20°C, 101,3 kPa) : inférieures à 305 g/m³
| Température (°C) | Solubilité (% en poids) |
|---|---|
| 1 | 13h35 |
| 10 | 22.2 |
| 20 | 44.3 |
| 30 | 62,7 |
| 40 | 81,5 |
| Concentration (% en poids) | Densité (g/cm³) |
|---|---|
| 10 | 1.041 |
| 20 | 1.085 |
| 30 | 1.137 |
| 40 | 1.188 |
| 50 | 1.238 |
| 60 | 1.290 |
| 72,5 | 1,355 |
2. Propriétés chimiques du chloroacétaldéhyde
Le chloroacétaldéhyde est très réactif en raison des groupes aldéhyde et chlorométhyle. Ses hydrogènes α et son chlore sont activés, facilitant les substitutions nucléophiles et les réactions typiques des aldéhydes (addition, condensation).
2.1. Réactions du groupe aldéhyde
L’autocondensation du chloroacétaldéhyde à température ambiante forme des trimères cycliques, des tétramères et des polymères de polyoxyméthylène. Il existe également des cotrimères et des copolymères avec l’acétaldéhyde. La structure hémihydratée du 1,1′-dihydroxy-2,2′-dichlorodiéthyléther réagit de la même manière qu’un aldéhyde.
L’adduit de bisulfite de sodium et les acétals de diméthyle/diéthyle sont des dérivés importants du chloroacétaldéhyde utilisés comme précurseurs pharmaceutiques et de pesticides.
L’oxydation du chloroacétaldéhyde avec des sels d’air/cobalt, du peroxyde d’hydrogène ou de l’acide nitrique donne de l’acide monochloroacétique.

La condensation aldolique en milieu alcalin produit du 2,4-dichloroacétaldol et la coaldolisation avec de l’acétaldéhyde forme du 2-chlorocrotonaldéhyde, qui est également un sous-produit de la production d’acétaldéhyde.
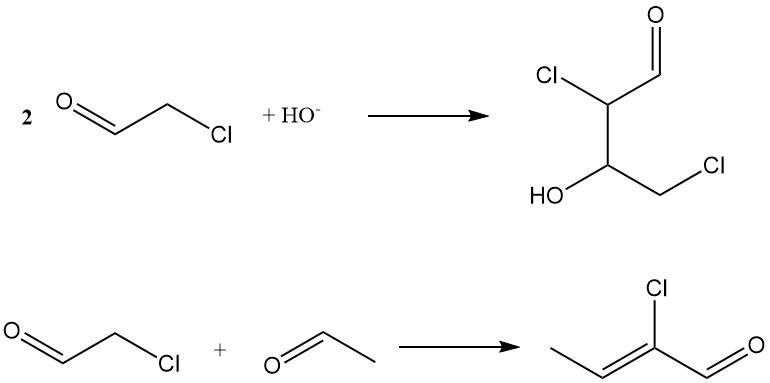
D’autres réactions incluent la formation d’ammoniac aldéhyde, de cyanhydrine et de chloroacétate de 2-chloroéthyle (réaction de Tishchenko).
2.2. Réactions de l’atome de chlore
L’hydrogénation du chloroacétaldéhyde dans une solution aqueuse avec un catalyseur palladium-carbone élimine le chlore. Divers nucléophiles peuvent remplacer le chlore.
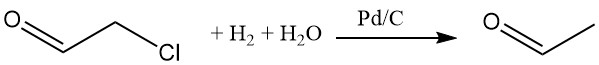
Le chloroacétaldéhyde réagit avec le mercaptan de sodium pour produire du mercaptoacétaldéhyde, qui est utilisé comme intermédiaire dans la synthèse des thiénodiazépines, des colorants azoïques, de la d-l-cystéine et de certains arômes alimentaires.

Les composés aminés peuvent remplacer l’atome de chlore du chloroacétaldéhyde sous forme acétal (éviter les réactions avec le groupe aldéhyde). Ces intermédiaires sont utilisés dans la synthèse de pesticides et de produits pharmaceutiques.

Le diméthylacétal de chloroacétaldéhyde réagit avec le méthylate de sodium pour former du 1,1,2-triméthoxyéthane (un intermédiaire pharmaceutique).

2.3. Réactions combinées
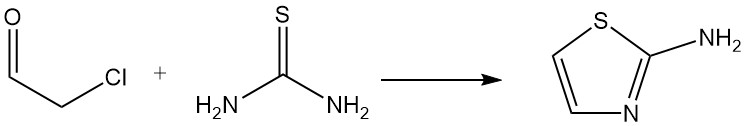
Le chloroacétaldéhyde (hémihydrate ou acétal) est une matière première importante pour la synthèse d’hétérocycles ; un exemple est la réaction avec la thiourée pour former du 2-aminothiazole, qui est utilisé dans la production de produits pharmaceutiques et de colorants.
La cyclocondensation avec l’acétoacétate de méthyle donne le 2-méthyl-3-carbométhoxyfurane (un désinfectant pour les graines).
La réaction du chloroacétaldéhyde avec la carboéthoxyhydrazine, suivie d’une cyclisation avec du chlorure de thionyle, produit du 5-chlorothiadiazole, un défoliant du coton et un régulateur de croissance des plantes.
Les stilbènes sont formés par des réactions avec des hydrocarbures aromatiques, des phénols ou des éthers de phénol. Les phosphates de vinyldialkyle sont produits par la réaction de Perkow avec des phosphites de trialkyle. Le 1,1,2-triacétoxyéthane (précurseur de la d,l-sérine) est préparé en faisant réagir du chloroacétaldéhyde avec de l’acétate de sodium et anhydride acétique.
2.4. Polymères de chloroacétaldéhyde
1. Trichloroparaldéhyde (C6H9Cl3O3)
- Propriétés : cristaux incolores, point de fusion 88–89 °C, point d’ébullition 140–144 °C, solubles dans les solvants organiques courants.
- Formation :
- Réaction de l’acide sulfurique concentré avec le chloroacétaldéhyde hémihydraté.
- Résidus de la distillation azéotropique de l’hémihydrate de chloroacétaldéhyde.
- Décomposition du nitrate de 1,2-dichloroéthyle en présence d’acides de Lewis.
Il est converti en chloroacétaldéhyde par chauffage avec des acides.
2. Tétrachlorométaldéhyde (C8H12Cl4O4)
- Propriétés : cristaux incolores, point de fusion 65–67 °C, point d’ébullition 127–130 °C.
- Formation : Résidu de déshydratation azéotropique de l’hémihydrate de chloroacétaldéhyde.
3. Polychloroacétaldéhydes (C2H3ClO)n
- Propriétés : produits élastomères amorphes à structure polyacétale. Formes cristallines disponibles à des températures plus basses avec des catalyseurs spécifiques.
- Formation : polymérisation du chloroacétaldéhyde anhydre entre -40 et -78°C, notamment avec les acides de Lewis.
3. Production de chloroacétaldéhyde

Le chloroacétaldéhyde est produit par la réaction de l’acétaldéhyde ou du paraldéhyde avec du chlore, avec du dichloroacétaldéhyde et du trichloroacétaldéhyde comme impuretés. Ces produits forestiers sont également obtenus comme sous-produits du procédé Wacker pour la production d’acétaldéhyde.
Une autre méthode de production est la chloration du chlorure de vinyle dans l’eau à 20 °C, qui donne un rendement en chloroacétaldéhyde proche de 100 % si sa concentration dans le milieu réactionnel reste inférieure à 5 %. Des concentrations plus élevées favorisent la formation de 1,1,2-trichloroéthane.
La réaction du chlore avec l’acétate de vinyle dans l’eau à température ambiante forme une solution concentrée de chloroacétaldéhyde, qui peut être distillée pour produire le composé pur. Les produits secondaires sont des quantités mineures d’acétaldéhydes chlorés, d’acétaldéhyde et de produits de condensation.
La synthèse d’acétals de chloroacétaldéhyde avec des rendements et une pureté élevés est obtenue en effectuant les réactions ci-dessus dans des alcools.
La production de chloroacétaldéhyde anhydre par chloration d’acétaldéhyde sec ou de paraldéhyde donne un faible rendement. Cependant, la déshydratation azéotropique de l’hémihydrate avec du chloroforme, du toluène ou du tétrachlorure de carbone suivie d’une distillation sur un déshydrateur l’agent offre de meilleurs résultats.
Le chloroacétaldéhyde anhydre est obtenu avec des rendements élevés par dépolymérisation du trichloroparaldéhyde ou du polychloroacétaldéhyde à 145°C avec de l’acide oxalique ou l’acide trichloroacétique. La pyrolyse du carbonate de chloroéthylène en présence de sels d’ammonium quaternaire donne également le même résultat.
4. Utilisations du chloroacétaldéhyde
Le chloroacétaldéhyde est utilisé comme élément de base dans la production d’intermédiaires pour les statines, qui abaissent le taux de cholestérol, et pour les médicaments anti-SIDA. Le dérivé mercapto, le 2,5-dihydroxy-1,4-dithiane, est utilisé dans la synthèse de médicaments contre le VIH/SIDA.
Le chloroacétaldéhyde est également utilisé dans la synthèse de divers colorants. Ses dérivés dialkylacétals, comme le diméthylacétal de chloroacétaldéhyde, sont des matières premières importantes pour la production de produits chimiques agricoles et ses acétals sont utilisés dans la production de parfums.
Il peut former des polymères qui ne sont pas commercialement importants.
5. Toxicologie du chloroacétaldéhyde
Toxicité aiguë :
- Très toxique par inhalation, provoquant une mort rapide ou retardée chez les animaux. Les valeurs de dose mortelle (DL50) sont :
- Rat (oral) : 89 mg/kg
- Lapin (cutané) : 267 mg/kg
- Rat (inhalation, 1h) : 650 mg/m³
- Irritant pour la peau et les yeux, même à faible concentration (solution à 0,03 %).
- N’est pas un sensibilisant cutané chez les cobayes.
Toxicité chronique :
- Aucun signe de toxicité n’a été observé dans les études d’inhalation chronique inférieures à 5,2 mg/m³.
- Mutagène dans divers organismes et cellules humaines.
- Aucune augmentation des tumeurs cutanées n’a été observée dans les études sur la souris.
- Des tumeurs du foie ont été observées chez des souris mâles buvant de l’eau contenant 0,1 g/L de chloroacétaldéhyde.
Exposition humaine :
- Le chloroacétaldéhyde est un irritant pour la peau, les muqueuses et les voies respiratoires.
- Il provoque des cloques ressemblant à des brûlures et des lésions tissulaires au contact de la peau.
- Larmoiement et irritation nasale à une exposition à l’air de 32,6 mg/m³.
Recommandations :
- TLV-STEL (USA) : 1 ppm (concentration maximale autorisée dans l’air).
- Classification UE : « Très toxique » et « Dangereux pour l’environnement ».
- Nécessite un équipement de protection individuelle complet (lunettes, gants et masque).
Référence
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
