Alcool benzylique : production, réactions et utilisations
L’alcool benzylique est l’alcool aromatique industriel le plus simple et le plus important. Il a été préparé pour la première fois à partir d’huile d’amande amère par Liebig et Wohler en 1832. Cannizzaro a déterminé sa structure en 1853 à l’aide de sa réaction, dans laquelle le benzaldéhyde est disproportionné en acide benzoïque et en alcool benzylique par un alcali.
L’alcool benzylique est présent naturellement à la fois libre et sous forme d’esters, tels que les esters d’acide acétique, benzoïque, salicylique et cinnamique. On le trouve dans les baumes du Pérou et de Tolu, les huiles de jacinthe et de giroflée, l’huile d’ylang-ylang et d’autres huiles essentielles. Il est également présent sous forme de glucoside dans le maïs.
Table des matières
1. Propriétés physiques de l’alcool benzylique
L’alcool benzylique est un liquide incolore avec une légère odeur aromatique et un effet légèrement irritant sur les muqueuses. Il est missible avec de nombreux solvants organiques.
Le tableau suivant présente certaines des propriétés physiques de l’alcool benzylique :
| Propriété | Valeur |
|---|---|
| Formule moléculaire | C7H8O |
| Poids moléculaire | 108,14 g/mol |
| Point d'ébullition | 205,4 °C à 101,3 kPa |
| Point de fusion | -15,4 °C |
| Indice de réfraction | 1,5400 |
| Densité | 1,061 g/cm³ à 0 °C |
| Chaleur spécifique | 1 972 J/kg·K à 20 °C |
| Chaleur de fusion | 82,9 J/g |
| Chaleur de vaporisation | 467,0 J/g à 205,4 °C |
| Enthalpie de combustion standard | 34,58 kJ/g |
| Point d'éclair | 101 °C |
| Température d'auto-inflammation | 435 °C |
| Limite inférieure d'explosivité | 1,3 % en volume à 170 °C et 101,3 kPa |
| Limite supérieure d'explosivité | 13,0 % en volume |
| Solubilité dans l'eau | 4,0 g/100 g à 20 °C |
| Solubilité de l'eau dans l'alcool benzylique | 5,1 g/100 g à 20 °C |
| Viscosité dynamique | 5,584×10⁻³ Pa.s à 20 °C |
| Tension superficielle | 39,96×10⁻³ N/m à 20 °C |
| Moment dipolaire | 5,571×10⁻³⁰ C·m (1,67 D) |
| Constante diélectrique relative | 11.92 à 30 °C |
| Constante diélectrique relative | 9,81 à 60 °C |
2. Réactions chimiques de l’alcool benzylique
Les propriétés uniques de l’alcool benzylique sont principalement dues à son groupe hydroxyle, qui se comporte comme celui des alcools aliphatiques. Cependant, sa proximité avec le noyau aromatique le rend plus réactif. L’alcool benzylique est moins acide que les crésols isomères, il ne se dissout donc pas complètement dans les alcalis aqueux.
Lorsqu’il est chauffé avec des agents déshydratants comme l’oxyde d’aluminium, l’alcool benzylique produit divers composés, notamment l’éther dibenzylique, le toluène et le benzaldéhyde. L’éther dibenzylique peut également être formé en faisant réagir de l’alcool benzylique avec des halogénures d’alkyle en présence de bis(acétylacétonato)nickel comme catalyseur.

L’oxydation de l’alcool benzylique donne du benzaldéhyde ou de l’acide benzoïque, selon l’agent oxydant et les conditions de réaction. Par exemple, l’acide nitrique oxyde l’alcool benzylique en benzaldéhyde, tandis que le permanganate de sodium solide monohydraté l’oxyde en acide benzoïque.
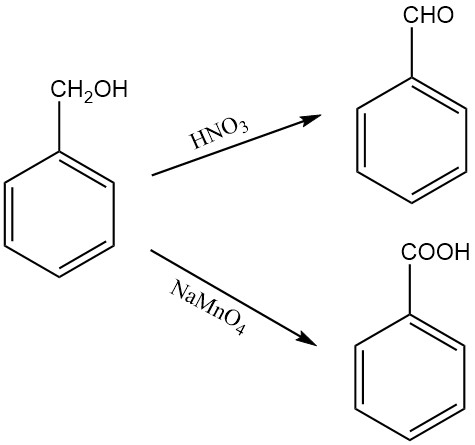
L’alcool benzylique peut également être oxydé en benzaldéhyde dans les conditions d’oxydation d’Oppenauer, en utilisant le furfural comme accepteur d’hydrogène. L’exposition à l’air peut progressivement oxyder l’alcool benzylique en benzaldéhyde.
La déshydrogénation de l’alcool benzylique en phase gazeuse, à l’aide de catalyseurs à base de cuivre ou de métaux nobles, produit également du benzaldéhyde comme produit principal.
L’hydrogénation de l’alcool benzylique dans différentes conditions peut produire divers produits, notamment le toluène, le benzène, le méthylcyclohexane, le cyclohexane et l’hydroxyméthylcyclohexane. L’alcool benzylique réagit également avec les halogénures d’hydrogène pour former les halogénures de benzyle correspondants.

De plus, l’alcool benzylique peut être converti en chlorure de benzoyle lors de la chloration des chaînes latérales des composés aromatiques. Il peut également être converti en diverses alkylamines lorsqu’il réagit avec de l’ammoniac ou des amines.
Les catalyseurs Friedel-Crafts peuvent être utilisés pour alkyler l’alcool benzylique. Par exemple, la réaction de l’alcool benzylique avec le benzène donne du diphénylméthane, tandis que sa réaction avec le phénol donne un mélange de 2- et 4-benzylphénols.
L’alcool benzylique réagit avec les acides organiques et inorganiques, les halogénures d’acide ou les anhydrides d’acide pour former des esters. Les réactions catalysées par l’acide avec les aldéhydes donnent des acétals. De plus, la réaction de l’alcool benzylique avec le monoxyde de carbone en présence de catalyseurs carbonylés donne de l’acide phénylacétique.
Le traitement de l’alcool benzylique avec certains catalyseurs, tels que le chlorure d’aluminium anhydre ou le chlorure de zinc, élimine l’eau pour produire des produits résineux. Même de petites quantités de bromure d’hydrogène et de fer (II) peuvent initier une réaction de polycondensation exothermique de l’alcool benzylique à des températures supérieures à 150 °C.
Cette réaction peut augmenter la température jusqu’à 240 °C et provoquer une brusque poussée de pression dans un récipient fermé. Par conséquent, il est recommandé de ne pas chauffer l’alcool benzylique au-dessus de 100 °C, sauf s’il est exempt d’impuretés acides et de fer dissous.
3. Production d’alcool benzylique
Il n’existe que deux méthodes industriellement importantes pour produire de l’alcool benzylique :
- Hydrolyse du chlorure de benzyle
- Hydrogénation du benzaldéhyde
3.1. Production d’alcool benzylique par hydrolyse du chlorure de benzyle

L’hydrolyse du chlorure de benzyle est une réaction réversible qui peut être rendue presque quantitative en présence d’agents saponifiants basiques qui neutralisent l’acide chlorhydrique produit comme sous-produit.
La réaction est généralement réalisée en chauffant du chlorure de benzyle avec un excès d’une solution aqueuse d’un oxyde, d’un hydroxyde ou d’un carbonate de métal alcalin ou alcalino-terreux. La soude est l’agent saponifiant préféré.
Pour produire de l’alcool benzylique à l’échelle industrielle, la procédure suivante est généralement utilisée :
- 126,5 parties de chlorure de benzyle sont ajoutées à 610 parties d’une solution bouillante de soude à 10 % sous agitation.
- Le mélange réactionnel est chauffé au reflux et agité jusqu’à ce que le dioxyde de carbone ne s’échappe plus (cela prend environ 5 à 6 heures).
- Le mélange réactionnel est refroidi et la couche supérieure, constituée d’alcool benzylique brut, est éliminée.
- La solution de chlorure de sodium ci-dessous est extraite avec un solvant organique comme le benzène ou le toluène pour récupérer tout alcool benzylique dissous.
- L’alcool benzylique brut est purifié par distillation fractionnée sous pression réduite pour obtenir un produit pur.
Le rendement en alcool benzylique de ce procédé est de 67 % et pour l’éther dibenzylique est de 8 %.
Pour réduire le temps de réaction, le résidu final de chlorure de benzyle peut être hydrolysé avec une solution d’hydroxyde de sodium après 3 heures de saponification avec une solution de soude. Cela réduit le temps total de saponification à 4 heures.
Le pourcentage d’éther dibenzylique formé dans la réaction peut être réduit en utilisant un solvant inerte, tel que le benzène, le toluène ou le xylène, ou en hydrolysant le chlorure de benzyle dans un processus continu.
Dans un nouveau procédé continu, le chlorure de benzyle et l’agent saponifiant alcalin réagissent à contre-courant dans un solvant organique inerte dans un réacteur à flux. L’alcool est extrait de la phase aqueuse alcaline par un solvant organique inerte dans une zone d’extraction.
L’alcool benzylique brut est ensuite lavé à l’eau dans une zone de lavage. Le réacteur à flux, la zone d’extraction et la zone de lavage sont intégrés dans un appareil spécial. Ce procédé peut être opéré à de basses températures de réaction (120-150 °C) et avec un léger excès stoechiométrique d’agent saponifiant (5-25 %).
Des procédés en deux étapes pour produire de l’alcool benzylique ont également été développés, mais ils n’ont pas acquis une grande importance commerciale.
3.2. Production d’alcool benzylique par hydrogénation et réduction du benzaldéhyde
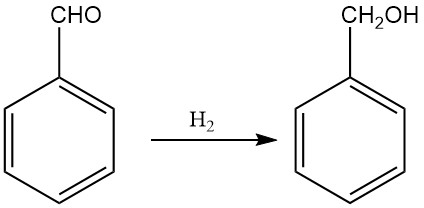
La production industrielle d’alcool benzylique par hydrogénation du benzaldéhyde est devenue importante en raison des grandes quantités de benzaldéhyde disponibles comme sous-produit du procédé Dow pour la production de phénol et du procédé Snia Viscosa pour la production de caprolactame.
Selon les conditions de réaction, le benzaldéhyde peut être hydrogéné pour former divers produits, notamment l’alcool benzylique, le toluène, l’hydroxyméthylcyclohexane et le méthylcyclohexane. Cependant, des rendements élevés en alcool benzylique peuvent être obtenus en ajustant les conditions de réaction et les catalyseurs.
Les catalyseurs appropriés pour l’hydrogénation du benzaldéhyde comprennent :
- Nickel de Raney dopé aux métaux de transition
- Métaux de nickel ou de platine avec des phosphines ou des oxydes de phosphine
- Palladium combiné avec un azote organique, une base alcaline, de l’eau ou un autre métal de transition
Lorsque le benzaldéhyde est hydrogéné à des températures de 70 à 200 °C et à une pression d’hydrogène de 1 à 4 MPa, des rendements élevés en alcool benzylique sont obtenus dans des temps de réaction courts.
Un procédé continu bien connu utilise un catalyseur platine-oxyde d’aluminium-oxyde de lithium pour hydrogéner efficacement et sélectivement le benzaldéhyde en alcool benzylique.
D’autres méthodes utilisant des agents réducteurs tels que le stannane, l’hydrure de sodium, le zinc ou des micro-organismes n’ont aucune importance industrielle.
La réaction de Cannizzaro n’est plus utilisée industriellement pour produire de l’alcool benzylique.
3.3. Production d’alcool benzylique par oxydation du toluène
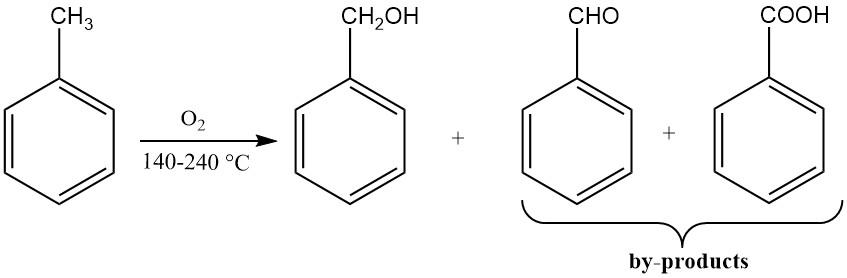
L’oxydation catalytique du toluène donne de faibles rendements en alcool benzylique car les conditions de réaction favorisent une oxydation ultérieure en benzaldéhyde et en acide benzoïque. La plupart des procédés de production d’alcool benzylique utilisant le toluène comme matière première isolent des sous-produits intermédiaires.
Un processus consiste à oxyder le toluène avec de l’air appauvri en oxygène à 170-220 °C et à une pression suffisante pour maintenir le milieu réactionnel liquide. Cette réaction est réalisée en présence de stabilisants des hydroperoxydes organiques, tels que le pyrophosphate de sodium ou le fluorure de sodium.
Si on ne laisse pas plus de 10 % du toluène réagir, le produit principal est l’hydroperoxyde de benzyle. La décomposition ultérieure de l’hydroperoxyde de benzyle à 165 °C en présence de sels de cobalt solubles donne de l’alcool benzylique.
Le benzaldéhyde et l’acide benzoïque sont formés comme sous-produits. L’hydroperoxyde de benzyle peut également être réduit en alcool benzylique à l’aide de sulfites de métaux alcalins.
Un autre processus consiste à oxyder le toluène dans l’air en phase liquide en présence d’acides, de chlorures d’acide ou d’anhydrides d’acide. Cela forme les esters benzyliques de ces acides, qui peuvent ensuite être saponifiés pour former de l’alcool benzylique.
Par exemple, l’oxydation du toluène en présence d’anhydride acétique à 140-240 °C et 1-3 MPa donne de l’acétate de benzyle. L’oxydation est interrompue après réaction de 10 % du toluène. Après saponification du produit d’oxydation, 350 g d’alcool benzylique, 55 g de benzaldéhyde et 67 g d’acide benzoïque peuvent être obtenus à partir de 500 g de toluène ayant réagi.
Les impuretés phénoliques, telles que les crésols, sont inévitablement présentes dans l’alcool benzylique obtenu par oxydation du toluène. Ces impuretés peuvent être éliminées en lavant la vapeur d’alcool benzylique avec un contre-courant d’une solution de benzylate alcalin dans une colonne à plateaux ou une colonne à garnissage.
3.4. Autres procédés de fabrication
L’hydrogénation des esters d’acide benzoïque pour former de l’alcool benzylique est une méthode intéressante lorsque les esters d’acide benzoïque sont produits en grandes quantités, comme dans la production de téréphtalate de diméthyle par le procédé Witten.
Les catalyseurs au cuivre sont préférés pour cette réaction. Les esters d’acide benzoïque peuvent être hydrogénés en alcool benzylique à l’aide d’un catalyseur au cuivre supporté par des oxydes ou des carbonates alcalino-terreux. La sélectivité peut être améliorée en ajoutant du chrome au catalyseur. La réaction est généralement réalisée à des températures de 100 à 300 °C et à des pressions supérieures à 6 MPa.
D’autres catalyseurs pour l’hydrogénation des esters d’acide benzoïque en alcool benzylique comprennent le ruthénium, le rhodium, le platine et le palladium, activés par des arènes de métaux alcalins, des cétyles ou des alcoxydes. Ces catalyseurs permettent d’effectuer la réaction dans des conditions douces avec une sélectivité élevée.
Les procédés en trois étapes pour la production d’alcool benzylique à partir de toluène impliquent généralement l’hydrogénation du benzoate de méthyle en présence d’un catalyseur cuivre-chrome :
- Oxydation du toluène en acide benzoïque
- Estérification avec du méthanol
- Hydrogénation du benzoate de méthyle en alcool benzylique
Ce procédé produit de l’alcool benzylique à un coût très faible.
D’autres procédés, notamment l’hydrogénation ou la réduction électrochimique de l’acide benzoïque, l’hydrolyse de l’acide benzylsulfonique et la décarboxylation du formiate de benzyle, ne sont pas importants pour la production industrielle d’alcool benzylique, mais ils peuvent être utilisés pour produire des dérivés substitués sur le cycle aromatique.
L’alcool benzylique peut également être obtenu à partir du benzoate de benzyle qui est produit comme sous-produit de la fabrication de l’acide benzoïque.
4. Utilisations de l’alcool benzylique
L’alcool benzylique est un bon solvant pour les revêtements de surface, les résines, les esters de cellulose, les éthers, les résines alkydes, les résines acryliques et les graisses. Il est également utilisé dans les encres pour stylos à bille, pour améliorer la fluidité et la brillance des revêtements de surface, et comme auxiliaire dans la teinture de la laine, des polyamides et des polyesters.
Parce qu’il a une légère odeur, il est utilisé comme solvant et agent diluant dans les parfums et les arômes.
L’alcool benzylique est également utilisé comme accélérateur de développement en photographie couleur.
Il est utilisé comme anesthésique local en pharmacie et comme ingrédient dans des pommades et autres préparations en raison de son effet microbicide.
L’alcool benzylique est une matière première pour de nombreux esters benzyliques, qui sont utilisés comme odorants, arômes, stabilisants pour parfums volatils et plastifiants.
Il est également utilisé dans la distillation extractive des m- et p-xylènes et des m- et p-crésols.
Les autres utilisations de l’alcool benzylique comprennent :
- Solvant pour nettoyage et dégraissage
- Additif pour carburant
- Ingrédient d’un produit de soins personnels (par exemple, shampoing, revitalisant, dentifrice)
- Excipient pharmaceutique (par exemple, conservateur, solubilisant)
- Produit chimique agricole (p. ex. acaricide, insecticide)
5. Toxicologie de l’alcool benzylique
L’alcool benzylique est un parfum, un conservateur et un agent antimicrobien polyvalent utilisé dans les produits pharmaceutiques, les savons, les détergents, les cosmétiques et les produits alimentaires. Il est considéré comme « généralement considéré comme sûr » (GRAS) par la Food and Drug Administration des États-Unis, mais les limites d’exposition environnementales ou sur le lieu de travail n’ont pas encore été établies.
L’alcool benzylique est modérément toxique, avec des valeurs orales aiguës de DL50 de 1,2 g/kg chez le rat et de 1,6 g/kg chez la souris. Il peut également être absorbé par la peau en quantités toxiques, avec une DL50 cutanée chez le cobaye inférieure à 5 ml/kg.
L’alcool benzylique n’est pas classé comme cancérigène et il n’existe aucune donnée sur ses effets tératogènes ou sur la reproduction. Cependant, il est important de noter que l’alcool benzylique est hautement toxique pour les nouveau-nés, avec une dose mortelle estimée nettement inférieure à celle des adultes.
L’alcool benzylique est largement utilisé comme conservateur dans les solutions médicamenteuses intraveineuses, mais la prudence est de mise en raison de sa forte toxicité chez les nouveau-nés.
L’alcool benzylique est également très toxique et irritant pour les yeux et peut provoquer une irritation cutanée légère à modérée. Certaines personnes peuvent présenter des réactions d’hypersensibilité à l’alcool benzylique, par voie topique ou parentérale.
Les symptômes d’une intoxication à l’alcool benzylique comprennent des vomissements, de la diarrhée, une dépression du système nerveux central, de l’excitabilité, une paralysie musculaire, des convulsions, une détresse respiratoire et un collapsus.
Pour réduire l’exposition à l’alcool benzylique, il est important d’utiliser des systèmes de ventilation adéquats, un équipement respiratoire autonome, des lunettes, des gants et des vêtements de protection.
Référence
- Benzyl Alcohol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_001
