Acide maléique : propriétés, réactions, production et utilisations
Qu’est-ce que l’acide maléique ?
L’acide maléique, également connu sous le nom d’acide cis-butènedioïque, est un acide dicarboxylique de formule C4H4O4. Il se présente sous la forme d’un solide cristallin incolore avec une légère odeur.
L’acide maléique n’est pas présent dans la nature et a été synthétisé pour la première fois en 1834 en chauffant l’acide malique. L’acide maléique est devenu important sur le plan industriel après le début de la production commerciale en 1919 via l’oxydation catalytique en phase gazeuse du benzène.
L’acide maléique et son anhydride sont devenus disponibles dans le commerce en 1928 et 1933, respectivement. L’acide maléique a des applications industrielles limitées en soi, mais il est utilisé comme précurseur des résines maléinates et des copolyesters.
Table des matières
1. Propriétés physiques de l’acide maléique
L’acide maléique forme des cristaux prismatiques monocliniques lorsqu’il est cristallisé. Il est très soluble dans l’eau et l’éthanol, soluble dans l’acétone et l’acide acétique glacial, légèrement soluble dans l’éther et insoluble dans le benzène.
Le tableau 1 résume les propriétés physiques de l’acide maléique.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [110-16-7] |
| Formule chimique | C4H4O4 |
| Poids moléculaire | 116,07 g/mol |
| Point de fusion | 130,5 °C |
| Densité | 1,590 g/cm3 |
| pKa1 à 25 °C | 1,94 |
| pKa2 à 25 °C | 6,23 |
| Chaleur de formation | -788,3 kJ/mol |
| Chaleur de combustion | -1358,9 kJ/mol |
| Solubilité dans l'eau |
|
| Point d'éclair | 127 °C |
2. Réactions de l’acide maléique
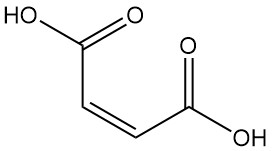
L’acide maléique présente une réactivité élevée en raison de la présence de groupes carboxyles et d’une double liaison. Au-dessus de 100 °C, il est déshydraté par élimination d’eau pour former de l’anhydride maléique. Un chauffage supplémentaire, en particulier avec des catalyseurs, favorise la décarboxylation pour produire de l’acide acrylique.
L’acide maléique participe aux réactions typiques des acides carboxyliques comme l’estérification et l’amidation, mais il est incapable de former du chlorure d’acide.
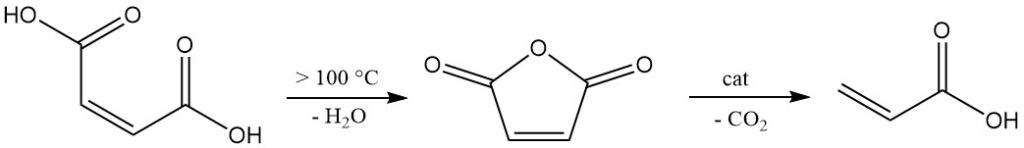
La présence de la double liaison permet diverses réactions, comme l’ajout d’eau à température et pression élevées, ce qui entraîne la formation d’acide malique.
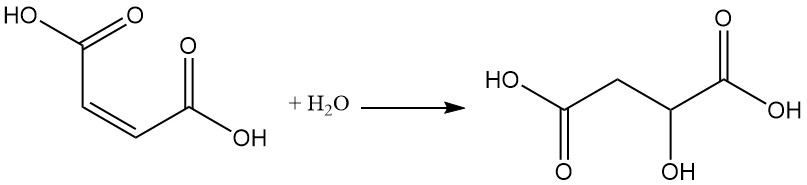
La réaction de l’acide maléique avec l’ozone donne de l’acide glyoxylique.
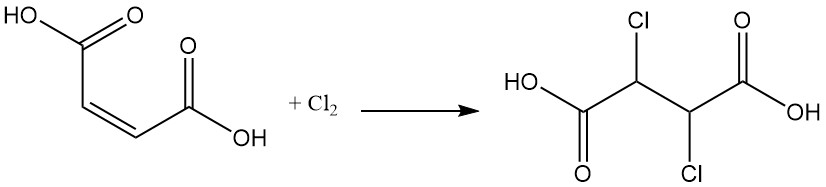
L’addition d’halogène forme des composés d’acide dihalogénosuccinique ; par exemple, l’addition de dichlore à l’acide maléique produit de l’acide dichlorosuccinique.
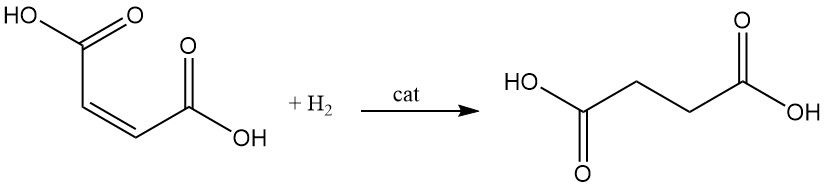
L’hydrogénation catalytique de la double liaison de l’acide maléique conduit à la formation d’acide succinique.
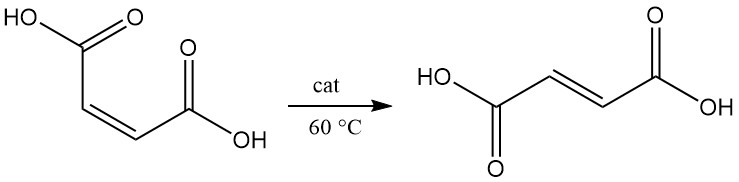
L’isomérisation de l’acide maléique en acide fumarique se produit lentement, même à 100 °C. En présence d’un catalyseur, la conversion se déroule presque quantitativement, même à 60 °C.
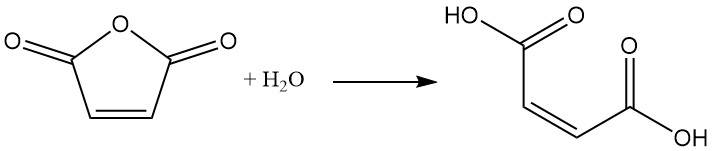
3. Production d’acide maléique
La méthode la plus courante pour produire de l’acide maléique est l’hydratation contrôlée de l’anhydride maléique avec une petite quantité d’eau. Une fois le mélange réactionnel refroidi, le produit, l’acide maléique, précipite sous forme solide.
Le liquide surnageant (liquide mère) est ensuite séparé. L’acide maléique solide est séché sous vide.
La liqueur mère peut être diluée et recyclée vers l’étape d’hydratation pour une production supplémentaire d’acide maléique ou dirigée vers l’unité de déshydratation pour la production d’anhydride maléique, éliminant ainsi la nécessité d’un traitement séparé des effluents. Cependant, cette méthode nécessite un équipement en acier résistant à la corrosion en raison des conditions difficiles.
En alternative, l’acide maléique peut être obtenu directement à partir de l’eau de lavage générée pendant la production d’anhydride maléique. Ce procédé permet d’économiser l’énergie nécessaire à la déshydratation en forme d’anhydride. Cependant, il nécessite la purification et la concentration de l’eau de lavage.
L’eau de lavage doit être traitée avec du charbon actif pour éliminer les impuretés. Le charbon usé est ensuite éliminé. La solution purifiée doit être concentrée sous vide car les températures élevées favorisent la formation d’acide fumarique et l’équipement en acier au chrome-nickel utilisé dans ce procédé se corrode au-dessus de 80 °C.
Les eaux de lavage enrichies issues de procédés d’oxydation tels que l’o-xylène et le naphtalène utilisés dans la production d’anhydride phtalique peuvent également être utilisées comme matière première pour la production d’acide maléique, aux côtés de l’acide fumarique et de l’anhydride maléique.
4. Utilisations de l’acide maléique

L’acide maléique est un composant important dans la production de polyester utilisé pour les moulages stratifiés renforcés de fibres et la peinture des véhicules.
Il est utilisé comme matière première pour la synthèse de nombreux autres produits chimiques.
L’acide maléique peut être converti en acide fumarique, un autre produit chimique industriel précieux.
En raison de ses propriétés acides, il peut être utilisé comme régulateur d’acidité dans certains aliments et boissons.
Il améliore l’adhérence entre divers matériaux, tels que les métaux zingués (acier galvanisé) et le nylon, utilisés avec des adhésifs à base de méthacrylate de méthyle.
L’acide maléique est utilisé dans les processus de teinture et de finition des fibres naturelles.
La forme ionisée (ion maléate) agit comme un inhibiteur des réactions de transaminases dans la recherche biochimique.
L’acide maléique est utilisé comme agent tampon, agent moussant et régulateur de pH dans les produits de nettoyage et les applications d’entretien ménager.
5. Toxicologie de l’acide maléique
La principale préoccupation toxicologique de l’acide maléique est son effet irritant et corrosif local sur la peau, les muqueuses et les yeux. Des études montrent qu’une solution aqueuse à 20 % peut provoquer une irritation cutanée légère et réversible chez l’homme, tandis que des concentrations plus faibles (< 5 %) peuvent irriter considérablement les yeux.
Les expériences sur les animaux confirment que cette action irritante locale est la caractéristique toxicologique la plus importante.
L’acide maléique présente une toxicité orale et cutanée aiguë modérée. Les valeurs DL50 rapportées sont les suivantes :
- 708 mg/kg (rat, voie orale)
- 2 400 mg/kg (souris, voie orale)
- 1 560 mg/kg (lapin, voie cutanée)
- > 1 000 mg/kg (cobaye, voie cutanée)
Les lésions rénales sont un effet toxique systémique potentiel de l’acide maléique. Des modifications morphologiques et fonctionnelles des reins ont été observées chez les rats et les chiens après injection intrapéritonéale et exposition par inhalation.
Ces lésions ressemblent au syndrome de Fanconi, potentiellement causé par l’interaction de l’acide maléique avec le glutathion dans les cellules rénales, entraînant la formation de radicaux libres et de peroxydes. De plus, l’acide maléique semble affecter les mécanismes de transport des ions sodium et hydrogène.
Les études d’exposition chronique chez les rats mâles (250-750 mg/kg/jour pendant deux ans maximum) ont montré une mortalité accrue, des lésions rénales et un retard de croissance dans tous les groupes de dosage. Des lésions hépatiques et testiculaires ont également été observées dans le groupe ayant reçu la dose la plus élevée.
Aucune cancérogénicité ou génotoxicité n’a été mise en évidence dans ces études, bien qu’elles n’aient pas été spécifiquement conçues à cet effet.
Références
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Acid
