Acide lévulinique : propriétés, réactions, production et utilisations
Qu’est-ce que l’acide lévulinique ?
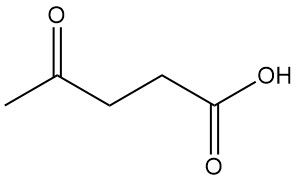
L’acide lévulinique, également connu sous le nom d’acide 4-oxopentanoïque ou acide γ-cétovalérique, est l’acide γ-oxocarboxylique le plus simple et le plus important, de formule C5H8O3. Il s’agit d’un solide cristallin blanc soluble dans l’eau et les solvants organiques polaires.
L’acide lévulinique a été décrit et nommé pour la première fois par Grote et Tollens en 1875, mais ce n’est qu’en 1960 qu’il a acquis une importance commerciale.
Table des matières
1. Propriétés physiques de l’acide lévulinique
L’acide lévulinique forme des cristaux incolores qui sont facilement solubles dans l’eau, l’éthanol et l’éther diéthylique.
Les propriétés physiques importantes de l’acide lévulinique sont indiquées dans le tableau ci-dessous.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [123-76-2] |
| Formule chimique | H3C-CO-CH2-CH2-COOH |
| Masse moléculaire | 116,11 g/mol |
| Point de fusion | 37 °C |
| Point d'ébullition | à (101,31 kPa) : 245–246 °C à (1,33 kPa) : 137–139 °C |
| Densité spécifique (20 °C) | 1,14 |
| Indice de réfraction (25 °C) | 1,4396 g/cm3 |
| pKa | 4,64 (à 18 °C) |
| Point d'éclair | 138 °C |
2. Réactions de l’acide lévulinique
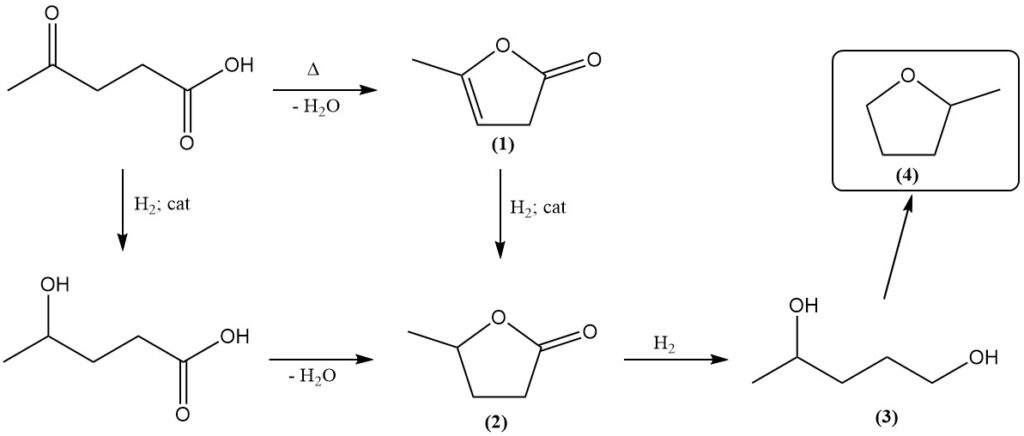
L’acide lévulinique réagit à la fois comme une cétone et comme un acide carboxylique. Un chauffage prolongé induit une déshydratation, donnant de la lactone angélique (1).
L’hydrogénation catalytique transforme l’acide lévulinique en γ-valérolactone (2). Différents catalyseurs, dont l’oxyde de platine, le nickel de Raney, le cuivre-chromite et les systèmes à base de rhénium, ont été utilisés. L’hydrogénation ultérieure donne du 1,4-pentanediol (3), un précurseur du méthyltétrahydrofurane (4).
Les réactions de condensation avec les aldéhydes se produisent aux positions α, β ou δ du carbone, selon les conditions de réaction.
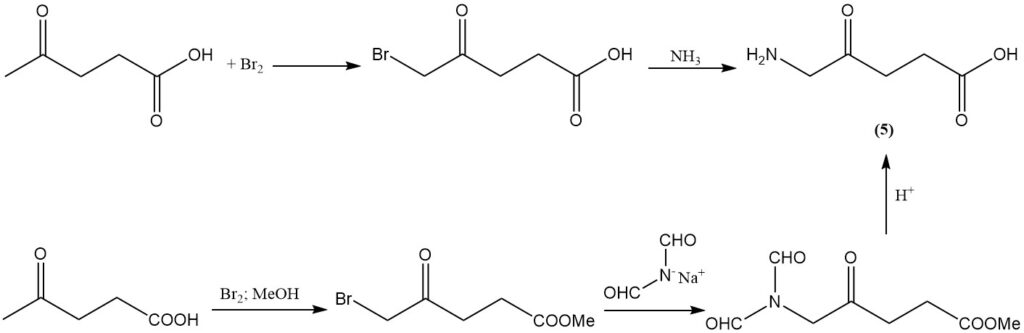
La bromation de l’acide lévulinique avec du brome, suivie d’une amination, produit de l’acide aminolévulinique (5), qui est un herbicide à large spectre d’activité. Cet herbicide peut également être produit avec un rendement élevé par bromation de l’acide lévulinique, suivie d’une réaction avec l’anion diformylamide, puis d’une hydrolyse acide.
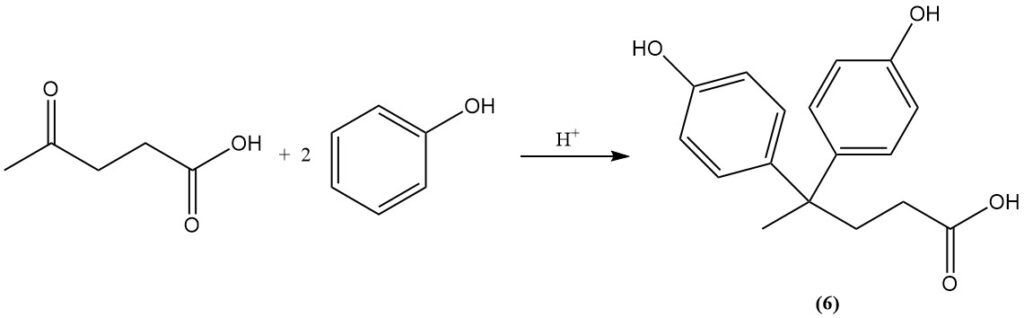
La réaction de l’acide lévulinique avec le phénol donne de l’acide diphénolique (6), qui est un composé utilisé dans la production de polymères.
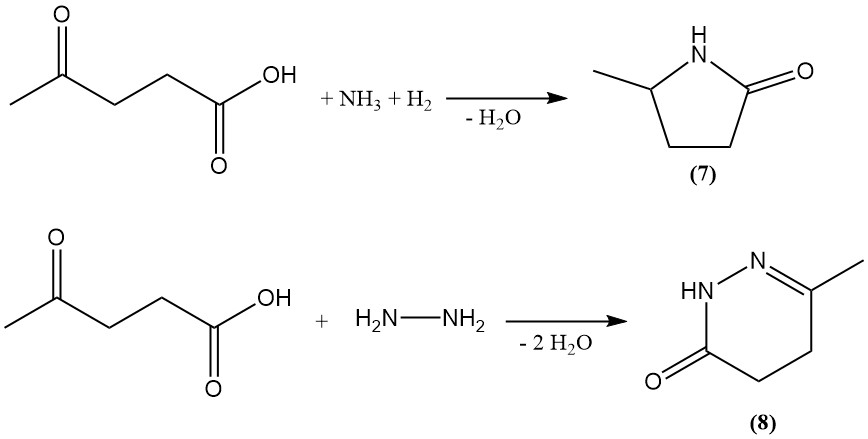
L’acide lévulinique est utilisé comme précurseur pour la synthèse de divers composés hétérocycliques. L’amination réductrice génère la 5-méthyl-2-pyrrolidone (7), tandis que la réaction avec l’hydrazine produit la 6-céto-3-méthyl-1,4,5,6-tétrahydropyridazone (8).
L’acide lévulinique peut réagir avec des alcools pour former des esters, comme le lévulinate d’éthyle, utilisé dans les parfums.
3. Production d’acide lévulinique
L’acide lévulinique est synthétisé industriellement à partir de polymères glucidiques, comme la cellulose ou l’amidon. Ces polymères sont d’abord dépolymérisés en monomères d’hexose, principalement du D-glucose, par hydrolyse acide-catalysée, suivie d’une isomérisation enzymatique du D-glucose en D-fructose.
La déshydratation ultérieure du D-fructose donne de l’hydroxyméthylfurfural, un intermédiaire clé dans la formation de l’acide lévulinique. La synthèse classique utilise la réaction directe du D-fructose avec l’acide chlorhydrique.
Les voies de synthèse alternatives comprennent l’hydrolyse des esters, l’hydrolyse de l’alcool furfurylique, l’oxydation des cétones, la carbonylation des cétones catalysée par le palladium et l’alkylation des nitroalcanes. Cependant, ces méthodes produisent souvent des sous-produits importants ou nécessitent des matières premières coûteuses.
Le procédé Biofine (Figure 1) représente une avancée notable dans la production d’acide lévulinique. Un système de réacteur à deux étages est utilisé pour la synthèse d’acide lévulinique à partir de matières premières glucidiques.
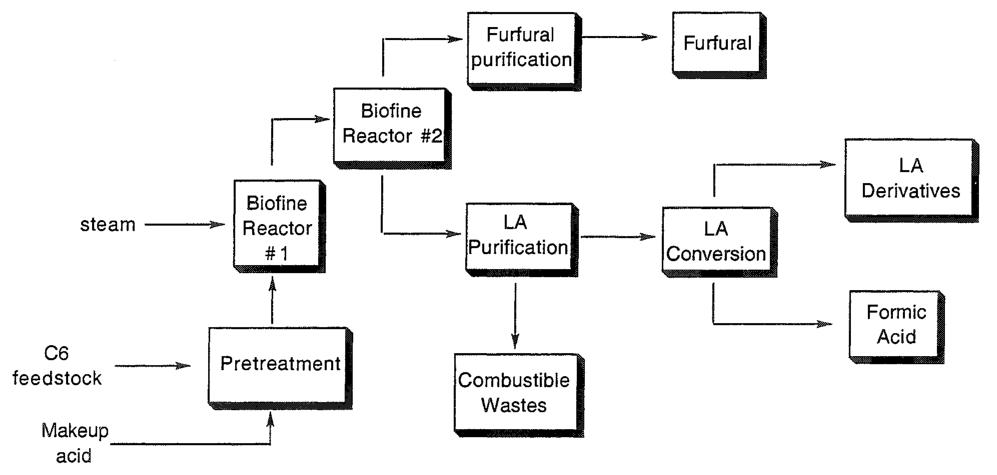
Dans le réacteur initial, l’hydrolyse des glucides se produit à des températures comprises entre 210 et 230 °C pendant une brève période de 13 à 25 secondes en présence d’un catalyseur acide minéral dilué. Cette étape produit de l’hydroxyméthylfurfural, qui est extrait en continu et transféré vers le réacteur suivant.
Dans le deuxième réacteur, l’hydroxyméthylfurfural subit une nouvelle hydrolyse à des températures comprises entre 195 et 215 °C pendant une durée de 15 à 30 minutes. L’acide lévulinique est retiré en continu de ce réacteur.
Le rendement global en acide lévulinique, calculé sur la base de la teneur initiale en hexose de la charge d’alimentation en glucides, est d’environ 60 %. Cette efficacité est particulièrement élevée par rapport aux méthodes précédemment décrites.
Ce procédé offre des rendements élevés, une formation réduite de sous-produits et le potentiel d’une production rentable à partir de divers flux de déchets cellulosiques. Les projections économiques indiquent des économies d’énergie substantielles et une réduction des déchets grâce à la mise en œuvre à grande échelle du procédé Biofine.
L’acide lévulinique peut également être produit à partir de matières premières pétrochimiques. Un procédé breveté utilise l’ozonolyse d’hydrocarbures insaturés pour générer de l’acide lévulinique, même si la réaction est complexe.
4. Utilisations de l’acide lévulinique
L’acide lévulinique est utilisé comme précurseur pour la synthèse de produits pharmaceutiques, de plastifiants et comme auxiliaire dans la galvanoplastie. Il est utilisé dans la production d’acide aminolévulinique (un herbicide biodégradable), de gamma-valérolactone (un solvant, un additif pour carburant et un intermédiaire pour d’autres produits chimiques) et d’acide diphénolique.
Le sel de calcium de l’acide lévulinique est utilisé dans la thérapie au calcium, et les esters d’acide lévulinique sont utilisés dans la production de cosmétiques et de parfums.
5. Toxicologie de l’acide lévulinique
L’acide lévulinique présente une faible toxicité aiguë. La DL50 orale chez le rat est déterminée à 1850 mg/kg. La DL50 cutanée chez le rat est supérieure à 2 000 mg/kg. Les données de toxicité par inhalation ne sont pas disponibles.
L’acide lévulinique est un irritant cutané. Il provoque de graves lésions oculaires. C’est un sensibilisant cutané, comme l’indiquent les résultats positifs des analyses des ganglions lymphatiques locaux.
L’acide lévulinique n’induit pas d’aberrations chromosomiques dans les lymphocytes humains ni de mutations génétiques dans les cellules pulmonaires du hamster chinois in vitro.
Les données disponibles sur la cancérogénicité, la toxicité pour la reproduction et la toxicité spécifique pour certains organes cibles de l’acide lévulinique sont insuffisantes.
L’acide lévulinique ne contient pas de composants identifiés comme des perturbateurs endocriniens, conformément à la réglementation REACH.
Les données sur la toxicité, la persistance et la dégradabilité de l’acide lévulinique dans l’environnement sont limitées.
L’acide lévulinique est nocif en cas d’ingestion, peut provoquer des réactions allergiques cutanées et provoque de graves lésions oculaires.
Références
- Oxocarboxylic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a18_313
- https://pubchem.ncbi.nlm.nih.gov/compound/Levulinic-acid
- https://www.aceee.org/files/proceedings/1999/data/papers/SS99_Panel1_Paper60.pdf
- https://www.merckmillipore.com/INTL/en/product/msds/MDA_CHEM-814254
