Acide gallique : propriétés, réactions, production et utilisations
Qu’est-ce que l’acide gallique ?
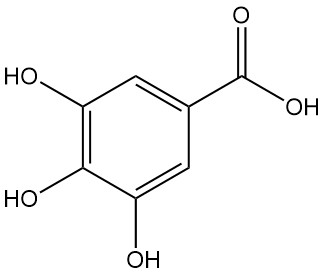
L’acide gallique, également connu sous le nom d’acide 3,4,5-trihydroxybenzoïque, est un acide hydroxyaromatique de formule chimique C7H6O5. C’est un solide blanc, mais il apparaît souvent brun en raison de l’oxydation et il est soluble dans l’alcool et les solvants polaires. Il a été découvert par Carl Wilhelm Scheele en 1786.
L’acide gallique se trouve dans les feuilles de busserole, dans l’écorce de racine de grenade, dans les noix de galle, dans l’hamamélis, dans le sumac, dans les feuilles de thé, dans l’écorce de chêne et dans de nombreuses autres plantes, à la fois à l’état libre et dans le cadre de la molécule de tanin.
Table des matières
1. Propriétés physiques de l’acide gallique
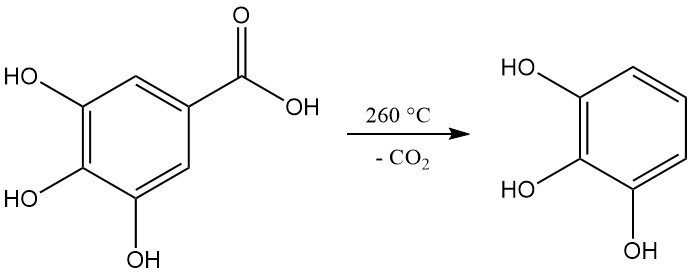
L’acide 3,4,5-trihydroxybenzoïque, communément appelé acide gallique, se présente sous la forme d’une poudre cristalline blanche à jaune pâle. La cristallisation à partir de solutions aqueuses donne une forme monohydratée en forme d’aiguilles soyeuses, qui se décompose en pyrogallol et en dioxyde de carbone lors d’un chauffage à 258–263 °C.
L’acide gallique est soluble dans l’eau chaude, l’éthanol, l’éther diéthylique et l’acétone et insoluble dans le benzène et le chloroforme.
Les propriétés physiques de l’acide gallique sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [149-91-7] |
| Formule chimique | C7H6O5 |
| Masse moléculaire | 170,12 g/mol |
| Point de fusion | 258–263 °C (décomposition) |
| Température de sublimation | 210 °C |
| Densité à 25 °C | 1,694 g/cm3 |
| pKa1 à 30 °C | 2,33 |
| pKa2 | 8,85 |
2. Réactions chimiques de l’acide gallique
La molécule d’acide gallique contient deux groupes fonctionnels : des groupes hydroxyles (phénoliques) et un groupe acide carboxylique. Les deux groupes fonctionnels ayant des hydrogènes acides, ils peuvent réagir pour former de nombreux esters, éthers et sels, dont l’acide digallique (1).

Les solutions d’acide gallique, en particulier celles contenant des sels de métaux alcalins, sont sensibles à l’oxydation par l’oxygène atmosphérique, ce qui entraîne un changement de couleur vers le brun comme dans le pyrogallol.
La décarboxylation de l’acide gallique par chauffage à une température supérieure à 260 °C produit du pyrogallol.
L’acide gallique est un puissant agent réducteur capable de réduire les sels d’or ou d’argent en leurs formes élémentaires.
La réaction de l’acide gallique avec les sels de fer (III) produit un complexe bleu intense, qui est utilisé dans la formulation des colorants d’encre. L’encre de noix de galle, composée d’acide gallique et de sulfate de fer (II), subit une oxydation à l’air pour générer le complexe bleu fer (III)-acide gallique.
Le chauffage de l’acide gallique avec de l’acide sulfurique concentré produit de l’hexahydroxyanthraquinone (2 ; acide rufigallique) par réaction de condensation.

La réaction avec le chlorhydrate de p-nitrosodiméthylaniline forme des dérivés d’oxazine.
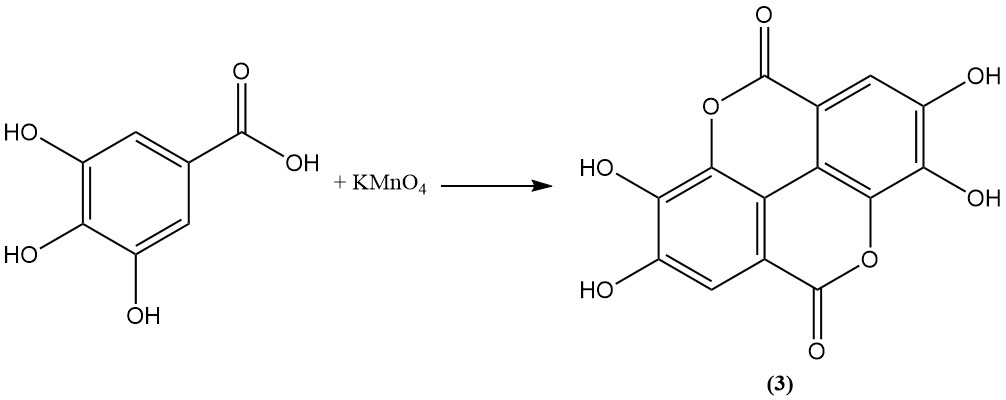
L’oxydation de l’acide gallique à l’aide d’acide arsénique, de permanganate, de persulfate ou d’iode conduit à la formation d’acide ellagique (3).
Le groupe acide carboxylique de l’acide gallique peut être estérifié avec des alcools par estérification azéotropique ou par la méthode de Fischer en utilisant de l’alcool avec de l’acide chlorhydrique.

Les dérivés éther-ester de l’acide gallique peuvent être préparés par alkylation à l’aide de sulfates de dialkyle ou d’halogénures d’alkyle en présence d’une base ou en utilisant du diazométhane.
Le groupe hydroxyle en position 4 est plus réactif que les autres. L’hydrolyse partielle de l’acide 3,4,5-triméthoxybenzoïque à l’aide d’acides forts produit l’acide 4-hydroxy-3,5-diméthoxybenzoïque (4) (acide syringique).

3. Production d’acide gallique
L’acide gallique est un constituant de nombreux agents tannants et il existe sous forme libre ou est lié aux tanins dans des sources naturelles telles que le divi-divi, l’écorce de chêne, les noix de galle, les racines de grenade, le sumac et le thé.
L’acide gallique est produit à partir d’extraits aqueux de noix de galle riches en tanins par hydrolyse acide à l’aide d’acide sulfurique à 110–120 °C ou par traitement alcalin.

Il peut également être préparé par clivage enzymatique du tannin par la tannase ou par fermentation à l’aide de moisissures comme Penicillium glaucum et Aspergillus niger.
Des procédés de fermentation en milieu solide ou submergé utilisant des champignons filamenteux libres ou immobilisés, tels que R. oryzae et Aspergillus foetidus, sont développés pour hydrolyser l’acide tannique à partir de poudre de tara à faible coût ou d’autres matières premières riches en tannin à faible coût.
L’acide gallique est ensuite extrait de la solution de fermentation par l’éther diéthylique, ce qui permet d’obtenir des rendements élevés d’environ 95 %. Ce processus de biosynthèse consomme moins d’énergie que l’hydrolyse acide classique.
4. Utilisations de l’acide gallique
L’acide gallique est utilisé dans la production d’encre de noix de galle ferreuse et de divers colorants, notamment l’anthragallol, la gallocyanine, la galloflavine et l’acide rufigallique.
Les esters de gallate, en particulier le gallate de méthyle (gallicine) et le gallate de propyle, sont utilisés comme antioxydants et conservateurs alimentaires pour les graisses.
L’acide gallique est utilisé comme agent réducteur dans les produits pharmaceutiques (Dermatol, Airol et sel de bismuth de l’acide gallique) et comme matière première pour la production de l’alcaloïde hallucinogène, la mescaline, et du triméthoprime (antibiotique à large spectre).
L’acide gallique est utilisé dans la production de révélateurs photographiques, tout comme le pyrogallol, qui est utilisé dans l’absorption d’oxygène et la synthèse de colorants azoïques.
Il est également utilisé dans le processus de tannage du cuir en raison de ses propriétés astringentes et comme antioxydant et conservateur dans les produits alimentaires.
De nombreuses études examinent les bienfaits potentiels de l’acide gallique pour la santé en tant qu’agent antioxydant, antimicrobien, anti-inflammatoire et anticancéreux.
5. Toxicologie de l’acide gallique
Les études de toxicité sur l’acide gallique indiquent une faible toxicité aiguë et subaiguë. Cependant, le composé a induit des effets hémorragiques chez les embryons de poulet, ce qui souligne la nécessité de limiter les doses.
Les valeurs DL50 rapportées sont de 320 mg/kg (souris, intraveineuse), 5000 mg/kg (lapin, orale) et 4300 mg/kg (souris, intrapéritonéale). Les valeurs LDL0 sont de 800 mg/kg (souris, intrapéritonéale) et 5 mg/kg (souris, sous-cutanée, 1 jour de gestation)
L’exposition humaine à l’acide gallique se produit principalement dans le cadre professionnel et par l’alimentation.
Il est classé comme mutagène et tératogène.
Références
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Organic and Fatty Acid Production, Microbial. – https://www.sciencedirect.com/science/article/abs/pii/B9780123739445001565
- Toxicity of natural products. – https://www.sciencedirect.com/science/article/abs/pii/B9780128243152011891
- https://pubchem.ncbi.nlm.nih.gov/compound/Gallic-Acid
