Acide dichloroacétique: Production et Applications

L’acide dichloroacétique est un liquide incolore et très corrosif, il émet des vapeurs acides qui peuvent provoquer une irritation des muqueuses. Il présente une miscibilité complète avec l’eau et peut se dissoudre facilement dans divers solvants organiques tels que les alcools, les cétones, les hydrocarbures et les hydrocarbures chlorés.
Table des matières
1. Propriétés physiques de l’acide dichloroacétique
Les propriétés physiques de l’acide dichloroacétique, également connu sous le nom d’acide 2,2-dichloroéthanoïque, comprennent :
- Masse molaire : 128,95 g/mol
- Point d’ébullition : 192 °C (101,3 kPa)
- Point de congélation : 13,5 °C
- Densité : 1.564
- Pression de vapeur : 0,19 kPa (à 20 °C)
- Constante de dissociation : 5×10–² mol/L (à 18 °C)
2. Propriétés chimiques de l’acide dichloroacétique
L’acide dichloroacétique possède deux atomes de chlore qui sont sensibles aux réactions de substitution.
Lorsqu’il réagit avec des composés aromatiques, il forme des acides diaryl acétiques, tandis qu’en présence de phénol, des acides diphénoxy acétiques sont produits.
Comparé à l’acide chloroacétique, l’acide dichloroacétique présente une plus faible sensibilité à l’hydrolyse. Cependant, la présence d’impuretés d’acide dichloroacétique dans l’acide chloroacétique peut entraîner une réticulation lors de la production de carboxyméthylcellulose (CMC) et d’amidons. L’effet de réticulation résultant peut être souhaitable ou indésirable, selon l’application prévue du produit final.
3. Méthodes de production d’acide dichloroacétique
L’approche la plus économiquement viable pour produire de l’acide dichloroacétique implique l’hydrolyse du chlorure de dichloroacétyle.

De plus, un rendement de 90% d’acide dichloroacétique pur à 98% peut être obtenu par l’hydrolyse du pentachloroéthane à l’aide d’acide sulfurique à 88–99% ou en oxydant la 1,1-dichloroacétone avec de l’acide nitrique et de l’air.
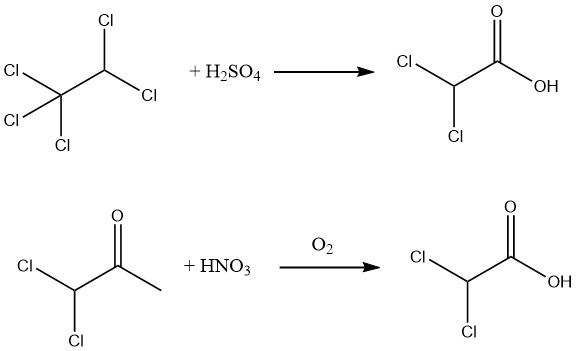
L’hydrolyse de l’ester méthylique, facilement obtenu par estérification de l’acide dichloroacétique brut, permet la production d’acide dichloroacétique exceptionnellement pur.

De plus, la déchloration catalytique de l’acide trichloroacétique ou du trichloroacétate d’éthyle avec de l’hydrogène sur un catalyseur au palladium fournit une méthode d’obtention d’acide dichloroacétique et de dichloroacétate d’éthyle.

La séparation de l’acide dichloroacétique pur des autres acides chloroacétiques s’avère difficile par des moyens physiques tels que la distillation fractionnée, principalement en raison des légères différences de points d’ébullition, en particulier entre les acides di- et trichloroacétique.
Cependant, des colonnes de distillation efficaces peuvent fractionner de manière satisfaisante des mélanges d’esters. De plus, les mélanges des sels dérivés des trois acides chloroacétiques peuvent être lavés avec de l’eau, de l’alcool ou des solutions eau-alcool pour dissoudre préférentiellement le dichloroacétate, qui peut ensuite être acidifié pour obtenir de l’acide dichloroacétique pur.
En laboratoire, l’acide dichloroacétique peut être synthétisé en faisant réagir l’hydrate de chloral avec du cyanure de potassium ou de sodium :
Cl3CCH(OH)2 + KCN → HCN + KCl + Cl2CHCOOH
4. Applications de l’acide dichloroacétique
L’acide dichloroacétique trouve une utilité comme réactif de test dans les mesures analytiques pendant la fabrication des fibres, en particulier pour la production de poly (téréphtalate d’éthylène).
Il sert également de désinfectant médicinal, agissant comme substitut du formol.
L’acide dichloroacétique joue un rôle essentiel en tant qu’agent débloquant dans la synthèse en phase solide des oligonucléotides. Pour accomplir cette fonction, un acide dichloroacétique de haute pureté, sensiblement dépourvu de chloral (trichloroacétaldéhyde), est nécessaire.
En synthèse organique, l’acide dichloroacétique, notamment sous la forme de ses esters, sert de matière première réactive. Il est utilisé dans la production d’acide glyoxylique, d’acides dialcoxy et diaroxy, ainsi que de sulfamides, servant ainsi de composé intermédiaire crucial.
Référence
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
