Acide benzènesulfonique : production, réactions et utilisations

L’acide benzènesulfonique est un composé chimique de formule C6H5SO3H et d’un poids moléculaire de 158,17 g/mol. Il a été synthétisé pour la première fois en 1834 par E. Mitscherlich par réaction du benzène et de l’acide sulfurique concentré, donnant de l’acide benzènesulfonique et de la diphénylsulfone.
Une application industrielle notable de l’acide benzènesulfonique est la production de phénol par fusion alcaline, une réaction lancée par A. Wurtz et A. Kekulé en 1867 et affinée plus tard par P. O. Degener en 1878.
Historiquement, l’acide benzènesulfonique a joué un rôle important dans la production de phénol. Cependant, ces derniers temps, des méthodes alternatives de synthèse du phénol ont gagné en popularité dans les processus industriels.
Table des matières
1. Propriétés physiques de l’acide benzènesulfonique
La cristallisation de l’acide benzènesulfonique à partir d’une solution aqueuse forme un hydrate contenant 1,5 molécules d’eau, ce qui donne des aiguilles déliquescentes avec un point de fusion de 43 à 44 °C. Le monohydrate a un point de fusion de 45 à 46 °C.
L’acide anhydre est distillable sans décomposition à 171-172 °C (0,13 mbar). Il démontre une solubilité élevée dans l’eau et l’éthanol, une solubilité modérée dans le benzène et une insolubilité dans l’éther diéthylique et le disulfure de carbone.
Le benzènesulfonate de sodium se décompose à environ 450 degrés Celsius. Il est soluble dans 1,75 partie d’eau à 30 °C et 0,8 partie d’eau bouillante. La cristallisation à partir de solutions aqueuses donne le sel avec une mole d’eau de cristallisation. Les sels de calcium et de baryum sont également solubles dans l’eau.
| Propriété | Valeur |
|---|---|
| Apparence | Cristaux déliquescents blancs ou solide cireux |
| Poids moléculaire | 158,17 g/mol |
| Densité | 1,48 g/cm³ |
| Point de fusion (hydrate) | 43-44 °C |
| Point de fusion (monohydrate) | 45-46 °C |
| Point de fusion (anhydre) | 65-66 °C |
| Point d'ébullition | 274 °C (se décompose) |
| Point de distillation (anhydre) | 171-172 °C (0,13 mbar) |
| Point d'éclair | 113 °C |
| Solubilité dans l'eau | Élevé |
| Solubilité dans l'alcool | Élevé |
| Solubilité dans le benzène | Modéré |
| Solubilité dans l'éther diéthylique | Insoluble |
| Solubilité dans le sulfure de carbone | Insoluble |
| Constante diélectrique (solution aqueuse) | 0,2 |
| pKa | −2,8 |
| Odeur | Piquant |
| Température de décomposition (benzènesulfonate de sodium) | 450 °C |
| Solubilité du benzènesulfonate de sodium dans l'eau | 1,75 partie à 30 °C 0,8 partie au point d'ébullition |
| Solubilité des sels de calcium et de baryum dans l'eau | soluble dans l'eau |
| Dangers | Corrosif pour les yeux, la peau et les voies respiratoires |
2. Réactions chimiques de l’acide benzènesulfonique
L’acide benzènesulfonique présente des réactions typiques d’un acide sulfonique aromatique fort. L’hydrolyse acide à 175 °C produit du benzène et de l’acide sulfurique.

Une sulfonation supplémentaire avec de l’acide sulfurique fumant produit de l’acide 1,3-benzènedisulfonique, qui peut être converti en acide 1,3,5-benzènetrisulfonique et en acide diphénylsulfone disulfonique.

L’acide benzènesulfonique subit une réaction de type Friedel-Crafts avec le benzène pour former de la diphénylsulfone.
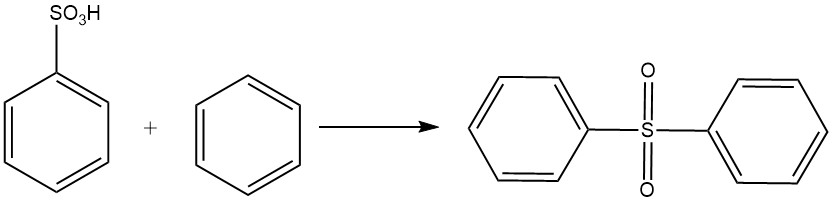
L’acide benzènesulfonique réagit avec l’hydroxyde de sodium à 320-350 °C pour produire du phénolate de sodium selon l’équation suivante :
C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3 + H2O
Cette réaction a constitué la base de la première production industrielle de phénol.

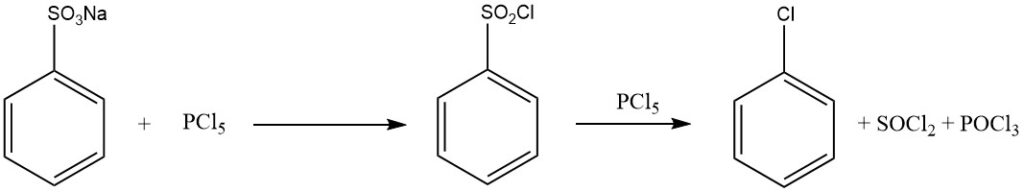
Traitement de l’acide benzènesulfonique avec des halogénures de phosphore (PCl5, PBr5), L’acide chlorosulfurique, le chlorure de thionyle ou le phosgène donnent des halogénures de sulfonyle :
C6H5SO2OH + PCl5 → C6H5SO2Cl + POCl3 + HCl
Lorsqu’un excès de PCl5 est utilisé, le chlorobenzène se forme selon :
C6H5SO2Cl + PCl5 → C6H5Cl + SOCl2 + POCl3
L’anhydride benzènesulfonique est synthétisé en faisant réagir l’acide benzènesulfonique avec P2O5, SOCl2, ou SO3. Il peut également être formé comme produit secondaire lors de la préparation de l’acide benzènesulfonique ou du chlorure de benzènesulfonyle. Cependant, dans ces cas, ils ne sont souvent pas observés en raison de leur hydrolyse rapide dans un acide aqueux.

Les esters benzènesulfoniques sont produits par la réaction d’acide sulfonique ou de chlorures de sulfonyle avec des alcools ou des éthers.
3. Production d’acide benzènesulfonique
L’acide benzènesulfonique est produit par une réaction exothermique entre le benzène et l’acide sulfurique, comme décrit par l’équation :
C6H6 + H2SO4 → C6H5SO3H + H2O

CROOKS et WHITE ont étudié cette réaction, en examinant l’impact de la température et de la composition du mélange de sulfonation sur la vitesse de réaction. Il est à noter que la réaction cesse à une concentration spécifique d’acide sulfurique, généralement comprise entre 74 et 78 %, en fonction de la température et de la génération d’eau.
En milieu industriel, une partie de l’acide sulfurique (généralement 45 % dans le procédé classique) reste non convertie et sert de solvant et de diluant. Cela limite la formation de sous-produits, en particulier de diphénylsulfone, à un faible rendement. L’excès d’acide peut être éliminé industriellement en ajoutant du carbonate de calcium.
Diverses méthodes ont été utilisées pour réduire l’excès d’acide sulfurique et améliorer la formation de sulfone :
- Utiliser de l’oléum ou du trioxyde de soufre au lieu de l’acide sulfurique.
- Extraire l’acide benzènesulfonique du mélange réactionnel avec le benzène.
- Élimination de l’eau de réaction par voie azéotropique avec du benzène.
a. Le processus classique impliquait la sulfonation du benzène pour produire de l’acide benzènesulfonique qui était utilisé dans la synthèse du phénol, puis le sulfite sous-produit formé était utilisé pour neutraliser l’acide benzènesulfonique. Ce processus n’a qu’un intérêt historique.
b. Une approche plus moderne est la sulfonation continue avec de l’oléum, également connue sous le nom de procédé Monsanto. Cela implique de pomper du benzène et de l’oléum dans une cascade de six cuves de sulfonation. Reliés par des canalisations de trop-plein, ces cuves permettent au mélange réactionnel de s’écouler de l’une à l’autre.
Les deux premiers récipients sont refroidis tandis que les autres sont chauffés. La neutralisation du mélange réactionnel avec du sulfite de sodium ou une solution d’hydroxyde de sodium élimine l’excès d’acide sulfurique. Le sulfate de sodium précipite et peut être séparé dans des centrifugeuses. La solution de benzènesulfonate de sodium résultante peut être concentrée et convertie directement en phénol ou séchée.
Ce procédé utilise de l’oléum contenant 35,6 % de trioxyde de soufre et maintient des conditions de température spécifiques. Seulement environ 1 % du benzène est converti en diphénylsulfone au cours de ce processus.
c. Une autre méthode est le processus d’extraction continue, qui consiste à introduire un excès de benzène et de trioxyde de soufre dans un récipient sous agitation vigoureuse. Une couche de benzène saturée d’acide benzènesulfonique se forme dans la partie supérieure du récipient et est lavée en continu avec de l’eau ou une solution d’hydroxyde de sodium dans un deuxième récipient agitateur.
Le benzène séparé peut être renvoyé dans le récipient de réaction. Dans ce procédé, la consommation d’acide sulfurique est de 1 260 kg pour 1 000 kg de benzène converti et la formation de diphénylsulfone est inférieure à 2 %.
d. La méthode d’élimination azéotropique de l’eau de réaction consiste à chauffer de l’acide sulfurique avec une concentration de, par exemple, 79 % à 170 °C dans un récipient de sulfonation et à introduire de la vapeur de benzène finement divisée.
Ce processus sulfone une partie de la vapeur de benzène, tandis que la partie non convertie élimine en continu l’eau du mélange réactionnel. Le mélange condensé de benzène et de vapeur d’eau peut être séparé et le benzène est renvoyé à l’évaporateur.
Une opération continue de ce procédé donne un produit final contenant 80,2 % d’acide benzènesulfonique et 14,3 % d’acide sulfurique, tandis qu’une opération par lots donne un produit final contenant 93,1 % d’acide sulfonique et 4,8 % d’acide sulfurique. L’ajout de benzènesulfonate de sodium au mélange de sulfonation peut maintenir la formation de sulfone en dessous de 2 %.
4. Utilisations de l’acide benzènesulfonique
L’acide benzènesulfonique est utilisé pour diverses applications dans diverses industries comme suit :
- Production de phénol : l’acide benzènesulfonique est utilisé pour produire du phénol par fusion avec de l’hydroxyde de sodium ou par hydrolyse de ses sels, généralement le sel de sodium.
- Synthèse des tensioactifs : L’acide benzènesulfonique est un composant clé dans la création de tensioactifs, notamment lorsqu’il est combiné avec des sels métalliques ou d’amines. Des sels d’acide benzènesulfonique, tels que le benzènesulfonate de sodium (Ludigol) et le benzènesulfonate de monoéthanolamine, sont utilisés comme tensioactifs dans les formulations de détergents à lessive.
- Synthèse de médicaments pharmaceutiques : l’acide benzènesulfonique est impliqué dans la synthèse de médicaments pharmaceutiques, où ces médicaments sont produits sous forme de sels de benzènesulfonate. Ces sels sont reconnus sous la dénomination commune internationale sous le nom de bésilates ou sous le nom adopté aux États-Unis sous le nom de bésylates.
- Catalyseur acide : La nature acide de l’acide benzènesulfonique le rend précieux comme catalyseur acide dans diverses réactions chimiques.
- Standardisation des colorants : Le sel de sodium de l’acide benzènesulfonique joue un rôle dans la standardisation des colorants, garantissant la précision des processus de coloration.
- Récupération de pétrole améliorée par tensioactif (SEOR) : L’acide benzènesulfonique est essentiel dans le SEOR, une technique qui implique l’utilisation de tensioactifs pour faciliter l’extraction du pétrole des réservoirs, également connue sous le nom de rinçage des tensioactifs.
5. Toxicologie de l’acide benzènesulfonique
Dose létale 50 (DL50) chez le rat (orale) : 1 170 milligrammes par kilogramme
Effets de l’exposition à court terme :
L’acide benzènesulfonique est une substance corrosive qui peut causer de graves dommages aux yeux, à la peau et aux voies respiratoires. Il est également corrosif en cas d’ingestion.
Symptômes d’exposition :
- Inhalation : Toux, mal de gorge, essoufflement, respiration difficile, sensation de brûlure, maux de tête, nausées
- Peau : Rougeur, sensation de brûlure, douleur, brûlures cutanées
- Yeux : Rougeur, douleur, brûlures profondes graves
- Ingestion : Maux de gorge, sensation de brûlure dans la gorge et la poitrine, douleurs abdominales, choc ou collapsus
Références
- Benzenesulfonic Acids and Their Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_507
- BENZENESULFONIC ACID – ILO
- https://www.acs.org/molecule-of-the-week/archive/b/benzenesulfonic-acid.html
- https://en.wikipedia.org/wiki/Benzenesulfonic_acid
- Benzenesulfonic Acid (Surfactant)
