2-Méthyl-1-propanol : Propriétés, Production et Utilisations
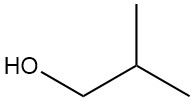
Le 2-méthyl-1-propanol, également connu sous le nom d’isobutanol ou alcool isobutylique, est un composé organique de formule chimique (CH3)2CHCH2OH. C’est un liquide incolore avec une odeur caractéristique que l’on retrouve dans les produits naturels ainsi que dans les huiles de fusel.
L’isobutanol est un produit de la fermentation de la mélasse (comprenant environ 74 % de la teneur totale en alcool). Historiquement, l’isobutanol était isolé des huiles de fusel. Cependant, le développement de la synthèse de l’huile isobutylique, un processus analogue à la synthèse du méthanol à partir de monoxyde de carbone et d’hydrogène, a permis une production à grande échelle.
Dans les années 2010, un changement important s’est produit avec l’hydroformylation du propylène (synthèse oxo) qui est devenue la méthode de production dominante actuelle en raison de son efficacité et de sa rentabilité. Cela a conduit à une augmentation significative de la taille du marché de l’isobutanol.
Table des matières
1. Propriétés physiques du 2-méthyl-1-propanol
Le 2-méthyl-1-propanol (isobutanol) est un liquide incolore avec une odeur caractéristique. Ses vapeurs sont irritantes pour les muqueuses et peuvent avoir un effet narcotique à forte concentration. Cet alcool est miscible avec les solvants organiques courants.
Le tableau 1 résume les principales propriétés physiques du 2-méthyl-1-propanol :
| Propriété | Valeur |
|---|---|
| Masse molaire | 74,12 g/mol |
| Point de fusion (mp) | -107,9 °C |
| Point d'ébullition (pb) | 107,9 °C |
| Densité à 20°C (d20) | 0,8027 g/mL |
| Indice de réfraction à 20°C (n20) | 1.3959 |
| Viscosité à 20°C | 4,0 mPa·s |
| Chaleur spécifique (30-80°C) | 2,5263 J·g-1·K-1 |
| Chaleur de vaporisation | 578,83 J/g |
| Chaleur de combustion | 35,981 kJ/g |
| Pression critique | 48 hPa |
| Température critique | 265 °C |
| Tension superficielle (température ambiante) | 23,0 mN/m |
| Constante diélectrique (température ambiante) | 18,8 |
| Indice d'évaporation (éther = 1) | 24 |
| Solubilité dans l'eau |
20°C : 8,5 % en poids 30°C : 7,5 % en poids |
| Solubilité de l'eau dans l'isobutanol |
20°C : 15 % en poids 30°C : 17,3 % en poids |
| Point d'éclair | 28 °C |
| Limites d'inflammation dans l'air | 1,7-10,9 % en volume |
| Température d'inflammation | 430 °C |
2. Propriétés chimiques du 2-méthyl-1-propanol
2.1. Déshydratation
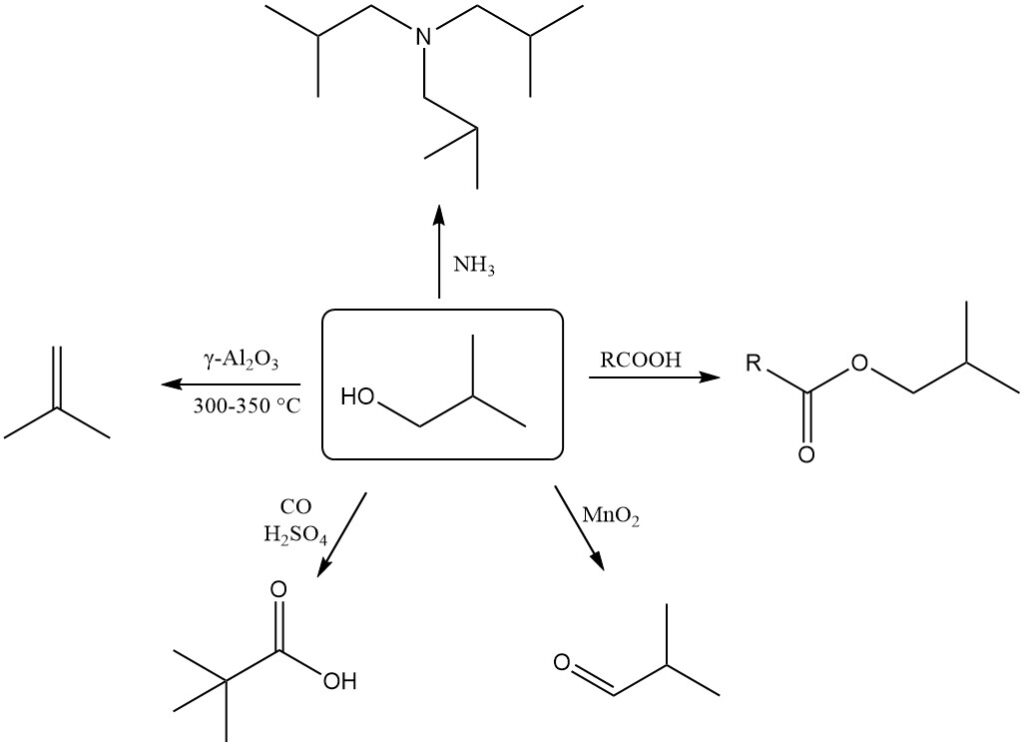
Le 2-méthyl-1-propanol subit facilement une déshydratation pour former du 2-méthylpropène (isobutène). Cette réaction nécessite un catalyseur γ-Al2O3 à 300-350°C et permet d’obtenir une conversion presque quantitative avec une sélectivité de plus de 90 % pour l’isobutène.
2.2. Oxydation
Le 2-méthyl-1-propanol peut être déshydrogéné en 2-méthylpropanal (isobutanal) en utilisant des agents oxydants comme le dioxyde de manganèse ou des catalyseurs appropriés à des températures plus élevées.
La réaction de Koch-Haaf convertit le 2-méthyl-1-propanol en acide triméthylacétique en présence de monoxyde de carbone et d’acide sulfurique avec un rendement élevé (89 %).
L’oxydation de l’isobutanol avec du dichromate en présence d’acide sulfurique produit de l’acide isobutyrique.
2.3. Alkylation
Le 2-méthyl-1-propanol peut être utilisé pour des réactions d’alkylation avec de l’ammoniac ou des amines pour former diverses alkylamines.
2.4. Estérification
Le 2-méthyl-1-propanol réagit avec les acides inorganiques et organiques en présence de catalyseurs pour former des esters isobutyliques, ainsi qu’avec des chlorures d’acide et des anhydrides d’acide.
3. Production de 2-méthyl-1-propanol
Trois procédés industriels importants pour la production de 2-méthyl-1-propanol (isobutanol) sont les suivants :
- Hydroformylation du propène (synthèse oxo)
- Hydrogénation catalytique du monoxyde de carbone
- Réaction d’homologation
3.1. Hydroformylation du propène (synthèse oxo)
La synthèse oxo est la méthode la plus efficace et la plus rentable pour la production à grande échelle d’isobutanol. Il s’agit de faire réagir le propène avec un gaz de synthèse (un mélange de monoxyde de carbone et d’hydrogène) sous haute pression et température, en utilisant un catalyseur approprié comme des complexes carbonyle de rhodium ou de cobalt.
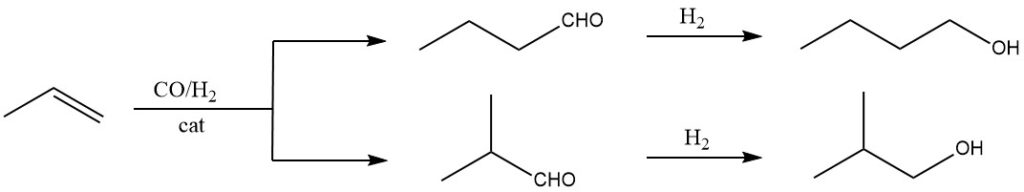
Il forme un mélange d’alcools (1-butanol et 2-méthyl-1-propanol). Il s’agit actuellement de la méthode dominante pour la synthèse de l’isobutanol en raison de sa haute efficacité, de sa rentabilité et de ses matières premières facilement disponibles.
Pour plus d’informations, consultez l’article à propos du 1-butanol.
3.2. Hydrogénation catalytique du monoxyde de carbone
Alors que la synthèse du méthanol à base de CO-H2 a connu un succès commercial dans les années 1920, les procédés analogues pour les alcools supérieurs ont été peu adoptés. Malgré leurs promesses initiales, ces procédés ont largement disparu du paysage industriel.
Parmi ces tentatives historiques, la synthèse de l’huile d’isobutanol BASF revêt une importance particulière. Ce procédé utilisait un catalyseur de synthèse de méthanol modifié par KOH sous haute pression (30 MPa) et température élevée (430 °C) pour convertir le CO et le H2 en un mélange de produits contenant environ 50 % de méthanol, 11 à 14 % de 2-méthyl-1- le propanol (isobutanol) et d’autres composants.
Cependant, BASF a abandonné la synthèse de l’huile d’isobutanol en 1952 alors que des alternatives plus économiques émergeaient. Les voies de synthèse oxo et pétrochimiques offraient une efficacité et une rentabilité supérieures à la fois pour l’isobutanol et son précieux produit secondaire, le 2-méthylpropène.
3.3. Réaction d’homologation
Ce processus consiste à étendre la chaîne carbonée d’un alcool plus court tel que le méthanol, l’éthanol ou l’alcane pour produire de l’isobutanol. Bien que techniquement possibles, les réactions d’homologation appropriées pour la production d’isobutanol ne sont pas très efficaces ni commercialement viables par rapport à l’hydroformylation du propène.
Les tentatives visant à produire directement du butanol à partir de méthanol et d’éthanol facilement disponibles via des réactions d’homologation n’ont pas donné de résultats significatifs. Malgré des efforts de recherche approfondis, l’isobutanol n’a été obtenu qu’en quantités mineures comme sous-produit.
D’autres procédés incluent l’hydratation du 2-méthylpropène avec 65 % d’acide sulfurique pour former de l’isobutanol.

4. Utilisations du 2-méthyl-1-propanol
Le 2-méthyl-1-propanol est souvent comparé au 1-butanol en raison de leurs applications similaires et est utilisé dans diverses industries en raison de son coût inférieur et de ses propriétés uniques.
Solvants et additifs :
- Substitut économique du 1-butanol : le 2-méthyl-1-propanol sert de solvant, de diluant et d’additif dans la nitrocellulose. et résines synthétiques, agents de nettoyage et encres d’imprimerie.
- Compatibilité des résines : Il est capable de dissoudre les résines cétoniques, les résines phtalates, résines d’urée et résines de mélamine-formaldéhyde et est utilisée commercialement, bien qu’elle est moins efficace comme solvant pour les résines phénol-formaldéhyde que le 1-butanol.
Esters :
- Acétate d’isobutyle : Cet ester est utilisé comme solvant pour les graisses, le caoutchouc chloré, le polystyrène et les résines de coumarone.
- Plastifiants : Les esters d’acides phtalique, adipique et dicarboxylique, ainsi que l’ester d’acide phosphorique du 2-méthyl-1-propanol, trouvent une utilisation comme plastifiants, notamment pour le PVC et ses copolymères et pour les dérivés cellulosiques.
- Esters de l’acide chlorophénoxyacétique : Les esters isobutyliques des acides 2,4-dichloro- et 2,4,5-trichlorophénoxyacétique ont une activité herbicide.
Autres applications :
- Antigel pour essence : 2-méthyl-1-propanol possède des propriétés antigel dans l’essence.
- Extraction du phosphate d’ammonium : Son utilisation comme agent d’extraction dans la récupération du phosphate d’ammonium ajoute à sa polyvalence.
5. Toxicologie du 2-méthyl-1-propanol
Le 2-méthyl-1-propanol présente une faible toxicité aiguë par voie orale et cutanée, mais une toxicité aquatique modérée. Les effets comprennent une irritation des yeux et de la peau.
Toxicité aiguë :
- Faible toxicité orale : la DL50 chez le rat est de 2 460 mg/kg (la plus basse publiée).
- Faible toxicité cutanée : la DL50 chez le lapin est de 3 400 mg/kg.
- Toxicité aquatique modérée : la CL50 pour les poissons est de 1 330 mg/L (96 h).
- Narcose observée chez la souris à une exposition élevée par inhalation (6 400 ppm).
Effets locaux :
- Irritation oculaire modérée à sévère chez le lapin.
- Irritation cutanée modérée chez le lapin (exposition 24h).
Effets chroniques :
- Des études à long terme suggèrent une cancérogénicité possible chez le rat (données limitées).
- Mutagène pour la bactérie E. coli.
Exposition humaine :
- Aucune irritation oculaire observée chez l’homme à une faible exposition par inhalation (100 ppm).
- L’exposition à des vapeurs mixtes (acétate de butyle et 2-méthyl-1-propanol) a provoqué une kératite vacuolaire chez les travailleurs (l’agent causal n’est pas clair).
- L’application cutanée a provoqué un léger érythème et une hyperémie chez l’homme.
Limites d’exposition :
- TLV (valeur limite de seuil) : 50 ppm (TWA), 75 ppm (STEL) [ACGIH]
- MAK (Concentration maximale autorisée) : 100 mL/m³ [Allemagne]
- TRGS 900 (Limite d’exposition professionnelle) : 100 mL/m³ [Allemagne]
Référence
- Butanols ; Encyclopédie Ullmann de chimie industrielle. – https://onlinelibrary.wiley.com/doi/10.1002 /14356007.a04_463.pub3
