Producción y usos del sulfato de amonio
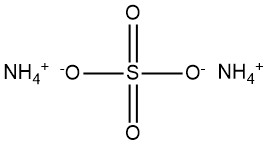
El sulfato de amonio, (NH4)2SO4, surgió como un compuesto importante durante el siglo XIX producido a partir del amoníaco que se encuentra en el gas de los hornos de coque. A principios del siglo XX, la síntesis industrial de amoníaco ganó importancia, lo que llevó a la adopción del sulfato de amonio como agente fertilizante.
Sin embargo, con el tiempo, su importancia ha disminuido debido a la llegada de fertilizantes más potentes a base de nitrógeno. En particular, su aplicación ha persistido a menor escala para aplicaciones industriales específicas.
Desde aproximadamente 1960, el sulfato de amonio ha experimentado una producción creciente como coproducto en los procedimientos de síntesis orgánica. En determinadas regiones, el sulfato de amonio se produce a partir del yeso.
Tabla de contenido
1. Propiedades del sulfato de amonio
El sulfato de amonio, que tiene una masa molar de 132,14 g/mol, muestra una densidad de 1,77 g/cm³ a 20 °C, junto con una capacidad calorífica específica promedio de 1,423 J/g·K dentro del rango de temperatura de 2 a 55 °C. .
Su estructura cristalina es bipiramidal rómbica. Es de destacar que el tamaño y la forma de los cristales pueden verse influenciados por sustancias presentes en la solución cristalizante, y este aspecto es importante en la producción comercial.
El comportamiento térmico del sulfato de amonio es complejo. A presión atmosférica, no se puede fundir sin sufrir descomposición, lo que provoca la liberación de amoníaco y la formación de bisulfato.
Sin embargo, en el caso del sulfato de amonio anhidro puro, la presión de vapor del amoníaco permanece prácticamente cero hasta que se alcanza los 80 °C. Al superar los 300 °C, la descomposición da como resultado la generación de N2, SO2, SO3 y H2O, además de amoníaco.
El sulfato de amonio no forma hidratos. El cambio de calor al disolver 1 mol de sal en 400 mol de agua es de +9,92 kJ a 18 °C, mientras que el calor integral de la solución es de +6,57 kJ/mol a 30 °C. El calor diferencial de solución para una solución saturada es +6,07 kJ/mol a 30 °C.
El sulfato de amonio exhibe delicuescencia solo por encima del 80% de humedad relativa, lo que permite su almacenamiento en aire seco y la adición de amoníaco reduce significativamente su solubilidad.
A 10 °C, la solubilidad disminuye de 73 g (NH4)2SO4 en 100 g de agua a aproximadamente 18 g de sal en 100 g de una solución acuosa de amoníaco al 24,5 %.
La solubilidad del sulfato de calcio en una solución de sulfato de amonio es aproximadamente el doble en comparación con su solubilidad en agua. Esta propiedad favorece la reacción del yeso o la anhidrita con soluciones que contienen carbonato de amonio – sulfato de amonio.
El compuesto permanece insoluble en disolventes orgánicos típicos. La disolución de sulfato de amonio en etanol, propanol, butanol, acetona, piridina y disolventes similares da como resultado la formación de dos fases distintas: una fase acuosa y una fase de disolvente orgánico.
Las soluciones de sulfato de amonio y sus soluciones en ácido sulfúrico no corroen el acero inoxidable especial Cr-Ni. El hierro y el aluminio no reaccionan en soluciones amoniacales. En los casos en que las soluciones contengan sustancias corrosivas para el acero inoxidable (p. ej., Cl−), los recipientes se pueden proteger recubriéndolos con ladrillos resistentes a los ácidos.
2. Producción de sulfato de amonio
El sulfato de amonio se produce industrialmente a partir de:
- gas de coque
- Amoníaco y ácido sulfúrico.
- Síntesis orgánicas, como la producción de caprolactama.
- Yeso, amoníaco y dióxido de carbono.
2.1. Del gas de coquería
La utilización de gas de coque como precursor para la producción de sulfato de amonio ha experimentado una disminución sustancial en las últimas décadas. Esta tendencia puede atribuirse al cierre parcial de las acerías y a los avances en los métodos de coquización que producen cantidades reducidas de sulfato de amonio.
En el método directo, se introduce gas de horno de coque sin tratar en ácido sulfúrico, lo que da como resultado sulfato de amonio contaminado con derivados de alquitrán pigmentados.
Alternativamente, el proceso indirecto implica la extracción de amoníaco del gas del horno de coque mediante lavado con agua, seguido de la liberación utilizando una suspensión de cal y combinándola con ácido sulfúrico.
2.2. De amoníaco y ácido sulfúrico
El calor generado por la reacción entre el amoníaco y el ácido sulfúrico puede vaporizar eficazmente el agua si la concentración de ácido supera el 70%. La reacción se representa de la siguiente manera:
2NH3(g) + H2SO4(l) → (NH4)2SO4(s) ΔH = -274 kJ/mol
En la práctica contemporánea, la reacción tiene lugar dentro de saturadores, dispositivos derivados de cristalizadores de evaporación utilizados anteriormente. El proceso saturador integra neutralización y cristalización en un solo aparato.
El ácido sulfúrico se introduce por el lado de succión, mientras que el amoníaco se añade por el lado de presión de una bomba de circulación forzada. La solución metaestable resultante produce partículas que varían de 0,5 a 3 mm de tamaño tras la cristalización.
Los procesos continuos de descarga, centrifugación, secado y enfriamiento facilitan el aislamiento del sulfato de amonio. Para facilitar el crecimiento de los cristales, se añaden pequeñas cantidades de ácido fosfórico, urea o sales inorgánicas.
2.3. Coproducto en síntesis orgánicas
El sulfato de amonio surge como subproducto durante la síntesis de intermediarios de fibras sintéticas, como caprolactama, acrilonitrilo y metacrilato de metilo, junto con la producción de ácido fórmico y acrilamida.
La fuente importante es la producción de caprolactama, vital para la síntesis de nailon 6. Los procesos tradicionales con caprolactama producen entre 2,5 y 4,5 toneladas de sulfato de amonio por tonelada de lactama. Procesos recientes desarrollados por diversas entidades han logrado reducir este rango a 1,7 – 1,8 toneladas por tonelada de lactama.
2.4. De yeso
Tanto la anhidrita como el yeso reaccionan con NH3 y CO2:
CaSO4(·2H2O) + (NH4)2CO3 → (NH4)2SO4 + CaCO3(·2H2O)
Este proceso, establecido por BASF durante la Primera Guerra Mundial, sigue siendo importante en regiones con acceso limitado al ácido sulfúrico, incluidas India, Pakistán y Turquía. El yeso finamente molido se expone a una solución de carbonato de amonio en una cascada de recipientes agitados.
La mezcla de reacción, que comprende una solución de carbonato de calcio y sulfato de amonio, se filtra usando filtros de vacío giratorios. El carbonato de calcio lavado resultante se utiliza para fertilizar cal, producir nitrato de calcio y amonio, materia prima para vidrio o relleno para caucho o PVC.
La solución de sulfato de amonio ligeramente turbia se filtra usando filtros prensa, seguida de acidificación con H2SO4 y procesamiento a través de cristalizadores de evaporación de múltiples etapas para producir sulfato de amonio de grano grueso.
Una técnica alternativa, el Proceso de Ingeniería Continental, introduce directamente NH3 y CO2 en una lechada de yeso dentro de un recipiente agitado cilíndrico alto.
2.5. Otros procesos
Varios métodos que utilizan SO2 y oxígeno atmosférico han quedado obsoletos.
Existe un interés creciente en los procesos que emplean amoníaco para eliminar el SO2 de los gases de escape de las centrales eléctricas, como por ejemplo el proceso Walther que utiliza un lavado en dos etapas de los gases de escape libres de polvo para generar una solución concentrada de sulfito de amonio. A continuación, esta solución se oxida con oxígeno atmosférico y se seca por pulverización para obtener polvo de sulfato de amonio, que posteriormente se granula.
3. Usos del sulfato de amonio
La aplicación predominante del sulfato de amonio es como fertilizante, con un uso industrial mínimo. En los países industrializados, el sulfato de amonio generalmente surge como coproducto o subproducto y se vende principalmente como fertilizante, especialmente en las regiones en desarrollo.
Su contenido limitado de nitrógeno en los países industrializados contribuye a mayores costos de transporte por unidad de nitrógeno en comparación con otros fertilizantes a base de nitrógeno.
En África y Asia, el sulfato de amonio tiene una función importante como fertilizante para los cultivos de arroz, té y caucho. Sin embargo, en regiones como Europa, Estados Unidos y Brasil, frecuentemente forma parte de fertilizantes compuestos y complejos.
En la industria, el (NH4)2SO4 se utiliza para la síntesis de persulfatos, agentes ignífugos y polvos extintores.
Demuestra utilidad en procesos de curtido, así como en industrias como la fotografía, la textil y la producción de vidrio. Además, el sulfato de amonio sirve como fuente de nutrientes para cultivos de levaduras y bacterias.
Referencias
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Industrial Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128498910000035
Preguntas más frecuentes
El sulfato de amonio es un compuesto químico compuesto de nitrógeno, hidrógeno, azufre y oxígeno. Se encuentra comúnmente como un polvo cristalino blanco o una sustancia granular.
La fórmula química del sulfato de amonio es (NH4)2SO4.
El sulfato de amonio se utiliza principalmente como fertilizante para suministrar nutrientes esenciales, en particular nitrógeno y azufre, a las plantas. Además, sirve para fines industriales como la producción de persulfatos, agentes ignífugos y polvos extintores. Encuentra aplicaciones en curtido, fotografía, textiles, fabricación de vidrio y como nutriente para cultivos bacterianos y de levadura.
La masa molar del sulfato de amonio es de aproximadamente 132,14 gramos por mol (g/mol).
El sulfato de amonio se puede producir mediante varios procesos. Un método implica hacer reaccionar gas amoníaco con ácido sulfúrico para producir (NH4)2SO4. También puede derivarse del gas de coquería o como coproducto en síntesis orgánicas. Otro enfoque implica la reacción del yeso con amoníaco y dióxido de carbono.
El sulfato de amonio generalmente se considera seguro para los humanos cuando se usa de acuerdo con las pautas y regulaciones establecidas. Como fertilizante, presenta un riesgo mínimo cuando se aplica correctamente a los cultivos.
